Levitra enthält Vardenafil, das eine kürzere Wirkdauer als Tadalafil hat, dafür aber schnell einsetzt. Männer, die diskret bestellen möchten, suchen häufig nach levitra kaufen ohne rezept. Dabei spielt die rechtliche Lage in der Schweiz eine wichtige Rolle.
Microsoft word - mb4_antibiotika_final.doc
Auswirkungen des Einsatzes von
Antibiotika und Substanzen mit antibiotischer
Wirkung in der Landwirtschaft und im
Ein Literatur-Review
Materialienband Nr. 4
Dr. med. M. Dettenkofer, M. Ackermann, M. Eikenberg, H. Merkel
Unterauftrag des Instituts für Umweltmedizin und Krankenhaushygiene
(Dir.: Prof. Dr. med. F.D. Daschner) am Universitätsklinikum Freiburg, im Rahmen des
Teilvorhabens "Ernährung und Produkte" (Öko-Institut e.V.) des
Verbundforschungsvorhabens "Ernährungswende - Strategien für sozial-ökologische
Transformationen im gesellschaftlichen Handlungsfeld Umwelt- Ernährung-Gesundheit"
Institut für Umweltmedizin und Krankenhaushygiene am Universitätsklinikum Freiburg
Freiburg, August 2004

„Ernährungswende – Strategien für sozial-ökologische Transformationen im gesellschaft-lichen Handlungsfeld Umwelt-Ernährung-Gesundheit" ist ein Gemeinschaftsprojekt des Forschungsverbundes Ökoforum unter der Leitung des Öko-Instituts. Beteiligt sind folgende Verbundpartner:
Öko-Institut e.V. – Institut für angewandte Ökologie
Institut für sozial-ökologische Forschung (ISOE)
Institut für ökologische Wirtschaftsforschung (IÖW)
KATALYSE Institut für angewandte Umweltforschung
Österreichisches Ökologie Institut für angewandte Umweltforschung
Nähere Informationen zum Forschungsvorhaben auf der Projekt-Website unter www.ernaehrungswende.de, dort finden Sie den Materialienband auch als pdf-Datei zum Download.
Das Projekt wird im Rahmen des Förderschwerpunkts „Sozial-ökologische Forschung" des Bundesministeriums für Bildung und Forschung (BMBF) gefördert.
Einleitung und Hintergrund. 3
Wirkung von antibiotischen Substanzen . 4
Antibiotikaresistenzen . 4
Aufgabenstellung und Untersuchungsumfang . 8
Aufgabenstellung. 8
Untersuchungsrahmen . 9
Methoden . 10
Recherchestrategie . 10
Datenbankübergreifende Suche (Überblick) . 10
Datenbankenauswahl. 12
Einordnung der gefundenen Literatur in 'Levels of Evidence' - Critical Appraisal . 12
Ergebnisse . 15
Systematische Datenbankrecherche. 15
Quantitatives Ergebnis . 15
Qualitatives Ergebnis. 15
Level IIIa (Zeitgleicher, nichtrandomisierter Kohortenvergleich) . 16
Level IIIb (Historischer, nichtrandomisierter Kohortenvergleich) . 20
Level IIIc (Fall-Kontroll Studien) . 21
Erweiterte Recherchen. 23
Einsatz von Antibiotika . 23
Entwicklung von Mengen und Art der eingesetzten Substanzen . 27
Gesetzliche Vorgaben und Richtlinien zum Einsatz von Substanzen mit antibiotischer Wirkung in Lebensmitteln . 31
Rückstände von antibiotisch wirksamen Substanzen in Lebensmitteln . 33
Einsatz von Antibiotika in der Fischzucht und Aquakultur . 34
Einsatz von Antibiotika bei Lebensmitteln pflanzlicher Herkunft . 35
Desinfektionsmittel und Resistenz. 36
Konservierungsmittel . 36
Rückstände antimikrobieller Substanzen in der Umwelt . 36
Zusammenfassung der Ergebnisse und Diskussion. 38
Problematik des Einsatzes von antibiotischen Substanzen in der Lebensmittelproduktion . 38
Risiken durch Antibiotikaeinsatz in der Produktion von Lebensmitteln tierischer Herkunft. 38
Entstehung von Resistenzen durch Gabe von Antibiotika in der Tiermast. 39
Übertragung von Resistenzen von Tieren aus der Tiermast auf den Menschen . 40
Übertragung von resistenten Krankheitserregern von Tieren auf den Menschen (Zoonosen). 40
Risiken durch die Verwendung von Antibiotika in der Fischzucht . 41
Risiken durch Antibiotika bei der Erzeugung von Lebensmitteln pflanzlicher Herkunft. 41
Risiken durch Desinfektionsmittel . 42
Probleme bei Rückständen antimikrobieller Substanzen in Lebensmitteln. 42
Risiken durch Konservierungsmittel . 43
Risiken durch Rückstände antimikrobieller Substanzen in der Umwelt . 43
Alternative Möglichkeiten der Leistungssteigerung (Probiotika und Prebiotika). 44
Fazit und Handlungsempfehlungen . 44
Literaturverzeichnis . 47
Anhang . 67
Zugelassene Antibiotika/Antimykotika in der Landwirtschaft und Lebensmittelproduktion [Quelle: BfR 2004]. 67
Datenbankbeschreibungen . 68
Suchstrategien für die verschiedenen Datenbanken. 78
Durchsuchte Datenbanken: Food, antibiotics, Doublettencheck. 82
Artikel der Evidenzlevel IV und V . 87
Abkürzungsverzeichnis . 88
1 Einleitung
Hintergrund
1.1 Einleitung
Mit der Entdeckung des Antibiotikums Penicillin durch Alexander Fleming im Jahre 1928
und dessen breiter Verfügbarkeit ab Mitte der 1940er Jahre wurde es möglich, zuvor häufig
tödlich verlaufende Infektionskrankheiten erfolgreich und ursächlich zu behandeln. Doch
schon bald verlor das Penicillin bei einigen Bakterienstämmen seine Wirksamkeit. Die Bak-
terien hatten Resistenzen gegen Penicillin entwickelt. Antibiotika wie das Penicillin sind
natürliche Stoffwechselprodukte von Mikroorganismen, die Bakterien abtöten (bakterizide
Wirkung) oder das Wachstum bzw. die Vermehrung der Bakterienzellen hemmen (bak-
teriostatische Wirkung). Neben diesen natürlichen Produkten werden auch chemisch ver-
änderte (teilsynthetische) Antibiotika und chemisch (d.h. vollsynthetisch) hergestellte Sub-
stanzen (Chemotherapeutika) zur Behandlung und Prophylaxe von Infektionserkrankungen
eingesetzt. Natürliche und teilsynthetische Antibiotika sowie die antibakteriell wirksamen
Chemotherapeutika werden als Antiinfektiva (Stoffe mit antibiotischer Wirkung) zusammen-
gefasst. Ein Beispiel für ein natürliches Antibiotikum ist das bereits erwähnte Penicillin, das
von einem Schimmelpilz (Penicillium notatum) gebildet wird. Beispiele für antibakteriell wirk-
same Chemotherapeutika sind das Salvarsan, das zur Bekämpfung der Syphillis eingesetzt
wurde oder die Substanzgruppe der Sulfonamide, die bis zum heutigen Tage therapeutische
Verwendung finden. Gegen Pilze wirksame Substanzen werden analog als Antimykotika
bezeichnet, gegen Parasiten wirksame z.B. als Anthelminthika (Würmer).
Seit der Entdeckung des Penicillins bis heute sind zahlreiche Substanzen als Antibiotika
entwickelt worden und auf den Arzneimittelmarkt gelangt. Gegen jedes dieser Mittel sind
nach unterschiedlich langer Zeit des Einsatzes Resistenzentwicklungen bekannt geworden.
Selbst gegen Linezolid, eine Substanz aus der Stoffgruppe der Oxazolidinone, die seit
mehreren Jahrzehnten die erste neue Gruppe von Antiinfektiva darstellt, entstanden nach
kurzer Zeit Resistenzen [Tsiodras et al 2001, Gonzales et al 2001]. Resistenzentwicklung
wurde zunächst für diese Substanz als äußerst unwahrscheinlich eingeschätzt, da Linezolid
sehr früh den Prozess der Proteinbiosynthese von Bakterien stört.
1.2 Wirkung von antibiotischen Substanzen
Ob ein Antiinfektivum bakterizid oder bakteriostatisch wirkt, ist abhängig vom Antiinfektivum,
den Bakterien, der Konzentration des Antiinfektivums und der Wirkungsdauer. Ein Anti-
infektivum, das in einer hohen Konzentration einen bestimmten Bakterienstamm abtöten
kann, ist bei einer geringeren Konzentration oft nur noch in der Lage, das Wachstum zu
hemmen. Bei einer noch niedrigeren Konzentration können sich die Bakterien unter Um-
ständen schon wieder verlangsamt vermehren. Unter diesen Bedingungen haben be-
sonders diejenigen Bakterien einen Vorteil, die gegen das Antiinfektivum Resistenz-
mechanismen aufweisen.
Die Antiinfektiva haben spezifische Angriffspunkte an den Mikroorganismen, an denen sie
ansetzen und wichtige Stoffwechselwege blockieren. Angriffspunkte sind der Zellwand-
aufbau, die Proteinbiosynthese, der Aufbau der Erbsubstanz (DNS), das Ablesen der
genetischen Information von der Erbsubstanz und die Überführung in Genprodukte wie
1.3 Antibiotikaresistenzen
Einige Bakterien besitzen Eigenschaften oder Mechanismen, die antibiotisch wirksame
Substanzen in ihrer Wirkung abschwächen oder unwirksam zu machen. Manche Bakterien
bilden Biokatalysatoren (Enzyme), die das Antibiotikum in unwirksame Bestandteile zer-
legen können. Ein Beispiel hierfür sind die Penicillinasen oder Betalaktamasen - Enzyme,
die Penicillin oder andere Betalaktam-Antibiotika (z.B. Cephalosporine) zerlegen können.
Diese Enzyme waren dafür verantwortlich, dass das Penicillin bei einigen Staphylo-
kokkenstämmen nicht mehr wirksam war. Andere Bakterien haben eine veränderte Ziel-
struktur, an der das Antibiotikum nicht mehr richtig binden oder ausreichend wirksam
werden kann. Ein Beispiel hierfür ist ein verändertes Protein für die Bindung von Penicillin
und den anderen Betalaktamantibiotika (Penicillin bindendes Protein, PBP) bei den
krankenhaushygienisch bedeutsamen Methicillin-resistenten Staphylococcus aureus-
Stämmen (MRSA). Weitere Methoden sind Veränderungen der Zellmembran, die ein Er-
reichen der Zielstruktur durch das Antibiotikum verhindern oder die Bildung von Transport-
kanälen (Porinen), die Antibiotika aus den Bakterienzellen aktiv heraus befördern können,
bevor sie auseichend wirksam werden.
Alle diese Resistenzeigenschaften werden durch die Erbsubstanz der Bakterien festgelegt,
die in Chromosomen und Plasmiden vorliegt. Letztere sind ringförmige Strukturen, die
zumeist Gene tragen, die für das Überleben der Keime nicht unbedingt lebensnotwendig
sind. Sie können sich im Gegensatz zu den Chromosomen unabhängig von der Teilung der
Bakterien vermehren. Plasmide tragen häufig Gene für Resistenzen. Auf den Chromosomen
befindet sich die Erbsubstanz, die für die Bakterien existenziell ist. Es können jedoch auch
weitere Gene in die Chromosomen aufgenommen (integriert) werden, insbesondere so-
genannte mobile oder ‚springende' Gene (Transposons). Das Genmaterial der Chromo-
somen wird bei der Vermehrung durch Zellteilung größtenteils auf die Nachkommenschaft
der Bakterien weitergegeben. Oft kommt es jedoch auch zu Veränderungen des gene-
tischen Materials (Mutationen). Mutationen können zu Veränderungen lebenswichtiger
Proteine führen und nachfolgend das Absterben der betroffenen Bakterien zur Folge haben.
Veränderungen können aber auch zu Antibiotikaresistenzen führen, wenn z.B. ein Ziel-
protein für ein Antibiotikum verändert wird.
Man spricht von ‚natürlicher Resistenz' eines Erregers, wenn er per se unempfindlich gegen-
über einem Antibiotikum ist. Sie ist immer spezifisch für eine Spezies, bei allen Keimen einer
Spezies vorhanden und üblicherweise chromosomal kodiert. Sie beeinflusst das Wirkungs-
spektrum eines Antibiotikums: Fehlt dem Keim beispielsweise die Zielstruktur für ein Anti-
biotikum, kann er auch nicht gegen die entsprechende Substanz empfindlich sein.
Im Gegensatz dazu spricht man von ‚erworbener Resistenz', wenn ein natürlicherweise
sensibles Bakterium (der sog. ‚Wildtyp') resistent gegen ein Antibiotikum geworden ist. Diese
erworbene Resistenz beruht auf Mutationen in chromosomaler DNA oder der Aufnahme
beziehungsweise Veränderung von Plasmiden oder Transposons. Klinisch wird noch
zwischen primärer und sekundärer Resistenz unterschieden, wobei im ersten Fall gemeint
ist, dass ein Mikroorganismus schon vor Therapiebeginn resistent ist und im anderen Fall,
dass dies erst unter oder nach einer Therapie geschieht (Resistenzentwicklung). Der Einsatz
von Antibiotika bedeutet somit auch, dass diejenigen Keime einer Spezies, deren Wachstum
durch das Antibiotikum nicht eingeschränkt oder unterbunden wird, einen Wachstumsvorteil
gegenüber den anderen besitzen. Es kommt zu einer Selektion von resistenten Erregern
gegenüber dem verwendeten Antibiotikum, die häufig auch ohne fortbestehenden Selek-
tionsdruck weiter bestehen kann. Die Gesamtmenge des eingesetzten Antibiotikums ist ein
Faktor für den entstehenden Selektionsdruck. Ständige Exposition gegenüber einem Anti-
biotikum erzeugt einen hohen Selektionsdruck. Die Entstehung von Resistenzen hat i.d.R.
zur Folge, dass Antibiotika nicht mehr wirksam eingesetzt werden können.
Wichtige Erreger mit antimikrobieller Resistenz, die beim Menschen Infektionen verursachen
Methicillin-resistente
Staphylococus aureus (MRSA)
Vancomycin-resistente
Multi-resistente Non-Fermenter (Pseudomonas spp, Acinetobacter baumannii)
Extended Spectrum Beta-Lactamasen (ESBL; z.B. Ceftazidim-resistente Kleb-
siellen oder Escherichia coli)
Chinolon-resistente
Escherichia coli
Penicillin-resistente
Fluconazol-resistente
Candida spp.
Multiresistente
Mycobacterium tuberculosis
Für Deutschland existiert für diese Keime nach dem Infektionsschutzgesetz (§4 Abs.2
Nr. 2b) und den Ausführungen des Robert Koch-Instituts [RKI 2000] eine Aufzeichnungs-
pflicht bzw. für Mycobacterium tuberculosis eine (Labor-)Meldepflicht.
Verbreitung und Übertragung von Resistenzen
Resistente Mikroorganismen können zwischen verschiedenen ökologischen Nischen
wechseln (z.B. von Tieren zu Menschen oder umgekehrt). Es sind Wechsel durch direkten
Kontakt (z.B. über Lebensmittel) oder indirekte Übertragungen (z.B. durch Wasser) möglich.
Die Übertragungen lassen sich im Labor nachweisen, weil sowohl z.B. die Bakterienstämme
als auch das genetische Material, das die Resistenzeigenschaften bestimmt (Resistenz-
determinanten) in diesem Fall aus allen Nachweisorten identisch sind.
Bakterien haben die Möglichkeit, genetisches Material (z.B. auch Resistenzgene) nicht nur
an ihre Nachkommenschaft (vertikaler Gentransfer), sondern auch an andere Bakterien
weiterzugeben (horizontaler Gentransfer) z.B. durch einen Austausch von kleinen Chromo-
somen, Plasmiden oder Transposons (s.o.). Die Übertragung von Resistenzgenen kann
auch zwischen verschiedenen Arten von Bakterien erfolgen (z.B. Weitergabe des vanA-Gens
für Vancomycinresistenz von Enterokokken auf Listerien oder Staphylococcus aureus). Auch
zwischen Bakterien mit unterschiedlich aufgebauter Zellwand (grampositive und gram-
negative Bakterien) ist ein Austausch möglich sowie eine Weitergabe genetischen Materials
von Bakterien zu Pilzen oder Pflanzen. Der Resistenzaustausch erfolgt auch in Abwesenheit
von Antibiotika und ist ungerichtet.
Medizinisch bedeutend ist ein Austausch von Resistenzgenen zwischen harmlosen Be-
siedlern (Kommensalen), wie z.B. Enterokokken in der natürlichen Darmflora von Mensch
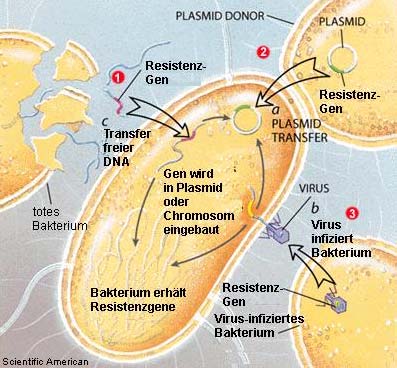
und Tier und pathogenen Bakterien (Krankheitserregern), weil die Behandlung von Infek-
tionen durch die erworbene Antibiotikaresistenz erschwert wird. Beim horizontalen Gen-
transfer sind die Stämme oder Arten unterschiedlich, und das weitergegebene Erbmaterial,
auf dem die Resistenzeigenschaften gespeichert sind (Resistenzdeterminanten), ist iden-
Ko-Selektion
Die Exposition gegenüber einem Antibiotikum kann zu einer Selektion weiterer Resistenzen
führen. Die Resistenz gegen ein Antibiotikum kann gekoppelt sein mit der Resistenz gegen
ein anderes Antibiotikum oder eine andere Antibiotika-Gruppe (Kreuzresistenz). Das
genetische Material, das die Resistenzdeterminanten trägt (z.B. die Plasmide), trägt häufig
Determinanten für mehrere Resistenzen gleichzeitig. Mit der Selektion dieser Bakterien
durch die Gabe eines Antibiotikums kommt es zur gleichzeitigen Resistenzentwicklung
gegenüber den anderen Antibiotika, gegen die Resistenzgene vorhanden sind (Ko-
Die Gabe nur eines Antibiotikums kann daher zu einer Selektion von Bakterien mit mehreren
Resistenzen (Multiresistenz) führen.
Abbildung 1:
Übertragung von Resistenzen
[Quelle: Scientific American]
Abbildung 2:
Übersicht: Ausbreitung von Resistenzen
2 Aufgabenstellung und Untersuchungsumfang
2.1 Aufgabenstellung
Ziel der vorliegenden Arbeit ist es,
eine Übersicht über Antibiotika und Substanzen mit antibiotischer Wirkung zu
geben, die in der Landwirtschaft eingesetzt werden. Ein besonderer Schwerpunkt wird hierbei auf die Fleischproduktion gelegt. Die Übersicht bezieht sich auf Charakteristika der eingesetzten Substanzen, ihre Anwendungsgebiete und die eingesetzten Mengen. Des Weiteren wird die Entwicklung bei der Antibiotika-anwendung in der Landwirtschaft in den letzten 10 Jahren hinsichtlich eingesetzter Substanzen und Mengen dargestellt.
den wissenschaftlichen Erkenntnisstand über die Auswirkungen der Verwendung
von Antibiotika und Substanzen mit antibiotischer Wirkung in der Landwirtschaft darzustellen. Rückstände und Metaboliten dieser Substanzen werden in die Betrachtung einbezogen. Zentral ist hierbei die Frage, welche Substanzen für Mensch und Umwelt ein Risiko darstellen. Auch hier wird ein Betrachtungs-schwerpunkt auf die Fleischproduktion und damit die Tierhaltung gelegt.
die mit der Antibiotikaanwendung in der Landwirtschaft und im Lebensmittelsektor
verbundenen Risiken zu bewerten.
2.2 Untersuchungsrahmen
Die Bearbeitung der oben genannten Schwerpunkte wurde folgendermaßen begrenzt, um
die Übersichtlichkeit zu gewährleisten und den zur Verfügung stehen Rahmen einzuhalten:
Es wurde auf die detaillierte Beschreibung des Einsatzes der Verwendung von
einzelnen Antibiotika oder Stoffklassen in der Tiermedizin und Tierproduktion ver-zichtet.
Die Beschreibung des Einsatzes der ca. 70 zugelassenen und weiterer nicht mehr zugelassener Substanzen mit antibiotischer Wirkung bei den verschiedenen Tier-arten und Lebensaltern (respektive Produktionsstufen und Produkten) sowie der verschiedenen Einsatzgebiete und Erkrankungen (Indikationen) würde den Rahmen dieser Arbeit erheblich sprengen, ohne eine nennenswerte Verbesserung der Erkenntnisse zu bieten. Die einzelnen Substanzen waren deshalb in dieser Arbeit auch nicht Bestandteil der Suchwortliste bei der Datenbankabfrage.
Bei der Auswertung der Ergebnisse der Datenbankabfrage wurden ausschließlich
Artikel bis zum Evidenzlevel III komplett ausgewertet, da durch diese Artikel wissenschaftlich fundierte, belastbare Erkenntnisse erzielt werden und als Grund-lage für wissenschaftlich begründete Handlungsempfehlungen dienen können. Auf die komplette Darstellung der bei der Datenbankrecherche ermittelten Artikel der Evidenzlevel IV und V wurde folglich verzichtet, da sie keine sicheren wissen-schaftlichen Aussagen erlauben. Artikel dieser Evidenzlevel wurden jedoch teil-weise als ergänzende Information einbezogen, wenn dies zur Erläuterung des Hintergrundes sinnvoll erschien.
Die Arbeit sollte sich schwerpunktmäßig mit dem Einsatz von Antibiotika und Sub-
stanzen mit antibiotischer Wirkung in der Landwirtschaft mit Schwerpunkt in der Fleischproduktion beschäftigen. Bei der Auswahl der Suchworte und der Daten-banken wurde dies berücksichtigt. Im Rahmen dieser Suche konnten interessante Nebenaspekte (wie z.B. Risiken durch den Einsatz von Desinfektionsmitteln oder Antimykotika) in der Darstellung nur ergänzend einbezogen werden. Pflanzen-schutzmittel oder andere Substanzen mit vorwiegend antiparasitärer Wirkung wurden nicht berücksichtigt.
Auf die Beschreibung von Risiken durch Resistenzgene (Markergene) gen-
technisch veränderter Pflanzen in der Landwirtschaft wurde nicht eingegangen, weil sie nicht im Zusammenhang mit dem Einsatz von Antibiotika oder Substanzen mit antibiotischer Wirkung in der Landwirtschaft stehen.
Auf die vollständige oder auszugsweise Darstellung allgemein zugänglicher
Quellen (z.B. MRL-Wert-Tabellen, EU-Richtlinien und –Verordnungen oder Gesetze) wurde verzichtet. Inhaltliche Zusammenfassungen oder Auszüge aus solchen Quellen wurden nur dann angeführt, wenn sie für das Verständnis des thematischen Zusammenhangs notwendig waren.
3 Methoden
Die Auswirkungen des Einsatzes antibiotisch wirksamer Substanzen in der Landwirtschaft und die Auswirkungen auf Menschen, Tiere und Umwelt sind äußerst komplex. Die bisher zu diesem Themenbereich in großer Zahl erschienenen Publikationen beschäftigen sich daher nur mit Teilaspekten.
Bei der Suche nach verfügbarer Literatur wurden vornehmlich Arbeiten berücksichtigt, die nach anerkannten wissenschaftlichen Prinzipien erstellt wurden (wissenschaftliche Studien), da nur diese Studien eine wissenschaftlich belastbare sichere Aussage über die unter-suchten Themenbereiche ermöglichen (Evidenz). Darüber hinaus wurde bei bestimmten Fragestellungen auch auf andere Quellen wie z.B. Zeitungsartikel, journalistisch geprägte Artikel oder Veröffentlichungen von Interessenverbänden zurückgegriffen, v.a. dann, wenn zu diesen Themengebieten keine wissenschaftliche Literatur verfügbar war (z.B. bei den Verbrauchszahlen von Antibiotika).
3.1 Recherchestrategie
Ein Ziel der vorliegenden Arbeit war es, die verfügbaren veröffentlichten Artikel, die in Bezug
zur Aufgabenstellung stehen, über Datenbankrecherchen ausfindig zu machen. Die ver-
schiedenen durchsuchten Datenbanken besitzen jeweils unterschiedliche Schwerpunkte und
indexieren unterschiedliche Zeitschriften. Titelüberschneidungen können vorkommen (zu den
Profilen der durchsuchten Datenbanken siehe Anhang A2). Die Suchstrategien wurden in
Zusammenarbeit mit Frau E. Motschall (Med. Dokumentarin am Institut für Biometrie und
Medizinische Informatik der Universität Freiburg) erstellt.
3.2 Datenbankübergreifende Suche (Überblick)
Die grobe Suche über eine Vielzahl von Datenbanken erfolgte nach den Schlagworten in den
Titeln ‘TI=food? AND TI=antibioti?' in ‘Humanmedizin (breite Auswahl); Toxikologie / Literatur
(breite Auswahl); Veterinärmedizin; Arzneimittel (breite Auswahl)' (s. Tab. 1)
Ergebnisse der Indexsuche
Datenbank
Trefferzahl
Biosis Prev AB Backfile
Biosis Prev AB
CAB ABSTRACTS
CAB HEALTH
Cochrane Database of Systematic Reviews
DDF for subscribers
Derwent Biotechnology Resource
Derwent Drug Backfile
Derwent Drug File
Elsevier Biobase
Kluwer-Verlagsdatenbank für Volltexte
Oldmedline
SCISEARCH
Springer PrePrint
Springer-Verlagsdatenbank für Volltexte
Thieme-Verlagsdatenbank für Volltexte
XTOXLINE
3.3 Datenbankenauswahl
Nach Durchsicht der Memocards (Beschreibung, siehe Anhang A2) der Datenbanken, die
das Thema weitläufig abdecken, wurden folgende Datenbanken ausgewählt:
BIOTECHNOBASE, CAB Abstracts, Elsevier BIOBASE, EMBASE, FSTA, XToxline, Kluwer-
Verlagsdatenbank, SOMED, Springer-Verlagsdatenbank, Thieme-Verlagsdatenbank.
Zusätzlich standen über die ReDi Freiburg (Regionale Datenbank Information Baden-
Württemberg) zur Verfügung:
BIOSIS Previews, Current Contents - Agriculture, Biology & Environmental Sciences (OVID)
(nur 1994-1999), Science Citation Index / Web of Science, Journals@Ovid, GEOBASE,
MEDLINE, PreMedline Umwelt-CD und SwetScan.
Die Suche erfolgte unter Einschränkung des Zeitraumes von 1990 bis zur Gegenwart, soweit
diese Zeitspanne in der entsprechenden Datenbank verfügbar war. Es erfolgte eine
Beschränkung auf die Sprachen Englisch, Deutsch, Französisch, Italienisch, Niederländisch
und Spanisch. Das Grundprinzip aller Suchstrategien war die Verknüpfung der Begriffsfelder
'food', 'antibiotic', 'resistant', and 'food-producing animal'. Zum anderen Teil wurden Artikel
mit Handsuche gefunden.
Die Details zu den Datenbankrecherchen finden sich im Anhang A3.
3.4 Einordnung der gefundenen Literatur in 'Levels of Evidence' - Critical
Appraisal
Die recherchierte Literatur wurde einem sog. Critical Appraisal in Bezug auf den jeweiligen
Evidenzgrad unterzogen. Dafür wurde eine Einordnung gewählt, die sich an der speziell für
Literatur aus dem Bereich ‘Hospital Epidemiology and Infection Control‘ entwickelten
Methode von Mindorff et al. [1999] orientiert und die leicht modifiziert wurde (zusätzliche
Aufnahme von Metaanalysen randomisierter, kontrollierter Studien und von Experten-
meinungen / Konsensusberichten, s. Tabelle 2).
Dabei repräsentieren randomisierte, kontrollierte Studien bzw. Metaanalysen (systematische
Zusammenfassung der Daten verschiedener solcher Studien mit vergleichbarer Frage-
stellung und Design) den höchsten Evidenzlevel. Sie haben die höchste Aussagekraft in
Bezug auf die Fragestellung, da durch die Zufallsverteilung der Intervention eine systema-
tische Verfälschung der Ergebnisse weitgehend ausgeschlossen ist. In ihrer Bedeutung
folgen Kohortenstudien, Fall-Kontroll-Studien und Fallberichte (s. Tabelle 2, Erläuterung).
Einteilung der gefundenen Literatur in Levels of Evidence, modifiziert nach Mindorff et al. [1999]
Metaanalysen randomisierter, kontrollierter Studien
Randomisierte, kontrollierte Studien
Zeitgleicher, nichtrandomisierter Kohortenvergleich
Historischer, nichtrandomisierter Kohortenvergleich
IIIc Fall-Kontroll
Fallberichte ohne Kontrollgruppen; Epidemiologisch-mikrobiologische Studien
Berichte / Meinungen von Expertenkreisen, Konsensuskonferenzen und / oder Er-fahrung anerkannter Autoritäten
Erläuterung zu Tabelle 2:
Metaanalyse: Systematische Zusammenfassung der Daten verschiedener randomisierter, kontrollier-ter Studien (s.u.). Voraussetzungen sind v.a. vergleichbare Fragestellung und weitgehend über-einstimmendes Design der Studien. Durch die Metaanalyse entsteht im Vergleich zu Einzelstudien eine wesentlich bessere Datenbasis, um die Fragestellung beantworten zu können.
Randomisierte, kontrollierte Studien: Untersucht wird der Effekt einer Intervention (z.B. Medikamen-tengabe bei Patienten) im Vergleich zu einer Kontrol e (z.B. Gruppe von Patienten, die das zu unter-
suchende Medikament nicht erhält bzw. nur ein Plazebo ohne Wirkstoff). Durch die gleichzeitige Zufallsverteilung der Intervention (Randomisierung) reduziert die Möglichkeit einer systematischen Verfälschung der Ergebnisse weitgehend, z.B. das besonders schwerkranke Patienten das Medi-kament erhalten und die Kontrollpatienten lediglich leicht erkrankt sind. Erfolgt zusätzlich eine
,Verblindung' für die Probanden (Medikament und Plazebo sind nicht zu unterscheiden) und ggf. zusätzlich für den Untersucher (erst nach Abschluss der Untersuchung wird offengelegt, welche Per-sonen das Medikament und welche das Plazebo erhalten haben), so handelt es sich um eine rando-
misierte, kontrollierte und (doppelt-)verblindete Studie. Letztere schließt systematische Fehler (Bias) weitestgehend aus.
Bei Kohortenstudien / -vergleichen werden in unterschiedlichem Maß exponierte Gruppen bezüglich des Auftretens eines Merkmals verglichen (z.B. Häufigkeit von resistenten Bakterien in den Aus-scheidungen von Mastbetrieben mit Gabe von Leistungsförderern im Vergleich mit solchen ohne deren Einsatz). Ggf. kann auch mit einer historischen Vergleichsgruppe gearbeitet werden, was die
Möglichkeit eines Fehlers vergrößert (z.B. unvollständige Dokumentation).
Fall-Kontroll Studien gehen von umgekehrter Reihenfolge aus, d.h. das Auftreten eines Merkmals bei den 'Fällen' (z.B. einer Erkrankung durch resistente Bakterien) wird mit einer zurückliegenden Expo-
sition in Verbindung gebracht. Untersucht werden im Vergleich die Expositionsbedingungen von 'Kontrollen', bei denen das Merkmal nicht aufgetreten ist.
Fallberichte unterscheiden sich von den o.g. Studien insbesondere durch das Fehlen einer Kontroll-gruppe. Es ist daher nicht möglich zu unterscheiden, ob das festgestellte Ereignis (z.B. Infektion) mit einer Exposition in Verbindung zu bringen ist, oder ob andere, z.B. individuelle Faktoren entscheidend
sind. Ähnliches gilt für beschreibende Studien zur Mikrobiologie (z.B. zur Häufigkeit von resistenten Erregern in Fleischproben).
Quer zu der Einteilung nach dem Evidenzgrad wurde die gefundene Literatur nach inhalt-
lichen Schwerpunkten eingeteilt (s. Tabelle 3).
Inhaltliche Schwerpunkte der gefundenen Literatur
Fleisch (-produkte); auch Ei
Fisch / Gewässer
Rückstände antimikrobieller Substanzen
4 Ergebnisse
4.1 Systematische
4.1.1 Quantitatives
Ergebnis
Die Suche nach den oben beschriebenen Suchbegriffen und Kriterien ergab 243 relevante
Identische Artikel, die bei der Suche in mehreren Datenbanken gefunden wurden, wurden
nur einmal aufgeführt. Nach der Suchstrategie ermittelte Literatur, die inhaltlich nicht der
Fragestellung entsprach, wurde nicht berücksichtigt.
Die Ergebnisse der verschiedenen Datenbankrecherchen (einschließlich Dublettencheck)
sind im Anhang A4 ausführlich dargestellt.
4.1.2 Qualitatives
Ergebnis
In Tabelle 4 sind die gefundenen Artikel nach Evidenzlevel und quer dazu nach inhaltlichen
Schwerpunkten gruppiert.
Einteilung der relevanten Artikel
(Evidenzlevel und inhaltliche Schwerpunkte; Aufgrund von Mehrfachnennungen bei inhaltlichen Schwerpunkten einzelner Artikel Summenbildung nur in den Spalten der inhaltlichen Schwerpunkte möglich)
Inhaltlicher Schwerpunkt
Legende zu Tabelle 4:
Metaanalysen randomisierter, kontrollierter Studien
Randomisierte, kontrollierte Studien
IIIa Zeitgleicher,
nichtrandomisierter Kohortenvergleich
IIIb Historischer,
nichtrandomisierter Kohortenvergleich
IIIc Fall-Kontroll
Fallberichte ohne Kontrollgruppen; Epidemiologisch-mikrobiologische Studien
Berichte / Meinungen von Expertenkreisen, Konsensuskonferenzen
Fleisch (-produkte); auch Ei
Fisch / Gewässer
Rückstände antimikrobieller Substanzen
6 Mikrobiologie 7 keine
Bei der durchgeführten Literaturrecherche wurden keine nach Evidenzlevel I und II rele-
vanten Artikel gefunden. Die Summen der den Evidenzlevels zugeordneten Artikel sind in
Tabelle 5 aufgeführt.
Summen der Artikel nach Evidenzlevels
Evidenzlevel Summe
4.1.3 Level IIIa (Zeitgleicher, nichtrandomisierter Kohortenvergleich)
Da die Artikel aus den Evidenzlevels IIIa bis IIIc die beste wissenschaftliche Aussagekraft
bieten (s. Tab. 5), werden sie im Folgenden kurz zusammenfassend beschrieben. Insgesamt
8 Studien mit dem Level IIIa wurden gefunden:
Bager et al. 1996
Untersucht wurde der Zusammenhang zwischen dem Auftreten von High-Level- Resistenz
(MHK >64 µg / ml) bei Vancomycin-resistenten Enterococcus faecium (VREF) und der Ver-
wendung des Glykopeptid-Antibiotikums Avoparcin (AVO). Die retrospektive Kohortenstudie
verglich Gruppen von Geflügel- und Schweinefarmen von September 1994 bis April 1995 in
Dänemark, die AVO verwendet hatten und solche die AVO nicht verwendet hatten. Sowohl
Geflügelscharen als auch Schweineherden wiesen einen positiven Zusammenhang
zwischen Verwendung von AVO als Wachstums- und Leistungsförderer und Auftreten von
VREF auf. Bei Geflügel wurde der Zusammenhang zwischen Auftreten von VREF und der
Verwendung von AVO durch zusätzliche Gabe von Breitspektrum-Antibiotika beeinflusst.
Das Relative Risiko (RR; adjusted relative risk) betrug 2,9 (CI 1,4-5,9; CI=Konfidenzintervall).
Dies bedeutet, dass bei Einsatz von AVO ca. 3-mal häufiger VREF auftraten, wobei das
Relative Risiko (im Vergleich zu keiner Verwendung von AVO) bedingt durch die zusätzliche
Verwendung von Breitspektrum-Antibiotika statistisch angepasst wurde. Mit einer 95%-igen
Wahrscheinlichkeit war das Risiko mindestens 1,4-fach und höchstens 5,9-fach, das heißt
statistisch signifikant erhöht. Bei Schweinen war der Zusammenhang von ähnlich großer
Bedeutung, das RR betrug 3,3 (0,9-12,3). Damit ergeben sich Hinweise darauf, dass
Fleischzubereitung und -verzehr entsprechender Tiere ein potentielles Reservoir für VREF-
Infektionen beim Menschen darstellen.
Borgen et al. 2000
Untersucht wurden Geflügel und deren Geflügelfarmer in Norwegen 3 Jahre nach dem Ver-
bot von Avoparcin (AVO) auf das Vorhandensein (Prävalenz) von Vancomycin-resistenten
Enterokokken (VRE). Dazu wurden Stuhlproben von Farmern und deren Geflügel untersucht,
die einerseits AVO erhalten hatten (n=73) und solche, die AVO nie erhalten hatten (n=74).
Von jeder Farm wurden jeweils eine Probe des Geflügelhauses und eine Probe des Farmers
gesammelt. VRE wurden in 72 von 73 (99%) Geflügelproben der AVO-exponierten und in 8
von 74 (11%) Geflügelproben der nicht AVO-exponierten Gruppe gefunden (RR: 9,1, 95% CI
4,7-17,7). Ebenso wurden VRE gefunden in 13 von 73 (18%) Stuhlproben von Farmern mit
AVO-Exposition und in 1 von 74 (1%) Stuhlproben von Farmern ohne AVO-Exposition (RR:
13,2, 95% CI 1,8-98,2). Alle VRE-Isolate besaßen eine ausgeprägte Resistenz gegenüber
Vancomycin und wiesen das vanA-Gen auf (PCR). Es zeigte sich eine bemerkenswerte
Stabilität der vanA-Resistenzdeterminante auch ohne direkten Selektionsdruck.
Borgen et al. 2001
Auf vorhandene VRE wurden geschlachtete Brathähnchen und Truthähne von Farmen
untersucht, die zuvor AVO verwendet hatten, sowie geschlachtete Legehennen von Farmen,
die nie zuvor AVO verwendet hatten. Von 150 verschiedenen Farmen wurde jeweils ein totes
Tier ausgewählt. Von 30 aus 100 Proben der Brathähnchen und Truthähne wurden VRE
isoliert, aber nicht von den 50 Proben der Legehennen (hochsignifikanter Unterschied;
P<0,0001). Nach Durchführung eines Zwischenschrittes zur Anreicherung wurden aus 81
von 100 Proben der ersten und aus 9 von 50 Proben der zweiten Gruppe VRE isoliert
(Unterschied ebenfalls hochsignifikant; P<0,0001). Alle VRE-Isolate waren hochgradig
resistent gegenüber Vancomycin (MHK ≥ 256 µg / ml; high-level resistance) und besaßen
Diese Ergebnisse sind vergleichbar mit der Prävalenz von VRE in einer zuvor durchge-
führten Studie mit Untersuchung von Fäkalproben in norwegischem Geflügel [Borgen et al.
2000]. Die Studie erhärtet somit noch einmal den in der vorangegangenen Studie formu-
lierten Verdacht der hohen Prävalenz von VRE von Geflügel, welches zuvor AVO als Futter-
mittelzusatz erhielt.
Davies and Roberts 1999
In dieser Pilotstudie wurden jeweils 40 Enterokokken-Isolate aus zwei Gruppen von
geschlachteten Schweinen eines gewerblichen Schlachthauses auf Resistenz gegenüber
Avilamycin (Gemisch aus Oligosacchariden der Orthosomycin-Gruppe) und Tylosin (Makro-
lid) untersucht. Bei der Gruppe mit Antibiotika als Futtermittelzusatz waren 3 von 10 Isolaten
und bei der Gruppe ohne Antibiotika 6 von 9 Isolaten resistent gegenüber Tylosin. Bei der
begrenzten Zahl von untersuchten Schweinen und Enterococcus faecium-Isolaten wurde
keine Evidenz gefunden, dass die Fütterung mit diesen antibiotischen Wachstumsförderern
(Tylosin oder Avilamycin) zur Selektion resistenter Enterokokken führte
Del Campo et al. 2003
In dieser Studie wurde die Empfindlichkeit von Enterokokken-Isolaten aus Stuhlproben (er-
halten von 42 gesunden Probanden und von 43 mit der Essenszubereitung betrauten
Restaurantbeschäftigten) gegenüber 15 verschiedenen Antibiotika und ebenso die Präsenz
von Resistenz-Genen untersucht. Insgesamt 142 Enterococcus faecalis, 74 Enterococcus
faecium und 23 Enterococcus spp. Isolate mit unterschiedlicher Antibiotika-Empfindlichkeit
wurden getestet. Eine statistisch signifikant höhere Resistenzrate für Moxifloxacin (P<0,01),
Erythromycin (P<0,01), Glykopeptide und High-Level-Resistenz gegenüber Gentamicin
(P<0,05) wurde in der Gruppe der Restaurantbeschäftigten beobachtet, dagegen eine
geringere Resistzenz gegenüber Minocyclin (P<0,05). Ampicillin- oder Linezolid-resistente
Isolate wurden in keiner der beiden Gruppen gefunden. Die Studie zeigt, dass trotz der Ein-
führung des offiziellen Verbots von Antibiotika als Wachstums- und Leistungsförderer vor 4
Jahren Enterokokken-Isolate der Gruppe der Restaurantbeschäftigten mehr Resistenzen
aufweisen als die Gruppe der gesunden Probanden. Die Ergebnisse deuten hin auf Be-
ständigkeit von resistenten Klonen oder übertragbaren Resistenzelementen bei Farmen und
einen möglichen Austausch zwischen Lebensmittelprodukten und Menschen, oder mög-
licherweise die langfristige Beständigkeit von gewissen Klonen im Gastrointestinaltrakt der
Klare et al. 1995
High-level Glykopeptid-resistente, vanA-positive Enterococcus faecium-Isolate konnten in
Auftauflüssigkeit von gewerblich produziertem Tiefkühlgeflügel (Hähnchen und Truthähne;
keine Daten bezüglich vorangegangener Fütterung mit Avoparcin waren verfügbar) gefunden
werden. In 5 von 13 Isolaten von rohem Schweinehackfleisch 13 unterschiedlicher Metzger
wurden nach nächtlicher Inkubation in Fleischbrühe ebenso Gykopeptid-resistente Entero-
coccus faecium (vanA-Typ) gefunden. Keine Glykopeptid-resistenten Enterokokken konnten
in Fleischproben von Geflügel gefunden werden, deren Tiere kein AVO erhalten hatte.
Enterococcus faecium-Isolate wurden weiterhin in 12 Stuhlproben von 100 gesunden Pro-
banden aus Sachsen-Anhalt gefunden. Diese Ergebnisse deuten darauf hin, dass die
Lebensmittelkette eine bedeutende Rolle in der Verbreitung Glykopeptid-resistenter E.
faecium-Isolate spielt. Die Molekulartypisierung zeigt eine weite Verbreitung des vanA-Gens
unter Isolaten verschiedenen ökologischen Ursprungs.
Sáenz et al. 2001
Untersucht wurde Antibiotika-Resistenz in 474 Escherichia coli-Isolaten, die aus Stuhlproben
von Tieren (Brathähnchen, Schweine, Haustiere, Zuchtbullen und Pferde), von Menschen
(Patienten und gesunde, freiwillige Probanden) und von Lebensmittelprodukten tierischen
Ursprung gewonnen wurden. Ebenso wurden 3.260 E. coli-Isolate aus Stuhlproben von
erkrankten Patienten untersucht. Gefunden wurde eine hohe Resistenzrate von E. coli
gegenüber Nalidixinsäure, Ciprofloxacin, Gentamicin und Kanamycin bei Brathähnchen
(88%, 38%, 40% und 38% der Isolate) und bei tierischen Nahrungsmitteln (53%, 13%, 17%
und 40%). Dagegen wurden bei den Isolaten aus anderen Quellen Resistenzraten von 0-
21%, 0-3%, 0-7% und 5-20% ermittelt. Bei den klinischen E. coli Isolaten waren gegenüber
Ciprofloxacin 16% und gegenüber Gentamycin 8% resistent. Nähere Angaben zur Signifi-
kanz dieser Unterschiede wurden nicht vorgelegt.
Weiterhin wurden hohe Resistenzraten gegenüber Trimethoprim-Sulfamethoxazol und
Tetrazyklin in E. coli-Isolaten bei Brathähnchen, Schweinen und tierischen Nahrungsmitteln
gefunden. Die Daten unterstützen die Annahme, dass sich die Verwendung von Futtermittel-
zusätzen mit antibiotischer Wirkung auf die Übertragung von resistenten Keimen im
Lebensmittelsektor auswirkt.
Simonsen et al. 1998
Untersucht wurde die genetische Verwandtschaft zwischen VRE-Isolaten von Geflügel-
farmern (n=5) und von diesen produziertem Geflügel (n=7). Es handelte sich dabei um fünf
norwegische Farmen, die AVO verwendeten. Eine Puls-Feld Gel-Elektrophorese (PFGE) und
eine strukturelle Analyse von vanA-Resistenzelementen wurde durchgeführt. Enterokokken-
Isolate von Mensch und Tier einer Farm waren mit nicht zu unterscheidenden vanA-
Elementen und einer Einzelband Differenz in der PFGE Analyse genetisch eng verwandt.
Untersuchung von genetisch nicht in Beziehung zueinander stehenden vanA-Elementen mit
zwei Restriktionsenzymen offenbarte einen Pool von zwei unterschiedlichen vanA-Gruppen
von Genclustern in den 2 Reservoirs.
Die Ergebnisse zeigen, dass die Übertragung von vanA-Glykopeptid-Resistenz von Entero-
kokken zwischen Tier und Mensch bei Farmen unter AVO-Verwendung sowohl durch direkte
Übertragung von VRE als auch durch horizontale Verbreitung von Resistenzgenen auftreten
4.1.4 Level III b (Historischer, nichtrandomisierter Kohortenvergleich)
Insgesamt 3 Studien wurden im Level III b gefunden:
Boerlin et al. 2001
Untersucht wurden Enterokokken-Isolate (n=96) von Schweineherden in der Schweiz zum
Zeitpunkt zu dem sie Tylosin als Wachstumsförderer erhalten hatten und 5-6 Monate nach
dem Verbot aller antimikrobieller Wachstumsförderer in der Schweiz 1999 (n=59). Die Isolate
wurden jeweils auf Empfindlichkeit gegenüber 9 antimikrobiellen Substanzen getestet. Dabei
wurde nach dem Verbot eine deutliche Abnahme der Resistenzrate gegenüber Makroliden,
Lincosamiden und Tetrazyklinen beobachtet. Die VREF gehörten zum selben Klon wie die
zuvor in Dänemark bei Schweinen isolierten Vancomycin-resistenten Isolate. Aufgrund der
statistischen Daten wurde ein starker Zusammenhang zur Resistenz gegenüber Makroliden
als auch Tetrazyklinen gesehen (P<0.0001, Chi-Quadrat Test im 95%-Konfidenzintervall für
die Verhältnisse von 8,1 - 43,8 für Spiramycin-Resistenz, von 3,4 - 16,1 für Erythromycin-
Resistenz und von 2,1 - 16,5 für Clindamycin-Resistenz). Ähnlich zu dänischen Unter-
suchungen konnte auch nach Verbot von AVO eine bis zu 2 Jahre andauernde Resistenz
der Enterokokken gegenüber Vancomycin bei Schweinen beobachtet werden.
Del Grosso et al. 2000
Anhand von Stuhlproben von Brathähnchen und Schweinen in Italien wurden die Aus-
wirkungen auf die Existenz von VRE vor und nach dem Verbot AVO in Rohfleisch (-produk-
ten) untersucht. Bei Brathähnchen waren 36% der Vogelscharen und bei Schweinen waren
24,6% der Herden mit VRE besiedelt. Molekularuntersuchungen der VRE-Isolate mit Hilfe
der PFGE zeigten, dass Tiere aus unterschiedlichen Gehegen aber derselben Farmen mit
verwandten Klonen der Keime besiedelt waren. Nach dem Bann wurde ein Absinken der
VRE-Kontamination bei Fleischprodukten beobachtet. Statistisch signifikant war das Ab-
sinken bei Geflügel (von 18,8% auf 9,6%) aber nicht bei Schweinefleisch (von 9,7% auf
6,9%). Die Mehrheit von VRE aller Quellen trug das vanA Resistenz-Gen. Keine Isolate
trugen das vanB-Gen wohingegen vanC-positive Isolate zahlreich zu finden waren. Die Er-
gebnisse zeigen, dass die Einstellung der Verwendung von AVO erfolgreich die Besiedlung
von Fleischprodukten mit VRE reduzieren kann, diese Maßnahme jedoch weiterhin durch
bedachten Einsatz von Glykopeptidantibiotika in der Humanmedizin vervollständigt werden
Klare et al. 1999
Der Gebrauch des Glykopeptidantibiotikums AVO als Futtermittelzusatz in der Tierhaltung
vieler europäischer Mitgliedsländer führte 1994-1995 zu häufigem Nachweis von vanA-Typ
Vancomycin-resistenter Enterokokken sowohl in Fleisch- und Fleischprodukten als auch bei
Stuhlproben von nicht-hospitalisierten Personen in Deutschland im Bundesland Sachsen-
Anhalt. Ende 1997 wurden bei deutschen Produzenten von gefrorenem und frischem Ge-
flügel (Hähnchen und Pute) dann sinkende Zahlen von VRE-Isolaten festgestellt. Zu diesem
Zeitpunkt war die Verwendung von AVO in Dänemark und Norwegen seit mehr als 2 ½ Jah-
ren, in Deutschland fast 2 Jahre und in Mitgliedsstaaten der Europäischen Gemeinschaft und
der Schweiz ungefähr 8-9 Monate eingestellt worden. VRE wurden dann nur noch in sehr
geringen Konzentrationen in ¼ der Proben von Geflügelfleisch (8 von 31, hergestellt von 18
deutschen Herstellern und aus 12 verschiedenen Supermärkten) gefunden. Eine Vermin-
derung der VRE-Prävalenz wurde ebenso in der Flora des Gastrointestinaltraktes von
gesunden VRE-Trägern derselben Region (Sachsen-Anhalt, Deutschland) gefunden, ge-
fallen von 12% (12 / 100) im Jahr 1994 als AVO noch verwendet wurde auf 6% (6 / 100) im
Jahr 1996 und auf 3% (13 / 400) im Jahr 1997, nachdem es verboten wurde. Die Ergebnisse
verdeutlichen glaubhaft die Bedeutung des Selektionsdruckes von Glykopeptidantibiotika wie
z.B. AVO für das Auftreten von VRE in tierischen Fleischprodukten aus kommerzieller Tier-
4.1.5 Level III c (Fall-Kontroll Studien)
Insgesamt 4 Studien wurden mit dem Level III c gefunden:
Burnens 2002
Hintergrund dieser Untersuchung war die Tatsache, dass in den letzten Jahren eine deut-
liche Zunahme der Resistenz humaner Campylobacter-Isolate gegenüber Fluorchinolonen
zu verzeichnen ist. Risikofaktoren für humane Infekte mit Chinolon-resistenten C. jejuni
waren Auslandsreise in den zwei Wochen vor Erkankungsbeginn (odds ratio, OR=8,9; CI 3,1
– 28,7). Die Einnahme eines Fluorchinolons vor Entnahme der Stuhlprobe ergab eine OR
von 3,6, allerdings nur an der Grenze zur Signifikanz (CI 0,8 – 21,7).
Die durchgeführten Untersuchungen zeigen, dass klinische Isolate Fluorchinolon-resistenter
Campylobacter fast immer eine spezielle Mutation im gyrA-Gen aufwiesen. Die minimalen
Hemmkonzentrationen dieser Stämme gegenüber Nalidixinsäure (einschließlich eines
Stammes mit der zusätzlichen Mutation) lagen bei 8 mg / l bis 128 mg / l. In vitro gegen
Chinolone auf Resistenz gezüchtete Isolate zeigten die gleiche Mutation. Resistenzraten
humaner Stämme von Campylobacter jejuni gegenüber Erythromycin lagen in den meisten
Ländern unter wenigen Prozentpunkten. Hingegen war diese Resistenz bei porcinen Stäm-
men von Campylobacter coli sehr verbreitet und erreichte in gewissen Ländern auch bei
humanen Isolaten Raten von bis zu 50%. Die ganz überwiegende Mehrheit resistenter klini-
scher Isolate wies eine Punktmutation (im Gen der 23S rDNA) auf. Durch Selektion in vitro
konnte diese Mutation nicht erzeugt werden, hingegen konnte die Resistenz mittels Trans-
formation mit einer Effizienz von 10-8 auf empfindliche Stämme übertragen werden.
Gaunt and Piddock 1996
2.209 Isolate von Campylobacter spp. wurden von April 1991 bis Ende 1991 im Krankenhaus
von Plymouth untersucht, von welchen 91 (4,1%) resistent gegenüber Ciprofloxacin waren.
Keiner der betreffenden 91 Patienten hatte ein Chinolon eingenommen, aber 30 / 91 (33%)
reisten ins Ausland (16 zu den Iberischen Halbinseln) innerhalb von 3 Monaten vor der Isola-
tion von Ciprofloxacin-resistenten Campylobacter spp. In der Fall-Kontroll Studie hatten
12 / 15 (80%) Patienten erst kürzlich Geflügel verzehrt wie auch 20 / 24 (83%) der Kontrollen
mit Enteritis, verursacht durch Ciprofloxacin-empfindliche Campylobacter spp. Eine kleine
Untersuchung von im Supermarkt gekauftem Geflügel brachte zum Vorschein, dass nur
1 / 37 Campylobacter-Isolaten von 64 britischen Brathähnchen resistent gegenüber Ciproflo-
xacin gewesen war, wohingegen 7 / 26 Campylobacter-Isolaten von 50 importierten Hähn-
chen resistent gegenüber Ciprofloxacin gewesen waren. Von 75 klinischen Isolaten mit
Ciprofloxacin-resistenten Campylobacter spp. waren nach genauerer Analyse 68 Campylo-
bacter jejuni, 6 Campylobacter lari und eins Campylobacter coli. Alle Isolate von Mensch und
Tier waren resistent gegenüber Ciprofloxacin, Norfloxacin, Sparfloxacin und Tosufloxacin
und es gab einen Zusammenhang zwischen Fluorochinolon-Resistenz und steigender MHK
von Tetracyclin. Der Empfindlichkeitsbereich von Erythromycin und Kanamycin war keim-
entsprechend. Das gyrA-Gen von C. jejuni eines Isolates (ein Fall einer vorangegangenen
Reise nach Spanien) und von C. jejuni eines anderen Isolates von importiertem Geflügel
enthielt Punktmutationen. Die Untersuchung erhärtet den oft geäußerten Verdacht, dass der
tierärztliche Gebrauch von Chinolonen, besonders von Enrofloxacin, zum Auftreten von
Resistenzen gegenüber Ciprofloxacin bei Brathähnchen und damit zu lebensmittelbedingten
Infektionen mit resistenten Isolaten beim Menschen führen kann.
Gupta et al. 2003
Beschrieben wird eine Felduntersuchung in Neu England, die das Auftreten und die Epide-
miologie neuer Reihen von multidrug-resistenten Salmonellen (Newport-MDRAmpC) auf-
führt. Eine Zusammenfassung der Überwachungsdaten dieser Infektionen des CDC wird
ebenso geliefert. In Massachusetts stieg die Prävalenz von NewportMDRAmpC in der
Gruppe der Salmonellen Serotyp Newport Isolate humanen Ursprungs von 0% (0 / 14) im
Jahr 1998 auf 53% (32 / 60) im Jahr 2001 (P<0,001). In einer retrospektiven Fall-Kontroll
Studie wurden Infektionen mit Newport-MDRAmpC beschrieben, die in häuslicher Um-
gebung erworben wurden und im Zusammenhang eines Milchwirtschaftsbetriebes standen.
Isolate beider Gruppen, sowohl Menschen als auch Herdentiere hatten nicht voneinander
unterscheidbare Antibiogramme als auch PFGE-Muster. Die Prävalenz von Ceftriaxon-
resistenten Salmonellen stieg landesweit von 0,5% im Jahr 1998 auf 2,4% im Jahr 2001.
85% der Isolate im Jahr 2001 waren Newport-MDRAmpC und ungefähr 27 Bundesstaaten
isolierten diese Keime von Mensch, Viehherden und Hackfleisch. Diese Daten veranschau-
lichen das weit verbreitete Vorkommen von Newport-MDRAmpC Isolaten in den Vereinigten
Staaten und zeigen einen Anstieg auf das Fünffache der Prävalenz von resistenten Salmo-
nellen im Bezug auf Cephalosporine mit erweitertem Spektrum zwischen 1998 und 2001
primär durch das Auftreten von Newport-MDRAmpC-Isolaten.
Kjerulf et al. 1996
Untersucht wurden 91 Stuhlproben von 67 Patienten eines Universitätskrankenhauses. 17
Isolate von Enterococcus faecium wuchsen auf einem selektiven Medium und 3 Isolate
(18%) davon waren VRE (MHK > 256 mg / l). PCR und Sondenuntersuchung zeigten die
Präsenz von vanA in den VRE. Es bestand kein Zusammenhang zwischen Vancomycin-
Therapie und dem Tragen von VRE.
4.1.6 Level IV und V
Die gefundenen Artikel aus den Evidenzlevels IV und V sind im Anhang A5 summarisch auf-
4.2 Erweiterte
Recherchen
4.2.1 Einsatz von Antibiotika
Obwohl es eine Vielzahl von Substanzen mit antibiotischer Aktivität gibt, gehören sie zu
wenigen Gruppen mit gemeinsamen strukturellen Eigenschaften, gleicher Wirkungsweise
und einem meist ähnlichen Wirkungsspektrum.
Die wichtigsten in der Veterinär- und Humanmedizin eingesetzten Gruppen mit Beispielen
und - sofern bekannt - Wirkungsweise finden sich in der Tabelle 6.
Gruppen veterinär- und humanmedizinisch bedeutender Antiinfektiva [eigene Zusammenstellung]
Gruppe Beispiele
Bemerkung
antibiotika: - Penicilline
Amoxicillin, Ampicillin,
Zellwandsynthese
Cefazolin, Cefoperazon
Zellwandsynthese
Imipenem, Meropenem
Zellwandsynthese
Bacitracin Störung
Leistungsförderer
Zellwandsynthese
(EU-Verbot 1999)
Glykopeptide Ardacin,
Avoparcin, Störung der
Avoparcin und Ardacin
Zellwandsynthese
Leistungsförderer
(EU-Verbot 1997, Avoparcin in Deutschland
Glykolipide Flavophospholipol Störung der
Leistungsförderer EU
Zellwandsynthese
Aminoglykoside Streptomycin,
Leistungsförderer 1994
Elfamycine Efrotomycin
Leistungsförderer EU
Erythromycin, Tylosin,
Tylosin und Spiramycin als
Spiramycin, Tilmicosin,
Leistungsförderer
(EU-Verbot 1999)
Lincosamide Lincomycin,
Orthosomycine Avilamycin,
Leistungsförderer EU
Leistungsförderer (EU-
Tetrazykline Oxytetrazyklin,
Chlortetrazyklin,
Polypeptide Bacitracin,
Störung der Funktion
Colistin, Polymyxin B
Monensin, Salinomycin
Störung der Funktion
Leistungsförderer
EU Coccidiostatika
Gruppe Beispiele
Bemerkung
DNA / RNA-Synthese
Olaquindox, Carbadox
Leistungsförderer
DNA/RNA-Synthese
(EU-Verbot 1999)
Sulfonamide Sulfadiazin,
Sulfadimethoxin,
Zellstoffwechsels
Trimethoprim Trimethoprim
Zellstoffwechsels
Nitrofural, Nifurpirinol,
Zellstoffwechsels
Furaltadon, Furazolidon
Zellstoffwechsels
Pleuromutiline Tiamulin,
Leistungsförderer EU
Valnemulinhydochlorid
Eine Zusammenstellung aller derzeit (März 2004) in Deutschland für die Landwirtschaft bzw.
Lebensmittelproduktion zugelassenen Antiinfektiva und Antimykotika findet sich in der
Tabelle A1 im Anhang. Die Liste enthält 70 Substanzen.
Antiinfektiva werden zur Behandlung von Infektionskrankheiten bei Menschen, Tieren und
Pflanzen eingesetzt. Neben dieser therapeutischen Verwendung werden sie auch vor-
beugend verabreicht (Antibiotikaprophylaxe). Eine Prophylaxe kann z.B. kurz vor und ggf.
während einer Operation gegeben werden, bei deren Verlauf eine Infektion durch Keime der
normalen Flora im Operationsgebiet (z.B. physiologische Darmflora bei Operationen im
Gastrointesinaltrakt) möglich ist (perioperative Prophylaxe) oder bei engem Kontakt mit
Infizierten (Expositionsprophylaxe). Auch die Antibiotikaprophylaxe zu Beginn der Trocken-
stehperiode von Milchkühen stellt eine Prophylaxe dar. Sie dient der Vermeidung von
Euterinfektionen, die in diesem Zeitraum häufig auftreten. Die Abgabe antibiotisch wirk-
samer Substanzen an Tiere, in deren Umgebung (z.B. Herde) Erkrankungen aufgetreten
sind, bezeichnet man als Metaphylaxe. Neben diesen Einsatzfeldern werden in der Tier-
medizin Antibiotika auch prophylaktisch verabreicht, ohne dass eine spezielle Bedrohung
(z.B. durch ein erkranktes Tier) existiert. Diese Prophylaxe wird vor allem bei intensiver
Tierhaltung und bei Unterbringung von vielen Tieren auf engstem Raum (z.B. Legebatterien
in der Geflügelproduktion) durchgeführt. Infektionen können sich bei dieser Produktionsform
schnell ausbreiten, einen großen Teil des Bestandes infizieren und einen erheblichen wirt-
schaftlichen Schaden verursachen.
In der Lebensmittelproduktion werden antibiotisch wirkende Substanzen primär bei der Her-
stellung von Produkten tierischer Herkunft, aber auch bei der Produktion von Lebensmitteln
pflanzlicher Herkunft eingesetzt. In Deutschland besteht ein Anwendungsgebiet von Anti-
biotika in der Pflanzenproduktion z.B. bei der Bekämpfung des sog. Feuerbrandes. Anti-
biotika spielen bzw. spielten (bei heute nicht mehr zugelassenen Substanzen) seit den
1950er Jahren v.a. als Zusatz zu Futtermitteln in der Tierzucht (Wachstums- und
Leistungsförderer; growth promoter) eine mengenmäßig bedeutende Rolle. So wurden 1999
in der EU nach Angaben der ‘European Federation of Animal Health' (FEDESA) einschließ-
lich der Schweiz ca. 3850t Antibiotika in der Veterinärmedizin und ca. 800t als growth
promoter eingesetzt [zitiert nach Kümmerer 2003].
Beim Einsatz als Leistungsförderer liegt die Dosierung immer unterhalb der therapeutischen
Dosen. Die Leistungsförderer werden im Vergleich zur Therapie oder Expositionsprophylaxe
über einen längeren Zeitraum hinweg verabreicht. Werden dem Tierfutter Antibiotika zu-
gesetzt, die ebenso in der Humanmedizin zur Behandlung von Infektionskrankheiten ver-
wendet werden, so können hierdurch sich entwickelnde resistente Erreger ein Problem für
die antimikrobielle Therapie beim Menschen darstellen. Hierbei sind zwei Fragestellungen für
den Menschen relevant:
ob und inwieweit solche resistenten Erreger pathogen sind und
inwieweit Resistenzmechanismen auf humanpathogene Keime übertragen werden
können und inwiefern dadurch Einschränkungen in den Therapieoptionen der antimikro-biellen Behandlung zu befürchten sind (z.B. Glykopeptid-resistente Enterokokken-Stämme) [RKI 2003].
Im Jahr 1969 wurde im sog. Swann Report in Großbritannien gefordert, dass therapeutisch
genutzte Antibiotika nicht als Wachstums- und Leistungsförderer genutzt werden sollten
[Swann Committee 1969]. Als Ergebnis des Swann Reports wurde unter anderem der Ein-
satz von Chloramphenicol als Leistungsförderer bei Lebensmittel liefernden Tieren in Groß-
britannien verboten. Im Jahr 1989 forderte die EU-Direktive 89 / 107 / EEC für Futtermittel-
zusätze nicht nur deren Effizienz für die Lebensmittelproduktion, sondern auch die Unbe-
denklichkeit gegenüber der konsumierenden Bevölkerung. In den vergangenen Jahren
wurde immer wieder gefordert, ein Verbot für den Gebrauch von Wachstums- und
Leistungsförderern im Lebensmittel-produzierenden Gewerbe auszusprechen, z.B. während
der WHO Konferenz in Berlin 1997, während einer europäischen Zusammenkunft im Sep-
tember 1998 in Kopenhagen und in Berichten des ‚House of Lords' (GB) und des
24. Generaldirektorats (Directorate General) der Europäischen Kommission [Acar et al.
2000]. Im Frühjahr 1999 fand an der Universität von Georgetown ein interdisziplinäres
Treffen, u.a. unter Beteiligung der ‚Food and Drug Administration' (FDA) und der 'Centers for
Disease Control and Prevention' (CDC) statt. Man kam darin überein, dass zunächst eine
gründliche Risikobewertung stattfinden sollte, bevor weitergehende Schlussfolgerungen be-
züglich eines generellen Verbots in der Lebensmittelproduktion gezogen werden sollten
[Acar et al. 2000]. Die FDA kündigte weiterhin eine quantitative Risikobewertung in Bezug
auf den Zusammenhang der Verwendung von Wachstumsförderern und resistenten Entero-
In der EU wurde im Januar 1997 der Einsatz des Glykopeptid-Antibiotikums Avoparcin
(AVO) als Leistungsförderer verboten. Im Januar 1998 folgte Ardacin und im Dezember
1998 das EU-weite Verbot für die Substanzen Virginiamycin, Bacitracin, Spiramycin und
Tylosin [Commission of the European Communities 2001]. Ein Kommissionsvorschlag für
eine neue Verordnung über Futtermittelzusätze sieht ein Verbot der verbleibenden
4 Substanzen als Leistungsförderer mit antibiotischer Wirkung für 2006 vor: Monensin-
Natrium, Salinomycin-Natrium, Avilamycin und Flavophospholipol [http://www.evz.de/food/
antibiotika-futtermittel.html - Seite eingesehen am 04.03.2004].
Die USA führten bislang keine ähnlichen generellen Verbote wie die EU ein. In den USA war
Avoparcin nicht zugelassen.
4.2.2 Entwicklung von Mengen und Art der eingesetzten Substanzen
Antibiotika werden in erheblichen Mengen produziert und verbraucht, wobei die Datenlage
über Produktion, Einsatz und Verbrauch spärlich ist. Offizielle Daten sind aus Deutschland
nicht verfügbar. Die Daten beruhen entweder auf freiwilligen Angaben der Hersteller und
Herstellerverbände oder sind als Ergebnis journalistischer Recherchen kaum zu überprüfen.
Auf Anfrage der EU wurden von der FEDESA für die Jahre 1997 und 1999 Verbrauchsdaten
Folgende Daten wurden veröffentlicht:
Deutschland
Offizielle Daten aus Deutschland über den Verbrauch von Futterzusatzstoffen und Tier-
arzneimitteln sind nicht verfügbar.
Winckler und Grafe [2001] publizierten in einer Studie über Abfälle in der Massentierhaltung
im Auftrag des Umweltbundesamts [Forschungsbericht 297 33 911 UBA-FB 000074]
Verbrauchszahlen über Futterzusatzstoffe und Tierarzneimittel mit antibiotischer Wirkung in
fünf niedersächsischen Landkreisen des Regierungsbezirks Weser-Ems. Die Angaben über
die Futterzusatzstoffe entstanden durch eine Befragung von Futtermittelherstellern, die mit
einem Marktanteil von ca. 40% an den in der Region verkauften Futtermitteln einen guten
Überblick über den gesamten Markt geben können. Die Zahlen über die Tierarzneimittel
wurden durch eine Auswertung von ca. 31.000 Herstelleraufträgen und Verschreibungen aus
dem Jahr 1997 ermittelt und durch Befragung von Tierarztpraxen ergänzt. Der Verbrauch an
Futterzusatzstoffen im untersuchten Gebiet wurde im Jahr 1997 auf ca. 112.000 Tonnen
wirksamer Substanzen geschätzt. Dabei betrug der Anteil der mittlerweile nicht mehr zu-
gelassenen Antibiotika Zink-Bacitracin, Tylosinphosphat, Virginiamycin und den Leistungs-
förderern Carbadox und Olaquindox insgesamt 47%. Seit Anfang 1999 rechnen die Autoren
mit einer verstärkten Verwendung von Ionophoren (Salinomycin) und Glykolipiden
(Flavophospholipol) bei Schweinen, Monensin bei Rindern und Avilamycin bei Geflügel.
Unter Berufung auf einen bedeutenden Vertreiber von Futterzusatzstoffen wird im Rahmen
von Markenfleischprogrammen bei Schweinefleischproduktion und der Geflügelmast auf
Leistungsförderer ganz oder teilweise verzichtet. In der Masthähnchenproduktion wird nach
dieser Quelle bereits zu 42% auf antibiotische Leistungsförderer verzichtet. Für die Ferkel-
aufzucht und –vormast liegen keine Schätzungen vor, hier wird der Einsatz von Salinomycin
und Flavophospholipol aufgrund der besseren Verträglichkeit vermutet. Der Einfluss von
Marketingfaktoren und der Kosten werden als Grund für einen weiteren Rückgang des Ein-
satzes dieser Substanzen in der eigentlichen Mast angesehen.
Die Verbreitung unterschiedlicher Mastformen in den verschiedenen Regionen lassen eine
Verallgemeinerung dieser Daten für ganz Deutschland nicht zu. Der Verbrauch an Tier-
arzneimitteln in der Schweinemast betrug in der Weser-Ems-Region 1997 ca. 54.500 kg bei
6.000.000 Mastschweinen. Im Vergleich mit Dänemark, dessen Produktionsbedingungen
denen in der Weser-Ems-Region ähnlich sind (31.004 kg bei 19.730.000 Mastschweinen),
lag dieser Verbrauch 1996 deutlich höher, obwohl direkte Abgaben von Arzneimitteln vom
Tierarzt an den Tierhalter hierbei noch nicht berücksichtigt wurden.
Insgesamt wurden 1997 im Regierungsbezirk Weser-Ems über tierärztliche Herstellungs-
aufträge 76.000 kg pharmazeutische Reinwirkstoffe ausgegeben, davon entfielen 91% auf
antibiotisch wirkende Substanzen. 89% der Herstellungsaufträge entfielen auf Schweine,
9% auf Geflügel und 2% auf die Rindermast [Winckler und Grafe 2001]. Von der Gesamt-
stoffmenge lagen der Anteil der Schweinemast bei 72% und der Anteil der Geflügelzucht bei
27%; Tetrazykline hatten mit 58% den größten Anteil gefolgt von den Sulfonamiden (21%),
den Aminoglykosiden (10%), den Betalaktamen (5%) und den Polymyxinen (3%). Insgesamt
78 % des Tetrazyklinverbrauchs entfiel auf die Schweinemast [Winckler und Grafe 2001].
Schweden
Schweden hat 1986 den Einsatz von Leistungsförderern im Futter gesetzlich verboten und
kann deshalb bei der Beurteilung der Vor- und Nachteile der Leistungsförderer als Bezugs-
punkt angesehen werden.
Im Jahr 1986 wurden in Schweden insgesamt 25.774 kg Antibiotika verbraucht; im Jahr
1996 konnte der Gesamtverbrauch nach einem zwischenzeitlichen Anstieg auf 20.307 kg
reduziert werden. Die Verteilung zeigen die beiden untenstehenden Tabellen 7 und 8.
[Animal pharm No. 401 17. Juli 1998, S. 3; http://www.animal-health-online.de/drms/rinder/
schweden.htm - Seite eingesehen am 28.04.2004]
Antibiotikaverbrauch in Schweden (kg Antibiotikum)
Antibiotika – Gruppe
6585 4572 7730 4968 2733
Pleuromutiline 0
Gesamtverbrauch an Antibiotika
Schwedischer Antibiotikaverbrauch bezogen auf die Wirksamkeit (biologische Aktivität) der einzelnen Antibiotikagruppen (durch einen Faktor in Relation zur Oxytetrazyklin-
dosierung als Standard gesetzt= Oxytetrazyklin-Äquivalente)
Antibiotika – Gruppe
6585 4572 7730 4968 2733
0 2016 5904 4300 4152
Pleuromutiline 0
Gesamtverbrauch an Antibiotika
Die Daten zeigen nach dem Verbot der Leistungsförderer eine Reduktion des Gesamt-
verbrauchs an Antibiotika bezüglich des Gewichts, jedoch einen Anstieg gemessen an der
biologischen Aktivität. Die Zunahme kann als Anstieg der Therapienotwendigkeit bedingt
durch eine Verschlechterung des allgemeinen Gesundheitszustandes der Tiere nach Fortfall
der Leistungsförderer angesehen werden. Eine vermehrte Gabe von Antibiotika als (höher-
dosierte) Prophylaxe ist eine weitere Erklärungsmöglichkeit.
Österreich
Angaben zum Verbrauch antibiotischer Leistungsförderer in Österreich liegen für 1997 vor
Antibiotische Leistungsförderer in Österreich 1997
[Quelle: www.cis.tugraz.at/orgc/hoegroup/chem_ges/2002_ULLY_2.pdf - Seite eingesehen 28.04.2004]
Leistungsförderer Menge
Tylosin (Makrolid)
Bacitracin (Polypeptid)
Avoparcin (Glykopeptid)
Salinomycin (Ionophor)
Avilamycin (Oligosaccharide)
Flavomycin (Flavophospholipol)
Virginiamycin (Peptolid)
Monensin (Ionophor)
Nach Schätzung der FEDESA wurden der EU (einschließlich Schweiz) insgesamt 12.752 t
Antibiotika eingesetzt. Davon entfielen auf die Humanmedizin 7.659 t (60%). In der Tier-
medizin wurden 3.994 t (27,5%) und als Leistungsförderer 1.599 t (12,5%) eingesetzt.
1999 betrug der Verbrauch an Antibiotika in der Europäischen Union (einschließlich
Schweiz) ca. 13.216 Tonnen. 8.528 t Antibiotika wurden davon in der Humanmedizin (65%)
und 3.902 t in der Veterinärmedizin (29%) eingesetzt. Der Einsatz an Leistungsförderern
betrug 786 t (6%) [http://www.ifahsec.org – Seite eingesehen am 28.04.2004]. Der
Verbrauch in der Humanmedizin stieg in dem Zeitraum zwischen 1997 und 1999 um 11,8 %
und in der Veterinärmedizin um 11,6%. Der Anteil der Leistungsförderer wurde um 51%
gesenkt. Insgesamt nahm der Verbrauch an Antiinfektiva um 10% zu. In der Veterinär-
medizin wurden v.a. Tetrazykline (66%), Makrolide (12%) und Betalaktam-Antibiotika (9%)
Niederlande
In den 90er Jahren wurden in den Niederlanden jährlich ca. 250 - 300 t Antibiotika dem
Tierfutter als Zusatz beigemischt. [http://www.ifahsec.org/International/publications/han1-
3.htm - Seite eingesehen am 12.03.2004].
Nach einem Bericht der Zeitung "Schweizer Landbote" in der Sonntagsausgabe vom 28. Ja-
nuar 2001 war der Antibiotikaeinsatz in der Schweizer Schweineproduktion nach dem Verbot
der Antibiotika als Leistungsförderer 1999 noch nicht rückläufig. Heinz Müller vom Bundes-
amt für Veterinärwesen erklärte der Zeitung, dass die zu Mastzwecken dem Futter beige-
mischten Antibiotika den nicht unerwünschten Nebeneffekt eines Infektionsschutzes gehabt
hätten. Durch das Verbot würden die Schweine nun öfter krank. Antibiotika müssten also in
einer Übergangsphase im therapeutischen Bereich vermehrt eingesetzt werden. Das mit
dem Verbot angestrebte Ziel einer Verringerung der Gesamtmenge von Antibiotika könne
erst nach einigen Jahren erreicht werden.
4.2.3 Gesetzliche Vorgaben und Richtlinien zum Einsatz von Substanzen mit anti-
biotischer Wirkung in Lebensmitteln
Rückstände unerwünschter pharmakologisch wirksamer Substanzen in Lebensmitteln wie
Antibiotika können für den Konsumenten Gesundheitsrisiken darstellen. Rechtlich wird der
Schutz der Verbraucher vor solchen Substanzen durch das Lebensmittel-, Futtermittel-, Arz-
neimittelgesetz sowie weitere Rechtsvorschriften konkretisiert. Die Lebensmittelüber-
wachung orientiert sich an den rechtlichen Vorgaben des Verbraucherschutzes.
Grundlage für die Überwachung von Rückständen in tierischen Lebensmitteln ist der Natio-
nale Rückstandskontrollplan (NRKP). Die rechtlichen Rahmenbedingungen für diesen Plan
finden sich in der Richtlinie 96 / 23 / EG des Rates vom 29. April 1996 und der Entscheidung
97 / 747 / EG der Kommission vom 27. Oktober 1997. Die Höchstmengen für Arzneimittel-
rückstände in Nahrungsmitteln tierischen Ursprungs werden in der Verordnung (EWG) Nr.
2377 / 90 EU-weit verbindlich geregelt. Die pharmakologisch wirksamen Stoffe werden hier
nach wissenschaftlicher Bewertung in vier Anhänge eingeteilt:
Stoffe, für die Höchstmengen (MRL = Maximum Residue Limits) festgelegt
Stoffe, für die keine Höchstmengen festgelegt werden müssen, weil sie ent-
weder nicht zu Rückständen führen oder eventuelle Rückstände unbedenklich
Anhang III: Stoffe, für die Höchstmengen vorläufig bis zu einer bestimmten Zeitdauer fest-
gesetzt werden. Innerhalb dieses Zeitraums müssen die Werte weiter über-
Anhang IV: Stoffe, für die derzeit keine Höchstmenge festgelegt werden können. Diese
Substanzen sind für die Verwendung bei Lebensmittel liefernden Tieren ver-
In den Anhängen I - IV der VO (EWG) 2377 / 90 werden ausführlich die zugelassenen Maxi-
malrückstandswerte (MRL) für die einzelnen Substanzen einschließlich der Abbauprodukte
und Markersubstanzen, Tiere, Zielorgane und Produkte (z.B. Niere, Leber, Fett, Muskel-
fleisch oder Milch) angegeben. Die Kommission kann die Liste nach aktuellen Erkenntnissen
ändern und erweitern.
Bei einer Behandlung mit antibiotisch wirksamen Substanzen – insbesondere bei einer
systemischen Therapie - von erkrankten Tieren ist generell mit dem Auftreten von Spuren
und Rückständen sowie Abbauprodukten der eingesetzten Substanzen zu rechnen (z.B. in
Fleisch oder Milch). Die EU-Richtlinie gibt daher für jede Substanz und jedes Tier Zeiträume
an, in der entsprechende Produkte der Tiere nicht auf den Markt gelangen dürfen. Bestimmte
Konzentrationen der Substanzen (MRL) dürfen anschließend nicht überschritten werden.
Einige Substanzen dürfen in keinem Fall nachweisbar sein (Anhang IV der VO (EWG)
2377 / 90 des Rates).
Die Vorgaben der EU-Richtlinie werden in Deutschland durch das Arzneimittelgesetz (AMG)
mit den besonderen Bestimmungen für Arzneimittel, die bei Lebensmittel liefernden Tieren
angewendet werden, in nationales Recht überführt.
Der Gebrauch von Futtermittelzusatzstoffen innerhalb der EU ist in der Direktive
70 / 524 / EEC geregelt. Diese fordert von den Futtermittelzusatzstoffen, dass sie sich
günstig auf die Beschaffenheit der Futtermittel, denen sie zugefügt werden, oder auf die tieri-
sche Erzeugung auswirken, der tierischen und menschlichen Gesundheit nicht schaden und
für den Verbraucher der tierischen Erzeugnisse keine Nachteile mit sich bringen. Der Vor-
schrift entsprechend sind die EU-Mitgliedsstaaten zur Einhaltung dieser Prinzipien und deren
Kontrolle verpflichtet. Antimikrobiell wirksame Leistungsförderer gelten als Futtermittel. Nach
§ 9t der Richtlinie 70 / 524 / EWG Buchstabe b des Rates über Zusatzstoffe in der Tierer-
nährung wird ein Verzeichnis der zugelassenen Zusatzstoffe von der Kommission heraus-
Antimikrobiell wirkende Leistungsförderer werden selten in relevanten Konzentrationen als
Rückstände nachgewiesen, da die Leistungsförderer funktionsbedingt aus Substanzen mit
der pharmakologischen Eigenschaft bestehen, bei oraler Gabe nicht durch die Darmwand
resorbiert zu werden, um eine maximale Wirkung im Intestinaltrakt selber zu erzielen.
Überwachung der MRL
Im Rahmen des Nationalen Rückstandskontrollplans werden seit 1989 Lebensmittel auf
Rückstände einschließlich der Substanzen mit antibiotischer Wirkung untersucht und die
MRL gemäß der Verordnung (EWG) Nr. 2377 / 90 bewertet. Hierbei wird für den gesamten
Bereich der Produktionskette nach unzulässigem Einsatz oder unzulässigen Konzentrationen
von Substanzen gefahndet. Die Methoden sind in der gesamten EU einheitlich und sind
gleichsam für neu beitretende EU-Mitgliedsländer verbindlich (Richtlinie 96 / 23 / EG des
Rates vom 29. April 1996; Entscheidung 97 / 747 / EG der Kommission vom 27. Oktober
4.2.4 Rückstände von antibiotisch wirksamen Substanzen in Lebensmitteln
Eine Zusammenstellung von Untersuchungsbefunden findet sich jährlich im Nationalen
FCckstandskontrollplan; Seite eingesehen am 9.8.2004].
Beispiele für Ergebnisse von Rückstandskontrolluntersuchungen:
In Deutschland wurden im Jahr 2000 Rückstände von Chloramphenicol (4 Proben), Tetra-
zyklin (3 Proben), Sulfonamide (2 Proben) und Streptomycin (1 Probe) beanstandet.
Der Einsatz von Chloramphenicol ist in Deutschland seit 23. August 1994 verboten. Rück-
stände von Chloramphenicol können beim Menschen zu einer irreversiblen aplastischen
Anämie führen.
Bei den Beanstandungen beim Nachweis der antibiotisch wirksamen Substanzgruppen
Tetrazykline, Sulfonamide und Streptomycin, handelte es sich um Höchstmengenüber-
schreitungen nach EWG-VO 2377 / 90. Ein mit Streptomycin belasteter Honig stammte aus
Untersuchungen von Honig auf Rückstände unabhängig vom Nationalen Rückstands-
kontrollplan wurden von der Stiftung Warentest in Deutschland durchgeführt [Stiftung
Warentest Online 25.03.2004]. Von 34 untersuchten Honigen verstießen 18 gegen die Vor-
schriften, zehn Honige hätten nicht als Honig verkauft werden können, neun trugen die
Sortenbezeichnung zu Unrecht. In vier Honigproben konnten Rückstände von Antiinfektiva
nachgewiesen werden. Zwei Honige enthielten Umwandlungsprodukte von Nitrofuranen, ein
Honig Streptomycin in unerlaubter Höhe und ein weiterer Tetrazykline. Nitrofurane wurden in
der EU 1995 verboten, da sie das Erbgut schädigen und Krebs erzeugen können. Die Pro-
ben stammten aus Südamerika, wo Nitrofurane noch in der Fischzucht und Schweinemast
eingesetzt werden.
Zwei der Honige waren ,Bioprodukte'. In einem der Bio-Honige wurden Nitrofurane und im
anderen Streptomycin nachgewiesen. Streptomycin wird in Deutschland zur Behandlung der
Pflanzenkrankheit Feuerbrand eingesetzt.
Diese Untersuchung der Stiftung Warentest zeigt die Schwächen der Stichprobenunter-
suchungen im Rahmen des Nationalen Rückstandskontrollplans. Im Jahr 2000 wurden im
Rahmen des Nationalen Rückstandskontrollplanes bei der Untersuchung von Honig von 100
Proben in einer Probe, im Jahr 2001 von 158 Proben in zwei Proben und im Jahr 2002 von
105 Proben in zwei Proben antibakteriell wirksame Substanzen nachgewiesen. 2002 wurden
in einem Honig Sulfonamide und in einem Honig Aminoglykoside gefunden.
Der Nachweis von Antiinfektiva in Bio-Produkten zeigt, dass die Kontamination der Umwelt
mit Antiinfektiva auch zu Kontaminationen mutmaßlich ohne Einsatz von Antiinfektiva pro-
duzierter Lebensmittel führen kann und deshalb als unkalkulierbares Risiko angesehen
Risiken bezüglich der Toxizität sind bei Einhaltung der MRL-Werte aufgrund des nach der
EU-Richtlinie vor der Einführung der Substanzen durchzuführenden gutachterlichen Nach-
weises der Unbedenklichkeit bzw. der Risikobewertung nach dem aktuellen Stand der
Wissenschaft auszuschließen. Risiken durch Rückstände allergener Substanzen wie Peni-
cillin können allerdings für entsprechend disponierte Personen (z.B. Atopiker) nicht gänzlich
ausgeschlossen werden. Risiken bezüglich Resistenzentwicklungen bzw. Auswirkungen auf
die Umwelt sind aufgrund der hohen Sicherheitsabstände bei der Festlegung der MRL-
Werte, die auf hohe lebenslängliche Verbrauchsmengen bezogen sind, nicht zu erwarten.
4.2.5 Einsatz von Antibiotika in der Fischzucht und Aquakultur
Ein besonders kritisches Beispiel stellt die Anwendung des Antibiotikums Chloramphenicol in
der Garnelenzucht in Ostasien dar. Chloramphenicol ist wie die Nitroimidazole in der EU zur
Anwendung bei Lebensmittel produzierenden Tieren nicht mehr zugelassen. Eine Dosis, die
sicher unschädlich ist, kann nicht angegeben werden. In der VO (EWG) 2377 / 90 des Rates
befindet sich Chloramphenicol im Anhang IV und ist in der EU (1994), den USA und Austra-
lien verboten worden [Greenpeace-Report 2001].
In der Fischzucht werden zur Behandlung von Infektionskrankheiten auch andere antibiotisch
wirksame Substanzen wie z.B. Tetrazykline eingesetzt, für die MRL-Werte existieren. Eine
wichtige Rolle in der Bekämpfung von Infektionskrankheiten bei Fischen kommt Triphenyl-
methan-Farbstoffen (Malachitgrün und Kristallviolett) zu. Malachitgrün ist ein wirksames Mit-
tel gegen einzellige Ektoparasiten und Pilzbefall in der Teichwirtschaft und ist als Arzneimittel
nur bei Fischeiern zugelassen. Nach dem Agrarbericht Qualitätssicherung in der Landwirt-
schaft Bayern 2000 [http://www.stmelf.bayern.de/landwirtschaft/agrarbericht/2000/
ernaehrung/1-2-1_ernaehrung.html; Seite eingesehen 16.06.2004] wurden unter 20 unter-
suchten Forellen sechs positive Filetproben gefunden. Damit lag 1998 der Anteil an
belasteten Forellen doppelt so hoch wie 1997. Altlasten bzw. Fischimporte wurden als
Ursache vermutet und untersucht. Im Ausland ist Malachitgrün zur Behandlung von Ekto-
parasiten und Pilzbefall nicht verboten.
4.2.6 Einsatz von Antibiotika bei Lebensmitteln pflanzlicher Herkunft
Die Behandlung von Pflanzenkrankheiten mit Antibiotika ist in Deutschland auf Streptomycin
beschränkt und prinzipiell genehmigungspflichtig (Warndienstaufruf durch die Länder).
Streptomycin (Plantomycin, Strepto) wird zur Behandlung des Feuerbrands im Kernobstbau
eingesetzt. Feuerbrand ist eine durch Bakterien der Spezies Erwinia amylovora hervor-
gerufene hochinfektiöse Pflanzenkrankheit. Die Verwendung von Streptomycin in der süd-
deutschen Bodensee-Region führte zu Rückständen in Honigproben. In der Folge wurde die
Zulassung ausgesetzt [nano online 2001].
Am 25. März 2004 wurde Streptomycin durch das Bundesamt für Verbraucherschutz und
Lebensmittelsicherheit wegen ‚Gefahr im Verzuge' erneut genehmigt, da durch Feuerbrand
ganze Obstbaumbestände innerhalb kurzer Zeit vernichtet werden können.
In anderen Ländern sind andere Antibiotika zur Bekämpfung des Feuerbrands zugelassen;
Oxolinsäure (Israel), Gentamycin (Israel und Mexiko), Oxytetrazyklin in den USA bei Strep-
tomycinresistenz von Erwinia amylovora.
In den Äpfeln wird bei Streptomycinanwendung Streptomycin nicht als Rückstand nach-
In der Schweiz ist Streptomycin für die Bekämpfung des Feuerbrands nicht zugelassen.
Feuerbrand wird durch umfangreiche Hygienemaßnahmen „Verhindern, Tilgen, Eindämmen"
kontrolliert. [Hölliger et al 2003]. Die Maßnahmen beinhalten z.B. ein Bienenaussetzverbot
während der Blütezeit in infizierten Beständen, Händedesinfektionsmaßnahmen beim Um-
gang mit infizierten Pflanzen und Verbot der Pflanzung bestimmter lange blühender für
Feuerbrand besonders anfälliger Zier-Pflanzen.
Eine mikrobiologische Untersuchung in Finnland von finnischem und importiertem Gemüse
zeigte niedrige Resistenzraten bei Enterobakterien [Österblad 1999]. Allerdings waren
gegenüber Chloramphenicol und Cefuroxim Resistenzraten im zweistelligen Bereich (12%
bzw. 14%) nachweisbar. Die Untersucher stellten fest, dass Gemüseverzehr für die hohe
Prävalenz resistenter Enterobakterien in Stuhlproben aus Finnland nicht verantwortlich ist.
4.2.7 Desinfektionsmittel und Resistenz
Literatur über Risiken durch den Einsatz von Desinfektionsmitteln, die in der Veterinär-
medizin oder der Landwirtschaft zum Einsatz kommen, war im Rahmen der Datenbank-
recherche nicht zu ermitteln.
Desinfektionsmittel zeichnen sich im Gegensatz zu Antibiotika durch einen unspezifischen
Wirkungseffekt aus (Zerstörung von Bakterienzellen). Die Resistenzmechanismen, die bei
der Anwendung von Antibiotika beobachtet werden, sind in einzelnen Fällen ähnlich denen,
die unter Anwendung spezieller Desinfektionsmittel auftreten können (z.B. Triclosan). Triclo-
san hat jedoch wahrscheinlich eine spezifische Wirkung auf Mikroorganismen und kann
daher auch als Antiinfektivum eingestuft werden. Es gibt Verbindungen zwischen Antibiotika-
und Desinfektionsmittelresistenz. So besitzen einige Desinfektionsmittel die Fähigkeit zur
Selektion von resistenten Erregern gegen bestimmte Antibiotika und umgekehrt. Die un-
kritische Anwendung solcher Desinfektionsmittel (in der häuslichen Umgebung, aber auch
z.B. in der Tierhaltung) kann zum Auftreten resistenter Erreger führen, die auch für die
Humanmedizin relevant sind [Heir et al. 2001]. Hat sich eine Resistenz herausgebildet, kann
sie auch ohne direkten Selektionsdruck durch Anwesenheit des Desinfektionsmittels be-
4.2.8 Konservierungsmittel
Zur Konservierung sind in der Europäischen Union lediglich zwei antimikrobielle Substanzen
für spezielle Lebensmittel zugelassen (Nisin, E234, und Natamycin, E235). Natamycin wird
häufig zum Schutz von Hartkäse vor Schimmelpilzbildung verwendet [de Ruig 1987]. Die
Europäische Kommission hat 2001 angekündigt, die Sicherheit und die Notwendigkeit des
Einsatzes dieser beiden Substanzen weiterhin zu überprüfen [Commission of the European
Communities. Brüssel, 20.6.2001].
Natamycin wird zur Vermeidung von Schimmelpilzbildung in Lebensmitteln eingesetzt, die
nach der Produktion noch einen Reifungsprozess durchlaufen (bestimmte Käsesorten,
getrocknete und gepökelte Würstchen) und darf entsprechend der lebensmittelrechtlichen
Bestimmungen in einem Abstand von 5 mm unterhalb der Käserinde nicht mehr nachweisbar
sein und 1 mg / dm2 nicht überschreiten.
4.2.9 Rückstände antimikrobieller Substanzen in der Umwelt
Über das Auftreten, den Verbleib und den Abbau von Antibiotika in der Umwelt und die damit
verbundenen Risiken liegen bisher nur vereinzelt Erkenntnisse vor [Kümmerer 2004]. Die
Hauptfragestellung ist auch hier die Bildung von Resistenzen, z.B. über den Weg des Ab-
wassers. In den Organismus aufgenommene Antibiotika werden je nach Substanzklasse in
ihrer ursprünglichen Form (bis zu 90%) oder z.T. metabolisiert ausgeschieden und gelangen
so in die Umwelt (z.B. Abwasser) [Alexy et al. 2003]. Im Rahmen der Verwendung bei der
Lebensmittelproduktion spielt das Ausbringen von Ausscheidungen (Gülle) zur Düngung auf
Böden eine besondere Rolle. Der Eintrag von nicht z.B. durch UV-Strahlung abgebauten
Antibiotika in Oberflächen- und ggf. auch Grundwasser ist dadurch möglich. Möglich ist aber
auch eine direkte Kontamination von pflanzlichen Lebensmitteln wie Salat, Tomaten Erd-
beeren (die in der Regel roh aufgenommen werden) durch Antibiotika-Rückstände oder
resistente Mikroorganismen.
Winckler und Grafe [2001] konnten in der Weser-Ems Region eine hohe Konzentration von
Antiinfektiva (Tetrazykline) in der Schweinegülle nachweisen. Die Tetrazykline konnten hierin
lange persistieren (genauere zeitliche Angaben liegen nicht vor). Die Autoren konnten das
Risiko bezüglich Resistenzentwicklung sowie die Auswirkungen auf die Umwelt und auf den
Menschen nicht quantifizieren. Sie sahen hier weiteren Forschungsbedarf.
5 Zusammenfassung
Ergebnisse und Diskussion
5.1 Problematik des Einsatzes von antibiotischen Substanzen in der Lebens-
Ein genereller Verzicht auf den Einsatz von Substanzen mit antibiotischer Wirkung bei
Lebensmittel liefernden Tieren ist unter Praxisbedingungen nicht zu realisieren; auch Tiere,
die zur Herstellung von Lebensmitteln dienen, müssen im Falle einer Erkrankung an einer
Infektionskrankheit wirksam therapiert werden können. Die Gabe von Antiinfektiva ist hierbei
unverzichtbar. Spezifische Risiken durch die Aufnahme von Rückständen dieser Arznei-
mittel durch den Menschen werden durch die Festlegung der MLR-Werte und deren Ein-
haltung (einschließlich des Verbotes der Anwendung bestimmter Substanzen) nach dem
aktuellen Stand des Wissens ausgeschlossen. Unspezifische Risiken (wie z.B. die Wir-
kungen einzelner Substanzen als Allergene) werden hierbei nicht berücksichtigt, ent-
sprechen jedoch entweder dem Risiko einzelner Lebensmittel wie Nüssen, Erdbeeren oder
Pilzen (z.B. Penicilline) oder wirken weniger allergisierend. Auswirkungen auf die Mikro-
biologie der menschlichen Darmflora bzw. auf Starterkulturen bei der weiteren Verarbeitung
(z.B. Käseherstellung) werden berücksichtigt. Die Resistenzentwicklung bei der therapeu-
tischen Gabe von Antiinfektiva beim Tier entspricht der therapeutischen Gabe beim
Menschen. Eine Risikoquantifizierung ist aufgrund der aktuellen Datenlage jedoch zur Zeit
ebenso wenig möglich wie eine Risikogewichtung oder ein Vergleich bestimmter einzelner
Substanzen oder Stoffgruppen. Hier besteht weiterer Forschungsbedarf.
Der Einsatz von Substanzen mit antibiotischer Wirkung in der Lebensmittelproduktion zur
Prophylaxe sowie die Verwendung zur Leistungsförderung weisen gegenüber der oben an-
gesprochenen therapeutischen Anwendung ein anderes Verhältnis von Nutzen und Risiko
auf. Hier stehen neben ethischen und wirtschaftlichen Faktoren wie beim therapeutischen
Einsatz überwiegend wirtschaftliche Vorteile gegen mögliche Risiken für Menschen, Tiere
und Umwelt, die abgewogen werden müssen. Der größte Anteil der eingesetzten Antiinfek-
tiva entfällt in der Lebensmittelproduktion auf die Lebensmittel tierischer Herkunft.
5.2 Risiken durch Antibiotikaeinsatz in der Produktion von Lebensmitteln
tierischer Herkunft
Die Risiken, die durch den Einsatz von Antibiotika in der Tiermast entstehen können, lassen
sich einteilen in direkte und indirekte Wirkungen:
Eine direkte Wirkung stellt die toxikologische Wirkung einer antibiotisch wirksamen Substanz
dar. Dieses Risiko entspricht den Risiken anderer in der Veterinärmedizin eingesetzter Medi-
kamente und ist abhängig von den pharmakologischen Eigenschaften der Stoffe bzw. Sub-
stanzen. Entsprechend der oben beschriebenen Regelungen (Arzneimittelgesetz AMG)
werden Substanzen in Abhängigkeit von ihrer Toxizität entweder gar nicht, nur in Aus-
nahmefällen oder nur für die entsprechenden Indikationen zugelassen. Die Festlegung der
MRLs und der einzuhaltenden Zeiten nach Applikation und deren Einhaltung stellt nach
aktuellem Erkenntnisstand die toxikologische Unbedenklichkeit sicher.
Ein weiteres Risiko stellt die Entwicklung von Antibiotikaresistenzen dar. Dieses Risiko ist
spezifisch für Antibiotika (bzw. Antiinfektiva und Antimykotika).
Resistenzen haben direkt wirkende und indirekt wirkende Risiken für die Verbraucher. Eine
unmittelbare Wirkung stellt eine Infektion mit einem Erreger aus dem Lebensmittel dar (z.B.
Zoonose). Bei Vorliegen einer Antibiotikaresistenz oder mehrerer Resistenzen (Multire-
sistenz) verschlechtern sich die Therapiemöglichkeiten dieser Infektion (z.B. bei Vorliegen
von Chinolon-Resistenz). Das Risiko einer längeren oder schwerer verlaufenden Erkrankung
Indirekt kann sich das Risiko schwerer zu therapierender Infektionserkrankungen bei Vor-
handensein vieler Resistenzen in der menschlichen Umwelt und bei Übertragung solcher
Resistenzen auf Keime, die den Menschen besiedeln, erhöhen.
Ergebnisse der Datenbankrecherchen zu diesen Risiken finden sich im Folgenden.
5.2.1 Entstehung von Resistenzen durch Gabe von Antibiotika in der Tiermast
Nach Durchsicht der im Rahmen der eingehenden Literaturrecherche gefundenen und als
relevant eingestuften Artikel gibt es im Fall des Glykopeptid-Antibiotikums Avoparcin eine
hohe Evidenz, dass ein Zusammenhang zwischen der Verwendung als Futtermittelzusatz
und dem Auftreten von Glykopeptid-resistenten Enterokokken (VRE) in Fäkalproben der da-
mit gefütterten Tiere besteht [u.a. Bager et al. 1996, Borgen et al. 2000]. Sowohl Geflügel-
scharen als auch Schweineherden wiesen einen positiven Zusammenhang zwischen Ver-
wendung von Avoparcin und Auftreten von VRE auf. Bemerkenswert ist nicht nur das Auf-
treten von VRE, sondern auch deren lange Persistenz ohne direkten, weiter bestehenden
Selektionsdruck [Borgen et al. 2000].
Die Anwesenheit von VRE in Fäkalproben der Tiere alleine reicht nicht aus, um einen
lückenlosen Zusammenhang zum Risiko für den Menschen herzustellen. Es wurden jedoch
in Proben von zum Verzehr hergestellten Fleischprodukten (sowohl Geflügel- als auch
Schweinefleisch) VRE gefunden [Del Grosso et al. 2000, Klare et al. 1995, Borgen et al.
2001]. Es handelt sich bei diesen Studienergebnissen um Untersuchungen aus euro-
päischen Staaten (Deutschland, Dänemark, Norwegen und Italien).
5.2.2 Übertragung von Resistenzen von Tieren aus der Tiermast auf den Menschen
Tierische Lebensmittel enthalten Mikroorganismen, die im Rahmen der Verarbeitung oder
des Verzehrs vom Menschen aufgenommen werden können. Bezüglich der Frage nach der
möglichen Übertragung von VRE aus Tierprodukten auf den Menschen konnten Studien-
ergebnisse nicht nur nachweisen, dass in humanen Stuhlproben VRE gefunden wurden,
sondern auch deren Verwandtschaft durch Übereinstimmung mikrobiologischer Eigen-
schaften (gleiche Resistenzgene, z.B. vanA bei Enterokokken) belegen [Simonsen et al.
1998, Borgen et al. 2000, Klare et al. 1999]. Die lückenlose Darstellung des Zusammen-
hangs von Resistenzentwicklung im Falle von Avoparcin mit dem Auftreten Glykopeptid-
resistenter Enterokokken beim Menschen führte schließlich zum Verbot des Antibiotikums
als Futtermittelzusatz in der EU [RKI 2003].
Studien bezüglich der Resistenzentwicklung unter Verwendung verschiedener anderer Anti-
biotika oder anderer Mikroorganismen kommen zu unterschiedlichen Ergebnissen. So
wurden in einer britischen Untersuchung unter Anwendung von Antibiotika keine erhöhten
Resistenzen bei Enterokokken gegenüber Avilamycin (Gemisch aus Oligosacchariden der
Orthosomycin-Gruppe) oder Tylosin (Makrolid) gefunden [Davies and Roberts 1999]. Jedoch
scheint hier die Aussagefähigkeit aufgrund der kleinen Zahl der Stichproben fragwürdig. Eine
Untersuchung in der Schweiz fand hingegen einen signifikanten Zusammenhang zwischen
Einsatz von Tylosin im Futtermittel und aufgetretener Resistenz in Fäkalproben der Tiere
[Boerlin et al. 2001].
5.2.3 Übertragung von resistenten Krankheitserregern von Tieren auf den Menschen
(Zoonosen)
Berichtet wird über das Auftreten neuer multiresistenter Salmonellen (Newport-MDRAmpC)
bei erkranktem Milchvieh und Menschen in den USA (häufiger therapeutischer Einsatz von
Cephalosporinen in der Milchviehwirtschaft) [Gupta et al. 2003]. Die Daten veranschaulichen
das weit verbreitete Vorkommen von Newport-MDRAmpC-Isolaten bei Menschen und
Rindern (Stuhlproben, Milch) und zeigen einen fünffachen Anstieg des Vorkommens resis-
tenter Salmonellen in Bezug auf Cephalosporine mit erweitertem Wirkungsspektrum
zwischen 1998 und 2001 primär durch das Auftreten von Newport-MDRAmpC-Isolaten und
eine Übertragung zwischen Tier und Mensch (Fall-Kontroll-Studie).
Eine weitere aktuelle Studie beschreibt hohe Resistenzraten von Enterokokken gegenüber
Moxifloxacin, Erythromycin, Glykopeptiden und Gentamicin. Letzteres ist auch in Kombi-
nation mit einem Aminopenicillin nicht mehr wirksam (High-Level-Resistenz) [Del Campo et
al. 2003]. Während die geschilderten Ergebnisse zu einer vorbeugend restriktiven Haltung
auf europäischer Seite führten (Verbot von Avoparcin, Begründung des tierärztlichen Ein-
satzes von Chinolonen etc.), ist die Meinungsbildung auf amerikanischer Seite nicht ab-
geschlossen [Richwine 2003].
Ökologische Fleischproduktion / Qualitätssigel
Ein aussagekräftiger mikrobiologischer Vergleich von Lebensmittelprodukten tierischer Her-
kunft aus konventioneller Produktion und aus ökologischem Landbau ist derzeit wegen
mangelnder Daten nicht möglich. Zur Erzeugung ökologischer tierischer Lebensmittel gibt es
viele Systeme, die u.a. auch unterschiedliche Tierrassen einsetzen, was die Vergleichbarkeit
erschwert [Honikel 1998].
Marketinggründe als Antwort auf vermutete Veränderungen im Verbraucherverhalten führten
zu einem Verzicht auf den (prophylaktischen) Einsatz von Antibiotika im begrenzten Umfang
durch die Einführung des neuen deutschen QS-Siegels, das Etablieren von Markenfleisch
und BIO-Fleisch. Das QS-Siegel, eine 'Qualitätsmarke' des fleischproduzierenden
Gewerbes, fordert den teilweisen Verzicht des Einsatzes von antibiotischen Leistungs-
förderern, bei Schweinen seit dem 1.1.2004, sowohl in der Mast als auch in der Aufzucht. Im
QS-Siegel sind regelmäßige Qualitätskontrollen beinhaltet. Verbraucherverbände fordern
allerdings auch hier Nachbesserungen [„Nur ein kleiner Schritt vorwärts"; DNR Deutschland-
Rundbrief 08.2002]. So wird beispielsweise bemängelt, dass für den Verbraucher nicht zu
erkennen sei, ob ein Betrieb die QS-Anforderungen vollständig oder nur teilweise erfülle
[http://www.dnr.de/publikationen/drb/archiv/drb02081.pdf]. Einige Markenfleisch-Anbieter und
BIO-Fleisch-Produzenten verzichten vollständig auf den Einsatz von Antibiotika zur
Leistungsförderung.
5.2.4 Risiken durch die Verwendung von Antibiotika in der Fischzucht
Besonders risikoreich ist die Anwendung des Antibiotikums Chloramphenicol in der
Garnelenzucht, wo es insbesondere in ostasiatischen Ländern eingesetzt wird. Chlor-
amphenicol kann beim Menschen zu einer irreversiblen aplastischen Anämie führen. Auf-
grund dieser toxischen Wirkung wird Chloramphenicol in den EU-Ländern nicht verwendet
und darf auch in importierten Lebensmitteln nicht nachweisbar sein.
5.3 Risiken durch Antibiotika bei der Erzeugung von Lebensmitteln pflanz-
licher Herkunft
Risiken durch den Gebrauch von Antibiotika oder Substanzen mit antibiotischer Wirkung bei
der Erzeugung von Lebensmitteln pflanzlicher Herkunft können in der Aufnahme resistenter
Keime oder der Aufnahme von Antibiotika-Rückständen durch antibiotisch behandelte
Pflanzen bestehen. In der Literatur [Österblad 1999] finden sich keine Hinweise auf einen
Zusammenhang der Prävalenz von Resistenzen mit dem Verzehr von Gemüse.
Der in Deutschland restriktive Einsatz von Streptomycin gegen den Feuerbrand führt nicht zu
Rückständen in Kernobst wie z.B. Äpfeln, da der Einsatz auf die Blütezeit der Obstbäume
limitiert ist. Problematisch ist hierbei jedoch die Möglichkeit der Kontamination von Honig.
Bienenflugverbote bei Antibiotikaeinsatz können das Risiko nicht vollständig ausschalten.
Insbesondere bei Import-Honig können Rückstände nachweisbar sein.
5.4 Risiken durch Desinfektionsmittel
Desinfektionsmittel, die bei der Lebensmittelherstellung (z.B. in einer Küche) eingesetzt
werden dürfen, erfüllen die hierfür notwendigen Kriterien bezüglich geringer Toxizität sowie
Geschmacks- und Geruchsneutralität. Gefahren hinsichtlich der Toxizität oder Resistenz-
entwicklung von Krankheitserregern bestehen nach aktuellem Wissensstand nicht. Die Des-
infektion in der Tiermedizin bzw. bei der Lebensmittelherstellung reduziert hingegen die
Gefahr von Infektionen sowohl bei Tieren als auch von Lebensmittelinfektionen und –intoxi-
kationen beim Menschen.
5.5 Probleme bei Rückständen antimikrobieller Substanzen in Lebensmitteln
Nach der Gabe von Arzneimitteln wie Antibiotika muss die gemäß EU-Richtlinien und Arz-
neimittelgesetz festgelegte Wartezeit bis zur Schlachtung oder der Produktgewinnung ein-
gehalten werden. In dieser Zeit sollte die Substanz gemäß der hierzu erstellten Gutachten
soweit abgebaut sein, dass die enthaltene Konzentration keine Gesundheitsgefahr mehr
darstellt. Ein Problem dabei ist, dass nicht jedes Tier ein Antibiotikum gleich schnell abbaut,
so dass im Extremfall trotz Einhaltung der festgelegten Wartezeiten die MRL-Werte über-
schritten werden könnten. Der in den MRL-Werten beinhaltete Sicherheitszuschlag schließt
hierbei jedoch ein toxikologisches Risiko nach dem aktuellen Stand des Wissens aus.
Zudem sind die Wartezeiten in der Praxis nur schwer kontrollierbar und die Vorschriften
können umgangen werden. Ein relevantes Resistenzrisiko durch Rückstände von Antibiotika
in Lebensmitteln ist bei Einhalten der MRL-Werte nach aktuellem Wissensstand nicht an-
Nach einem Bericht der Financial Times Deutschland waren hochwirksame Antibiotika bei-
spielsweise aus China als Chemikalien ohne die strengen Auflagen des Arzneimittelgesetzes
erhältlich [FTD vom 24.1.2001: ,Tierärztepräsident sieht Lücken beim Verbot von Anti-
biotika']. Über illegale Kanäle würden Schweinemäster das Verbot vieler Antibiotika im
Futtermittel umgehen, zumal Chemikalien mit antibiotischer Wirkung nicht generell unter das
Arzneimittelrecht fielen [ebda].
Rückstände von Antibiotika und Chemotherapeutika in Fleischproben eines großen
Schlachtbetriebes wurden in einer Untersuchung aus der Schweiz hauptsächlich bei Kälbern
gefunden. Die bedeutendsten Substanzklassen waren hierbei Tetrazykline, Sulfonamide und
Aminoglykoside [Jemmi und König 1999].
5.6 Risiken durch Konservierungsmittel
Die Verwendung von Natamycin, das zum Schutz von Hartkäse vor Schimmelpilzbildung
verwendet wird, ist aus toxikologischer Sicht nicht problematisch. Das Risiko besteht in einer
Resistenzentwicklung von Pilzen gegenüber Natamycin-haltigen Arzneimitteln, die z.B. zur
Behandlung einer Hornhautinfektion des Auges durch Hefepilze eingesetzt werden. Wenn
die Rinde der Würstchen bzw. des Käses vor dem Verzehr nicht - oder nicht ausreichend –
entfernt wird, geht der Verbraucher dieses Risiko ein, da er ggf. nicht mehr mit diesen Medi-
kamenten erfolgreich behandelt werden kann. Das Bundesinstitut für Risikobewertung (BfR)
empfiehlt in einer Stellungnahme vom 9. September 2003, die Verwendung von Natamycin
auf Lebensmittel zu beschränken, bei denen der Verbraucher die Rinde erkennen und ent-
fernen kann. Die Verwendung in anderen Lebensmitteln, bei denen die Rinde teilweise mit-
gegessen wird (z.B. Rohschinken oder Würstchen, deren Hülle vor dem Verzehr nicht ent-
fernt wird) sollte daher abgelehnt werden.
5.7 Risiken durch Rückstände antimikrobieller Substanzen in der Umwelt
Resistenzgene treten auch als Gene von natürlichen Resistenzen auf wie z.B. von Bakterien,
die mit vielen anderen Mikroorganismen in einer ökologischen Nische wie dem Erdboden
leben und sich somit Vorteile gegenüber ihren Konkurrenten um die dort vorkommenden
Nährstoffe verschaffen. Erdbodenbewohnende Bakterien bilden viele Antiinfektiva wie bei-
spielsweise auch die Leistungsförderer Flavophospholipol (Streptomyces ghanaensis),
Salinomycin (Streptomyces albus) und Avilamycin (Streptomyces viridochromogenes).
Natürliche Resistenzgene finden sich zum Teil auch häufig bei Bakterien, die natürlicher-
weise im Wasser vorkommen (z.B. bei nicht fermentierenden Bakterien wie Pseudomonas
spp., Stenotrophomonas spp. oder Burkholderia spp.), die dann auch (z.B. in Biofilmen) in
Wasserleitungen nachgewiesen werden können.
Diese Resistenzen sind Teil der Überlebensstrategie von Mikroorganismen und ihre Ent-
wicklung und Übertragung findet auch ohne Selektionsdruck durch vom Menschen produ-
zierte Antiinfektiva statt. Das Vorkommen der natürlichen Resistenzen in der Umwelt muss
bei der Risikoabschätzung von Auswirkungen durch die vom Menschen in die Umwelt einge-
brachten Antiinfektiva bedacht werden. Deren Eintrag liegt in der Regel deutlich unterhalb
der minimalen Hemmkonzentrationen und zumeist unterhalb der wirksamen (z.B. Selek-
tionsdruck erzeugenden) Konzentrationen. Über die Auswirkungen dieser niedrigen Kon-
zentrationen auf die Umwelt existieren keine durch Studien gesicherten wissenschaftlichen
Kenntnisse [Kümmerer 2004a]. Hier besteht weiterer Forschungsbedarf.
5.8 Alternative Möglichkeiten der Leistungssteigerung (Probiotika und
Prebiotika)
Unter Probiotika werden lebende Mikroorganismen verstanden, die nach Verabreichung
einen positiven Beitrag zur Gesunderhaltung und zum Wohlergehen des Wirtes leisten. Sie
können gesundheitsfördernd wirken und dadurch den prophylaktischen Einsatz von Anti-
biotika in der Tiermast verhindern oder zumindest verringern [Sauter and Blum 2003]. Die
wenigen Studien in der Humanmedizin zu diesem Thema kommen allerdings bedingt durch
die Unterschiedlichkeit der verwendeten Präparate (Bakterienstämme, Zubereitungsformen
und Dosierungen) zu unterschiedlichen Ergebnissen. Studien, die den klinischen Einsatz von
Probiotika molekularbiologisch untersuchen, gibt es in der Humanmedizin nur sehr wenige
und in der Veterinämedizin keine. Über den Einsatz von Probiotika als Leistungsförderer
finden sich in der Literatur sowohl Angaben über Leistungsverschlechterung als auch –ver-
besserungen, die sogar den Einsatz von Leistungsförderern mit antibiotischer Wirkung über-
treffen [Borger 2003]. Bei den Prebiotika handelt es sich um von Säugetieren nicht ver-
daubare Inhaltsstoffe, die sich jedoch positiv auf Wachstum und Aktivität einer begrenzten
Anzahl von Bakterienarten der Darmflora auswirken. Auch über deren Einsatz liegen nur
wenige, widersprüchliche Arbeiten vor [Bollmann 2002]. Insgesamt besteht also noch er-
heblicher Forschungsbedarf, um eine genauere Aussage über eine evtl. mögliche Substi-
tution von antibiotischen Leistungsförderern durch Pre- und Probiotika und deren Risiko-
potential vornehmen zu können.
Die unkritische Verwendung von antibiotisch wirkenden Substanzen in der Lebensmittel-
produktion hat, wie das Beispiel des Leistungsförderers Avoparcin zeigt, zu einem human-
medizinisch relevanten Resistenzproblem geführt. Für andere Substanzen als Avoparcin
liegen Hinweise und teilweise wissenschaftliche Belege vor.
Heute müssen bei geplantem großflächigem Einsatz von Substanzen mit erheblichem
Risikopotential für die Gesundheit (wie Antibiotika) Hersteller und Anwender zuvor belast-
bare Daten für die Sicherheit von Menschen, Tieren und der Umwelt zu Verfügung stellen.
Parallel dazu sollte ein kontinuierliches, engmaschiges Monitoring z.B. der Resistenz-
entwicklung erfolgen, das auch von den ‚Verursachern' finanziell getragen wird (und damit
letztlich von den Verbrauchern entsprechend produzierter Lebensmittel).
Nicht nur zum direkten Gesundheitsschutz (d.h. Vermeiden von Infektionen mit resistenten
Krankheitserregern), sondern auch zum Schutz von Ökosystemen (Boden, Wasser) sollte in
Anbetracht der ungenügenden Datenlage und aus Vorsorgegründen der Einsatz von Anti-
biotika generell auf ein notwendiges Mindestmaß beschränkt werden. Auf der gesundheits-
politischen Ebene ist bei der Lebensmittelproduktion v.a. entscheidend, dass die schon be-
stehenden Einschränkungen z.B. bei den Leistungsförderern konsequent eingehalten bzw.
überwacht werden und dass bestehende Lücken (z.B. zu wenige Kontrollen, illegale Be-
schaffung) geschlossen werden. Um Resistenzentwicklungen erfassen und bewerten zu
können, sollte neben einer Erfassung von Resistenzen in der Veterinärmedizin auch ein
System zur Erfassung des Verbrauchs von Antibiotika in der Tiermast, in der Veterinär-
medizin und der Humanmedizin aufgebaut werden. Nur bei Vorliegen von validen Daten ist
eine zuverlässige Risikobewertung möglich.
Insbesondere die Entwicklung der Verwendung von Chinolonen und deren Resistenz-
entwicklung sollte hierbei aufgrund der herausragenden Bedeutung dieser Substanzgruppe
in der Humanmedizin besondere Beachtung geschenkt werden. Vor allem die Resistenz-
entwicklungen gegenüber Fluorchinolonen bei Erregern von Zoonosen wie z.B. Salmonellen
und Campylobacter können erhebliche Einschränkungen der therapeutischen Möglichkeiten
in der Humanmedizin zur Folge haben.
Insgesamt gesehen besteht nach Durchsicht und Bewertung der gefundenen Artikel und der
damit zur Verfügung stehenden wissenschaftlichen Evidenz erheblicher weiterer
Forschungsbedarf, um eine genauere Aussage über die Risiken durch Antibiotika in der
Landwirtschaft vornehmen zu können.
Der Zusammenhang von Resistenzentwicklung und Einsatz von Antiinfektiva in der Fleisch-
produktion ist für Glykopeptide, Chinolone, Makrolide und Aminoglykoside evident. Gleiches
gilt für die Übertragung der Resistenztypen von Tieren zum Menschen bzw. umgekehrt. Die
Übertragung von resistenten Erregern von Zoonosen kann für chinolonresistente Campylo-
bacter spp. und gegenüber Breitspektrum-Cephalosporinen resistente Salmonellen als Er-
gebnis der vorliegenden Literaturrecherche als evident angesehen werden.
Der Verbraucher hat auch beim Konsum tierischer Produkte, die multiresistente Erreger ent-
halten, die Möglichkeit, das Risiko durch Hygienemaßnahmen bei der Zubereitung erheblich
zu reduzieren. Hierbei spielt vor allem das ausreichende Kochen bzw. Durchgaren von
Fleisch, Fisch und Eiern eine wesentliche Rolle. Roh verzehrte Lebensmittel wie Hackfleisch,
Rohwurst, Schinken und Weichkäse sollten sehr kritisch kontrolliert, ausgewählt oder ggf.
auch gemieden werden (z.B. vermeiden von Weichkäse aus unpasteurisierter Milch für
In Grenzen können Verbraucher diese Risiken durch ein bewusstes Verhalten verringern,
indem sie z.B. Lebensmittel einkaufen, bei deren Produktion die Verwendung antimikrobiell
wirksamer Substanzen auf ein Mindestmaß eingeschränkt wurde (z.B. Produkte mit QS-
Siegel oder bestimmte Markenfleisch-Sorten) oder besser Produkte, bei denen weitest-
gehend auf die Verwendung von Antiinfektiva verzichtet wird wie z.B. Öko-Erzeugnisse ge-
mäß EG-Öko-Verordnung (VO EWG Nr. 2092 / 91).
Die verantwortlichen Politiker sollten den generell eingeschlagenen Weg eines Verbotes an-
tibiotisch wirkender Substanzen zur Leistungsförderung beibehalten.
Durch den Verzicht auf die intensive Massentierhaltung können die hiermit verbundenen
Nebenwirkungen (wie z.B. in der Schweineproduktion die Schweinedysenterie verursacht
durch Brachyspira hyodysenteriae) vermieden werden und prophylaktische Gaben von
Antiinfektiva entbehrlich werden. Ein erheblicher Teil der Infektionsgefahr entsteht bei dieser
Tierhaltung durch Stress und auch ballaststoffarme Nahrung.
Die Verbesserung organisatorischer Maßnahmen in der Tierhaltung und die konsequente
Einhaltung von Hygienemaßnahmen wie z.B. Verfahren nach dem 'all in all out' Prinzip (d.h.
alle Tiere einer Herde gelangen gemeinsam in die Stallungen und verlassen diese auch ge-
meinsam) können das Auftreten von Infektionskrankheiten reduzieren.
Für die Therapie von Infektionskrankheiten, die auch Tieren für die Produktion von Lebens-
mitteln zusteht, sollte ein sorgfältiger Gebrauch der Antibiotika ('prudent use') erfolgen. Als
Prinzip hierfür dient - wie in der Humanmedizin - der Grundsatz, dass nach Möglichkeit
preiswerte ältere Antibiotika mit möglichst schmalem Spektrum verwendet werden sollten
und moderne oder Reserveantibiotika nur, falls keine anderen Therapieoptionen mehr
Insgesamt ist festzustellen, dass die wissenschaftliche Datenlage bezüglich des Verbrauchs
und Einsatzes von Antiinfektiva zum jetzigen Zeitpunkt nicht der Dimension der damit ver-
bundenen (potentiellen) Risiken entspricht. Dies gilt insbesondere vor dem Hintergrund, dass
diese Substanzen in erheblichen Mengen und auch großflächig eingesetzt werden. Nur mit
aussagekräftigen und nach aktuellen wissenschaftlichen Methoden erarbeiteten Daten
können valide Aussagen über die Risiken des Einsatzes von Antibiotika und Substanzen mit
antibiotischer Wirkung getroffen werden. Diese sind als Basis für die notwendigen gesund-
heitspolitischen Entscheidungen unverzichtbar.
7 Literaturverzeichnis
Aarestrup FM, Bager F, Jensen NE, Madsen M, Meyling A, Wegener HC. Surveillance of anti-microbial resistance in bacteria isolated from food animals to antimicrobial growth promoters and related therapeutic agents in Denmark. APMIS 1998;106: 606-22
Aarestrup FM. Association between decreased susceptibility to a new antibiotic for treatment
of human diseases, everninomicin (SCH 27899), and resistance to an antibiotic used for growth promotion in animals, avilamycin. Microbial Drug Resistance1998;4: 137-41
Aarestrup FM and Wegener HC. The effects of antibiotic usage in food animals on the
development of antimicrobial resistance of importance for humans in Campylobacter and Escherichia coli. Microbes & Infection 1999;1: 639-44
Aarestrup FM. Association between the consumption of antimicrobial agents in animal hus-
bandry and the occurrence of resistant bacteria among food animals. International Journal of Antimicrobial Agents 1999;12: 279-85
Aarestrup FM. Occurrence, selection and spread of resistance to antimicrobial agents used for growth promotion for food animals in Denmark. APMIS 2000; Supplementum 101: 1-48
Abrahim A, Papa A, Soultos N, Ambrosiadis I, Antoniadis A. Antibiotic resistance of Salmo-nella spp. and Listeria spp. isolates from traditionally made fresh sausages in Greece. Journal of Food Protection 1998;61: 1378-80
Acar J, Casewell M, Freeman J, Friis C, Goossens H. Avoparcin and virginiamycin as animal growth promoters: a plea for science in decision-making. Clin Microbiol Infect 2000;6: 477-82
Adesiyun AA, Webb LA, Romain HT. Prevalence and characteristics of Staphylococcus aureus strains isolated from bulk and composite milk and cattle handlers. Journal of Food
Protection 1998;61: 629-32
Ahl AS, Buntain B. Risk and the food safety chain: animal health, public health and the environment. Revue Scientifique et Technique 1997;16: 322-330
aid. Lasalocid in Eiern; Futtermittel wurden untersucht. aid-Presseinfo Nr. 3 / 04, 15.1.2004
Alderman DJ, Hastings TS. Antibiotic use in aquaculture: development of antibiotic resistance - potential for consumer health risks. International Journal of Food Science & Technology
1998;33: 139-155
Alexy R, Lange FT, Metzinger M, Wenz M, Sommer A, Kümmerer K. Verbrauch und Umwelt-konzentration von Antibiotika. GDCh-Buch (Jahrestagung) 2003, S. 143-147
Allerberger F, Lass-Floerl C, Dierich MP, Hirschl AM, Presterl E, Haas G, Klare I, Witte W.
Vancomycin-resistant enterococci in Austria. Wiener Klinische Wochenschrift 1997; 109: 312-320
Altekruse SF, Cohen ML, Swerdlow DL. Emerging foodborne diseases. Emerging Infectious
Diseases 1997; 3: 285-293
Altekruse SF, Stern NJ, Fields PI, Swerdlow DL. Campylobacter jejuni - an emerging food-borne pathogen. Emerging Infectious Diseases 1999; 5: 28-35
16. Ammon A, Bräuning J. Lebensmittelbedingte Erkrankungen in Deutschland. RKI,
Gesundheitsberichterstattung - Themenheft 01 / 02;2003
Anadon A, and Martinez-Larranaga MR. Residues of antimicrobial drugs and feed additives in animal products: regulatory aspects. Livestock Production Science 1999; 59: 183-198
Anderson SA; Woo RWY; Crawford LM. Risk assessment of the impact on human health of
resistant Campylobacter jejuni from fluoroquinolone use in beef cattle. Food Control 2001; 12: 13-25
Angulo FJ, Johnson KR, Tauxe RV, Cohen ML. Origins and consequences of antimicrobial-
resistant nontyphoidal Salmonella: implications for the use of fluoroquinolones in food animals. Microbial Drug Resistance 2000; 6:77-83
Anonym. Is human health at risk from animal drugs? Chemistry & Industry 1997; VOL: No.
Anonymous. Judicious antimicrobial-use principles, related proposals approved by board. J Am Vet Med Assoc 1999; 214: 167-8
Anonymous. Deut Tierärztebl 2001; 8: 841
Anthony F, Acar J, Franklin A, Gupta R, Nicholls T, Tamura Y, Thompson S, Threlfall EJ, Vose D, van Vuuren M, White DG; Office International des Epizooties Ad hoc Group. Antimicrobial resistance: responsible and prudent use of antimicrobial agents in veterinary medicine. Rev
Sci Tech 2001; 20: 829-39
Bager F, Aarestrup FM, Wegener HC. Dealing with antimicrobial resistance: The Danish ex-perience. Canadian Journal of Animal Science 2000; 80:223-228
Bager F, Madsen M, Christensen J, Aarestrup FM. Avoparcin used as a growth promoter is
associated with the occurrence of vancomycin-resistant Enterococcus faecium on Danish poultry and pig farms. Preventive Veterinary Medicine 1997;31:95-112
Bager F and Helmuth R. Epidemiology of resistance to quinolones in Salmonella. Vet Res
2001; 32: 285-90
Barber DA. New perspectives on transmission of foodborne pathogens and antimicrobial resistance. Journal of the American Veterinary Medical Association 2001; 218: 1559-1561
Bartlett J. Antibiotics and livestock. Infectious Diseases 1-2. 2003
Barton MD. Antibiotic use in animal feed and its impact on human health. Nutrition Research Reviews 2000; 13: 279-299
Barza M. Potential Mechanisms of Increased Disease in Humans from Antimicrobial
Resistance in Food Animals. Clinical Infectious Diseases 2002;34:S123-S125
Basilico JC, deBasilico MZ, Chiericatti C, Vinderola CG. Characterization and control of thread mould in cheese. Lett Appl Microbiol 2001;32:419-23
Bates J, Jordens JZ, Griffiths DT. Farm animals as a putative reservoir for vancomycin-resistant enterococcal infection in man. Journal Antimicrob Chemother 1994;34:507-14
Bates J. Epidemiology of vancomycin-resistant enterococci in the community and the relevance of farm animals to human infection. Journal of Hospital Infection 1997;37:89-101
Bellot M; Bouvarel I. Suppression des antibiotiques facteurs de croissance en aviculture: etat
des lieux et solutions alternatives. Suppression of antibiotic growth factors in poultry farming: current status and alternative solutions. Sciences & Techniques Avicoles 2000; No. 30; 16-27
Berche P. Transgenic plants and the resistance to antibiotics. Comptes Rendus de L'Academie D'Agriculture de France 2000;86:103-110
Berends BR, Bogaard AEJM van den, Knapen Fvan, Snijders JMA. Human health hazards associated with the administration of antimicrobials to slaughter animals. II. As assessment of the risks of resistant bacteria in pigs and pork.Veterinary Quarterly 2001; 23: 10-21
Bergogne-Berezin E, Courvalin P, Gehanno P, Demaresy J, Perronne C, and Ducluzeau R. Forum on bacterial resistances [French]. Presse Medicale 1998;27:1796-1800
BfR Symposium Risk Analysis zum Thema Antibiotika und Resistenzbildung mit Schwerpunkt
Tierzucht - Tagungsprotokoll Berlin 9. November 2003 Tagungsband liegt derzeit noch nicht vor (Juni 2004).
Bisignano G, Tomaino A, Lo Cascio R, Crisafi G, Uccella N, and Saija A. On the in-vitro anti-microbial activity of oleuropein and hydroxytyrosol. Journal of Pharmacy & Pharmacology
Blanco JE, Blanco M, Mora A, Blanco J. Prevalence of bacterial resistance to quinolones and other antimicrobials among avian Escherichia coli strains isolated from septicemic and healthy
chickens in Spain. J Clin Microbiol 1997; 35: 2184-5
Boerlin P, Wissing A, Aarestrup FM, Frey J, Nicolet J. Antimicrobial growth promoter ban and resistance to macrolides and vancomycin in enterococci from pigs. Journal of Clinical Micro-biology 2001; 39: 4193-5
Bollmann S. Untersuchungen zur Wirkung nichtantibiotischer Futterzusätze auf die Darmflora sowie den Verlauf einer experimentellen Escherichia coli- bzw. Salmonella Derby- Infektion bei Schweinen. Dissertation, Institut für Tierernährung der Tierärztlichen Hochschule Han-
Bonora MG, Boldrin C, Bragagnolo L, Cirelli L, De Fatima M, Grossato A, Ligozzi M, Lo Cascio G, Fontana R, Bordin C. Molecular analysis of vanA enterococci isolated from humans and
animals in northeastern Italy. Microb Drug Resist 2001;7:247-56
Borgen K, Simonsen GS, Sundsfjord A, Wasteson Y, Olsvik O, Kruse H. Continuing high pre-valence of VanA-type vancomycin-resistant enterococci on Norwegian poultry farms three years after avoparcin was banned. Journal of Applied Microbiology 2000;89: 478-85
Borgen K; Sorum M; Wasteson Y; Kruse H. VanA-type vancomycin-resistant enterococci (VRE) remain prevalent in poultry carcasses 3 years after avoparcin was banned. International Journal of Food Microbiology 2001; 64: 89-94
Brandt P. Antibiotika – Resistenzgene als Marker in genetisch veränderten Pflanzen. Bundes-gesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 1999;42:51-57
Brothers AM, Wyatt RD. The antifungal activity of natamycin toward molds isolated from com-mercially manufactured poultry feed. Avian Dis 2000;44:490-7
Brown SA. Fluoroquinolones in animal health. Journal of Veterinary Pharmacology & Thera-
peutics 1996;19:1-14
Burnens, Andre P. [Epidemiology and clinical significance of antimicrobial resistance in Campylobacter jejuni and C. coli.]. Mitteilungen aus Lebensmitteluntersuchung und Hygiene 2002;93:18-23
Butaye P, Damme Kvan, Devriese LA, Damme Lvan, Baele M, Lauwers S, Haesebrouck F. In vitro susceptibility of Enterococcus faecium isolated from food to growth-promoting and thera-peutic antibiotics. International Journal of Food Microbiology 2000; 54: 181-187
Butaye P, Devriese LA, Haesebrouck F. Antimicrobial growth promoters used in animal feed: effects of less well known antibiotics on gram-positive bacteria. Clin Microbiol Rev 2003; 16: 175-88
Bywater RJ. Benefits and microbiological risks of feed additive antibiotics. Feed manufacturing in the Mediterranean region. Recent advances in research and technology. Proceedings of the II Conference of Feed Manufacturers of the Mediterranean, Reus, Spain, 25-27 March, 1998. Cahiers Options Mediterraneennes 1999;37: 77-82
Campagnolo E, Johnson K, Karpati A, Rubin C, Kolpin D, Meyer M, Esteban J, Currier R, Smith K, Thu K, McGeehin M. Antimicrobial residues in animal waste and water resources proximal to large-scale swine and poultry feeding operations. The Science of the Total
Environment 2002;299:89-95
Carraminana JJ, Humbert F, Ermel G, Colin P. Molecular epidemiological investigation of Salmonella typhimurium strains related to an egg-borne outbreak. Research in Microbiology 1997(a);148:633-6
Carraminana JJ, Yanguela J, Blanco D, Rota C, Agustin AI, and Herrera A. Potential virulence determinants of salmonella serovars from poultry and human sources in spain. Veterinary Microbiology 1997(b);54:375-383
Catry B, Laevens H, Devriese LA, Opsomer G, Kruif A. Antimicrobial Resistance in Livestock. Journal of Veterinary Pharmacology and Therapeutics 2003;26:81-93
Chauvin C, Beloeil P-A, Orand J-P, Sanders P, and Madec F. A survey of group-level anti-
biotic prescriptions in pig production in France. Preventive Veterinary Medicine 2002;55:109-120
Cohen ML. Changing patterns of infectious disease. Nature 2000;406:762-7
Collignon PJ. Vancomycin-resistant enterococci and use of avoparcin in animal feed: Is there
a link? Medical Journal of Australia 1999; 171:144-152
Commission of the European Communities. Communication from the Commission on a com-munity strategy against animicrobial resistance. Brüssel, 20.6.2001
Conedera G, Marangon S, Chapman PA, Zuin A, and Caprioli A. Atypical strains of verocyto-toxin-producing escherichia coli o157 in beef cattle at slaughter in veneto region, italy. Journal of Veterinary Medicine 1997;Series B 44:301-306
Cooper RA, Molan PC, Krishnamoorthy L, Harding KG. Manuka honey used to heal a re-calcitrant surgical wound. European Journal of Clinical Microbiology & Infectious Diseases 2001;20:758-9
Cordano AM and Virgilio R. Evolution of drug resistance in Salmonella panama isolates in Chile. Antimicrobial Agents & Chemotherapy 1996;40:336-341
Cormican MG, Erwin ME, Jones RN. Avoparcin, a glycopeptide used in animal foods: anti-microbial spectrum and potency tested against human isolates from the United States.
Diagnostic Microbiology & Infectious Disease 1997; 29:241-8
Cruchaga S, Echeita A, Aladuena A, Garcia-Pena J, Frias N, and Usera MA. Antimicrobial resistance in salmonellae from humans, food and animals in Spain in 1998. Journal of Anti-
microbial Chemotherapy 2001;47:315-21
Curtis GD and Bowler IC. Prevalence of glycopeptide and aminoglycoside resistance in Enterococcus and Listeria spp. in low microbial load diets of neutropenic hospital patients.
International Journal of Food Microbiology 2001;64:41-9
Daly M, Buckley J, Power E, O'Hare C, Cormican M, Cryan B, Wall PG, Fanning S. Molecular characterization of Irish Salmonella enterica serotype typhimurium: detection of class I integrons and assessment of genetic relationships by DNA amplification fingerprinting. Applied
and environmental microbiology 2000;66: 614-9
D'Aoust J-Y. Salmonella and the international food trade. International Journal of Food Micro-biology 1994; 24: 11-31
Dasen G. Antibiotika-resistente Mikroorganismen in Lebensmitteln ETH Zürich 2000
Davies R, Roberts TA. Antimicrobial susceptibility of enterococci recovered from commercial swine carcasses: effect of feed additives. Letters in Applied Microbiology 1999; 29: 327-33
Davis MA, Hancock DD, and Besser TE. Multiresistant clones of Salmonella enterica: The im-
portance of dissemination. Journal of Laboratory & Clinical Medicine 2002;140:135-41
del Campo R, Ruiz-Garbajosa P, Sanchez-Moreno MP, Baquero F, Torres C, Canton R, Coque TM. Antimicrobial resistance in recent fecal enterococci from healthy volunteers and
food handlers in Spain: genes and phenotypes. Microb Drug Resist 2003;9:47-60
Descheemaeker PRM, Chapelle S, Devriese LA, Butaye P, Vandamme P, and Goossens H. Comparison of glycopeptide-resistant enterococcus faecium isolates and glycopeptide
resistance genes of human and animal origins. Antimicrobial Agents & Chemotherapy 1999; 43:2032-2037
de Ruig WG. Determination of natamycin in cheese and cheese rind: interlaboratory collabo-rative study. J Assoc Off Anal Chem 1987;70:949-54
Deutz A, Obritzhauser W, Kofer J. Zur resistenz von staphylokokken im Mastitisgeschehen. Tierärztliche Umschau 1998;53; 10:597-598, 600-601
Donabedian SM, Thal LA, Hershberger E, Perri MB, Chow JW, Bartlett P, Jones R, Joyce K,
Rossiter S, Gay K, Johnson J, Mackinson C, Debess E, Madden J, Angulo F, Zervos MJ. Molecular characterization of gentamicin-resistant Enterococci in the United States: evidence of spread from animals to humans through food. J Clin Microbiol. 2003; 41:1109-13
Endtz HP, Ruijs GJ, Vanklingeren B, Jansen WH, Vanderreyden T, and Mouton RP. Quinolone Resistance in Campylobacter Isolated from Man and Poultry Following the Intro-duction of Fluoroquinolones in Veterinary-Medicine. Journal of Antimicrobial Chemotherapy
Endtz H, Van Den Braak N, Van Belkum A, Van Keulen M, Vliegenthart J, and Verbrugh HA. High prevalence and clonal spread of Tn1546, a transposon conferring resistance to vancomycin in enterococci from humans and consumer poultry. Abstracts of the Interscience
Conference on Antimicrobial Agents & Chemotherapy 1997;37:70
Engberg J, Aarestrup F, Taylor D, Gerner-Smidt P, Nachamkin I. Quinolone and Macrolide Resistance in Campylobacter jejuni and C.coli: Resistance Mechanisms and Trends in Human
Isolates. Emerging Infectious Diseases 2001;7:
Espinasse J. Responsible use of antimicrobials in veterinary medicine: perspectives in France. Veterinary Microbiology 1993;35(3-4):289-301
Eubel C. Tierärztepräsident sieht Lücken beim Verbot von Antibiotika. Financial Times Deutschland 24.1.2001
Evans M, Wegener H. Antimicrobial Growth Promotors and Salmonella spp., Campylobacter spp. In Poultry and Swine, Denmark. Emerging Infectious Diseases 2003;9:
Farrington LA, Harvey RB, Buckley SA, Stanker LH, Inskip PD. A preliminary survey of anti-biotic resistance of Salmonella in market-age swine. Adv Exp Med Biol 1999; 473: 291-7
Farrington LA, Harvey RB, Buckley SA, Droleskey RE, Nisbet DJ, Inskip PD. Prevalence of
antimicrobial resistance in Salmonellae isolated from market-age swine. J Food Prot 2001; 64: 1496-502
Ferber D. WHO advises kicking the livestock antibiotic habit. Science ; 301:1027.2003
Fields P, Swerdlow D. Campylobacter jejuni. Clinics in Laboratory Medicine 1999;19(3):489-
Franklin A, Acar J, Anthony F, Gupta R, Nicholls T, TamuraY, Thompson S, Threlfall EJ,Vose D, van vuuren M, White DG, Wegener HC, Costarrica ML, Office International des Epizooties Ad hoc Group. Antimicrobial resistance: harmonisation of national antimicrobial resistance-
monitoring and surveillance programmes in animals and in animal-derived food. 2001;20:859-70
Franz CMAP, Holzapfel WH , and Stiles ME. Enterococci at the crossroads of food safety?
International Journal of Food Microbiology 1999;47:1-24
Frediani-Wolf V and Stephan R. Resistance patterns of Campylobacter spp. strains isolated from poultry carcasses in a big Swiss poultry slaughterhouse. Int J Food Microbiol 2003; 89: 233-40
Gambarotto K, Ploy M-C , Dupron F, Giangiobbe M, and Denis F. Occurrence of vancomycin-resistant enterococci in pork and poultry products from a cattle-rearing area of France. Journal of Clinical Microbiology 2001;39:2354-2355
Garau J, Xercavins M, Rodriguez-Carballeira M, Gomez-Vera JR, Coll I, Vidal D, Llovet T, and Ruiz-Bremon A. Emergence and dissemination of quinolone-resistant escherichia coli in the community. Antimicrobial Agents & Chemotherapy 1999;43:2736-2741
Gaunt PN and Piddock LJV. Ciprofloxacin resistant campylobacter spp in humans - an epide-miological and laboratory study. Journal of Antimicrobial Chemotherapy 1996;37:747-757
Girardeau JP, Lalioui L, Ou Said AM, Champs Cde, Bouguenec Cle. Extended virulence
genotype of pathogenic Escherichia coli isolates carrying the afa-8 operon: evidence of similarities between isolates from humans and animals with extraintestinal infections. Journal of Clinical Microbiology 2003; 41: 218-226
Golding S, Yaron S, White D, and Matthews K. Escherichia coli O157:H7: Cross-resistance to
antibiotics and food preservatives. Abstracts of the General Meeting of the American Society for Microbiology 2001;101:212-213
Goldmann DA. The epidemiology of antimicrobial resistance. Ecosystem Health 1999;5:158-
Goldsmith RS and Schur PM. Use of subtherapeutic antibiotics in livestock (as supplements or feed additives) with the induction of resistance in human bacterial pathogens, the magnitude
and complexity of the problem become increasingly clear. Journal of environmental health 2002; 65: 7, 21
Gonzales RD, Schreckenberger PC, GrahamMB, Kelkar S, Quinn JP. Infections due to vancomycin-resistant Enterococcus faecium resistant to linezolid. Lancet 2001;357:1179
Gorbach SL. Antimicrobial use in animal feed - time to stop. New England Journal of Medicine 2001; 345: 1202-1203
Grave K, Lingaas E, Bangen M, and Ronning M. Surveillance of the overall consumption of
antibacterial drugs in humans, domestic animals and farmed fish in Norway in 1992 and 1996. Journal of Antimicrobial Chemotherapy 1999;43:243-252
Greenpeace-Report. Antibiotika in der industriellen Meeresfrüchte-Produktion. Februar 2001 (http://archiv.greenpeace.de/GP_DOK_3P/HINTERGR/C10HI89.PDF)
Greenlees KJ. Animal Drug Human Food Safety Toxicology and Antimicrobial Resistance - the Square Peg. International Journal of Toxicology 2003;22:131-4
Greko C. Antibiotics as growth promoters. Acta Veterinaria Scandinavica – 1999; Supplement
103. Grosso MD, Caprioli A, Chinzari P, Fontana MC, Pezzotti G, Manfrin A, Giannatale ED,
Goffredo E, and Pantosti A. Detection and characterization of vancomycin-resistant entero-
cocci in farm animals and raw meat products in Italy. Microbial Drug Resistance 2000;6:313-8
Gupta A, Fontana J, Crowe C, Bolstorff B, Stout A, Van Duyne S, Hoekstra MP, Whichard JM, Barrett TJ, Angulo FJ. Emergence of Multidrug-Resistant Salmonella enterica Serotype New-port Infections Resistant to Expanded-Spectrum Cephalosporins in the United States. The
Journal of Infectious Diseases 2003;188:1707-16
105. Gustafson RH. Historical perspectives on regulatory issues of antimicrobial resistance.
Veterinary & Human Toxicology 1993;35 Suppl 1:2-5
Hässig M. Use of milk from diseased quarters to feed calves and consequences for the public health Schweizer Archiv fuer Tierheilkunde 1999; 141: 125-129
107. Hakanen A, Jousimies-Somer H, Siitonen A, Huovinen P, Kotilainen P. Fluoroquinolone
Resistance in Campylobacter jejuni Isolates in Travelers Returning to Finland: Association of Ciprofloxacin Resistance to Travel Destination. Emerging Infectious Diseases 2003; 9: 267-
Hamer DH, Gerald J, Friedman DR, Gill CJ. From the Farm to the Kitchen Table: the Negative Impact of Antimicrobial Use in Animals on Humans. Nutrition Reviews 2002;60:261-4
Hammes WP. Safety Assessment of Lactic Acid Bacteria and Probiotics. Monatsschrift Kinder-
heilkunde - Organ der Deutschen Gesellschaft fuer Kinderheilkunde und Jugendmedizin 1998;146:S31-S38
Hatha AAM and Lakshmanaperumalsamy P. Antibiotic resistance of Salmonella strains iso-
lated from fish and crustaceans. Letters in Applied Microbiology 1995;21:47-49
Hattan D, Kahl L. Current developments in food additive toxicology in the USA. Toxicology 2002;181-182:417-420
Heinzl S. Antibiotika in der Tierhaltung. MMP 1997;Editorial 6:145
113. Heir E, Langsrud S, Sidhu MS, Steinbakk M. Can disinfectants contribute to antibiotic
resistance? Tidsskr Nor Laegeforen 2001; 121: 3201-6
Helmuth R and Protz D. How to modify conditions limiting resistance in bacteria in animals and
other reservoirs. Clin Infect Dis 1997; 24 Suppl 1: 136-8
115. Helmuth R. Einsatz antimikrobiell wirksamer Substanzen in der Veterinärmedizin. Bundes-
gesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 1999;42:26-34
Herbers K, Conradsstrauch J, and Bonas U. Race-Specificity of Plant-Resistance to Bacterial Spot Disease Determined by Repetitive Motifs in a Bacterial Avirulence Protein. NATURE 1992;356:172-174
Heuer OE, Pedersen K, Jensen LB, Madsen M, and Olsen JE. Persistence of vancomycin-
resistant enterococci (VRE) in broiler houses after the avoparcin ban. Microbial Drug Resistance-Mechanisms Epidemiology & Disease 2002;8:355-61
Hilbert F, Rippel-Rachle B, Paulsen P, Smulders FJM. Die Bedeutung antibiotikaresistenter
Keime im Lebensmittel tierischer Herkunft. Wiener Tierarztliche Monatsschrift 2001;88; 4:97-105
Hildebrandt, G. Lebensmittelsicherheit: vermeintliche und reale Risiken. Bundesgesundheits-
blatt – Gesundheitsforschung – Gesundheitsschutz 2002; 6:473
Holliger E, Schärer HJ, Vogelsanger J, Schoch B und Duffy B. 15 Jahre Feuerbrand in der Schweiz Erfahrungen und getroffene Massnahmen. Z. Obst-Weinbau 2003; 7
Hollinger KA, Bager F, Marano N, Angulo F, Aaerstrup FM, Tollefson L, Gerner-Smidt P, and
Wegener HC. Aminoglycoside (AG) resistance in Salmonella serotype typhimurium (STm) in the United States (US) and Denmark (DK): An association between resistance and AG use in food animals, particularly in US poultry. Abstracts of the Interscience Conference on Anti-
microbial Agents & Chemotherapy 1999;39:101
122. Honikel KO. Qualität ökologisch erzeugter Lebensmitteltierischer Herkunft. Dtsch Tierärztl
Wschr 1998; 105: 327-329
Honikel K. Rückstände und Kontaminaten in Fleisch. Ernährung und Medizin 2002;17:187-194
Honkanen-Buzalski T; Suhren G. Residues of antimicrobial agents in milk and their signifi-cance to public health and milk processing. Bulletin of the International Dairy Federation 1999;
VOL: No. (345,): 11-12
Hoszowski A; Wasyl D. Salmonella spp. found in wastes, sewage sludge, compost and their antimicrobial resistance. Bulletin of the Veterinary Institute in Pulawy 2001;45;2:163-170
126. http://europa.eu.int/eur-lex/en/com/cnc/2001/act333en01/com2001_0333en01-02.pdf - Seite
eingesehen am 12.03.2004
127. http://www.evz.de/food/antibiotika-futtermittel.html - Seite eingesehen am 04.03.2004
128. http://www.animal-health-online.de/drms/rinder/schweden.htm - Seite eingesehen am
129. http://www.cis.tugraz.at/orgc/hoegroup/chem_ges/2002_ULLY_2.pdf - Seite eingesehen
130. http://www.ifahsec.org/International/publications/han1-3.htm - Seite eingesehen 28.04.2004
131. Jemmi T and König M. Rückstände von Antibiotika und Chemotherapeutika in Fleisch.
Residues of antibiotics and chemotherapeutics in meat. Schweizer Archiv für Tierheilkunde 1999; 141: 109-13
132. Johnston AM. Animals and antibiotics. International Journal of Antimicrobial Agents
133. Kamphues J. The discussion on growth-promoting feed additives-willing or not, veterinary
nutritionists are especially involved. Journal of Animal Physiology & Animal Nutrition-Zeitschrift fur Tierphysiologie Tierernahrung und Futtermittelkunde 1998;80:260-269
Kamphues J. Antibiotic growth promoters for the view of animal nutrition. Berl Munch Tierarztl Wochenschr 1999; 112: 370-9
Kelley TR, Pancorbo OC, Merka WC, and Barnhart HM. Antibiotic resistance of bacterial litter isolates. Poultry Science 1998;77:243-247
Khan AA, Nawaz MS, Khan SA, Steele R. Detection and Characterization of Erythromycin-
Resistant Methylase Genes in Gram-Positive Bacteria Isolated From Poultry Litter. Applied Microbiology and Biotechnology 2002;59:377-81
Khan MKR, Malik A. Antibiotic resistance and detection of beta-lactamase in bacterial strains
of Staphylococci and Escherichia coli isolated from foodstuffs. World Journal of Microbiology and Biotechnology 2001;17: 863-868
Kietzmann M. Arzneimittel-Einsatz bei Tieren: Aktuelle Probleme und Konsequenzen. Fleisch-wirtschaft 2001;81,7:15-16
Kim AY and Thayer DW. Mechanisms by which gamma irradiation increases the sensitivity of Salmonella typhimurium ATCC 14028 to heat. Applied & Environmental Microbiology 1996;62:1759-1763
King L, Khabbaz R. Converging Issues in Veterinary and Public Health. Emerging Infectious Diseases 2003;9:
141. Kist M. Food-borne Campylobacter infections. Bundesgesundheitsblatt - Gesundheits-
forschung - Gesundheitsschutz 2002;45:497-506
Kjerulf A, Pallesen L, Westh H. Vancomycin-resistant enterococci at a large university hospital
in Denmark. APMIS 1996;104:475-479
Klare I, Heier H, Claus H, Bohme G, Marin S, Seltmann G, Hakenbeck R, Antanassova V, Witte W. Enterococcus faecium strains with vanA-mediated high-level glycopeptide resistance isolated from animal foodstuffs and fecal samples of humans in the community. Microb Drug
Resist 1995; 1: 265-72
Klare I, Badstubner D, Konstabel C, Bohme G, Claus H, Witte W. Decreased incidence of VanA-type vancomycin-resistant enterococci isolated from poultry meat and from fecal
samples of humans in the community after discontinuation of avoparcin usage in animal hus-bandry. Microbial Drug Resistance 1999;5:45-52
Klein G, Pack A, Reuter G. Antibiotic resistance patterns of enterococci and occurrence of
vancomycin-resistant enterococci in raw minced beef and pork in Germany. Applied & Environmental Microbiology 1998;64:1825-30
146. Klein G. Lebensmittel als potentielle Vektoren fur Antibiotikaresistenzen. 2. Mitteilung: Be-
deutung von Milchsaurebakterien. Berliner und Munchener Tierarztliche Wochenschrift
2000;113;2:46-52
Klein G. Food as a potential vector for antibiotic resistance. 1. Relevance of residues and selected foodborne infections and intoxicants. [German]. Berliner und Munchener Tierarztliche
Wochenschrift 1999;112:365-9
Kleter GA, Kuiper HA. Considerations for the assessment of the safety of genetically modified animals used for human food or animal feed. Livestock Production Science 2002; 74: 275-285
Kondo J K and Johansen E. Product development strategies for foods in the era of molecular
biotechnology. Antonie van Leeuwenhoek 2002;82:291-302
Kümmerer K, Daschner F. Do antibiotics in the environment promote resistance? Institute of Environmental Medicine and Hospital Epidemiology. Freiburg University Hospital. 2003
151. Kümmerer K and Henninger A. Promoting resistance by the emission of antibiotics from
hospitals and households into effluent. Clin. Microbiol. Infect. 2003; 9: 1203-14
Kümmerer K. Sigificance of antibiotics in the environment. Journal of Antimicrobial Chemo-
therapy 2003;52:5-7
Kümmerer K (Hrsg.). Pharmaceuticals in the Environment. Springer Berlin 2004
Kümmerer K. Resistance in the environment. Journal of Antimicrobial Chemotherapy 2004; Advance Access published June 23
L'Abee-Lund TM and Sorum H. Class 1 integrons mediate antibiotic resistance in the fish pathogen Aeromonas salmonicida worldwide. Microbial Drug Resistance 2001;7:263-272
Lack G. Clinical risk assessment of GM foods. Toxicology letters 2002; 127: 337-40
Lathers CM. Clinical pharmacology of antimicrobial use in humans and animals. Journal of Clinical Pharmacology 2002(a);42:587-600
Lathers CM. Risk assessment in regulatory policy making for human and veterinary public health. Journal of Clinical Pharmacology 2002(b);42:846-66
Lathers CM. Role of veterinary medicine in public health: antibiotic use in food animals and
humans and the effect on evolution of antibacterial resistance. Journal of Clinical Pharma-cology 2001;41:595-9
Laval A. Veterinary usage of antibiotics and resistance in human: What kind of links? Patho-logie et Biologie 2000;48:940-944
Lees P. Antimicrobial drug resistance and veterinary therapeutics. Vet Rec 2002; 151: 454-5
Lemcke R and Bülte M. Occurrence of the vancomycin-resistant genes vanA, vanB, vancl, vanC2 and vanC3 in Enterococcus strains isolated from poultry and pork. International Journal
of Food Microbiology 2000;60:185-94
Mammina C, Cannova L, Massa S, Goffredo E, and Nastasi A. Drug resistances in salmonella isolates from animal foods, Italy 1998-2000. Epidemiology & Infection 2002;129:155-161
Mardh PA, Hovelius B, Hovelius K, and Nilsson PO. Coagulase-negative, novobiocin-resistant staphylococci on the skin of animals and man, on meat and in milk. Acta Veterinaria Scan-dinavica 1978;19:243-53
Marre R, Scheringer I, Erb A, Zeitler HP, Stuermer T, and Brenner H. Prevalence of Antibiotic
Resistance of E. coli in the General Population. Bundesgesundheitsblatt - Gesundheits-forschung - Gesundheitsschutz 2002;45:130-137
Martel J-L, Tardy F, Sanders P, and Boisseau J. New trends in regulatory rules and sur-
veillance of antimicrobial resistance in bacteria of animal origin. Veterinary Research (Paris) 2001;32:381-392
Mayr A. Illegale Antibiotika und Hormone in der Schweinemast. Gesundheitsrisiko Fleisch? Illegal antibiotics and hormones in swine raisin. Is the meat a health risk? MMW Fortschritte
der Medizin 2001; 143: 16
McConnell J. Risk of untreatable infection is growing. Lancet 1996;347:1471
McDermott PF, Zhao S, Wagner DD, Simjee S, Walker RD, and White DG. The food safety
perspective of antibiotic resistance. Animal Biotechnology 2002;13:71-84
McDonald LC, Kuehnert MJ, Tenover FC, and Jarvis WR. Vancomycin-resistant enterococci outside the health-care setting: prevalence, sources, and public health implications. Emerging
Infectious Diseases 1997;3:311-7
171. Mehall JR, Kite CA, Gilliam CH, Jackson RJ, Smith SD. Enteral Feeding Tubes Are a
Reservoir for Nosocomial Antibiotic-Resistant Pathogens. Journal of Pediatric Surgery 2002;37:1011-2
Millar MR, Walsh TR, Linton CJ, Zhang S, Leeming J P, Bennett PM, and ALSPAC Study Team. Carriage of antibiotic-resistant bacteria by healthy children. Journal of Antimicrobial Chemotherapy 2001;47:605-610
Mitchell MJ, Yee AJ. Antibiotic use in animals and transfer of drug resistance to humans: should we stop treating animals with these drugs? Dairy, Food and Environmental Sanitation 1995; 15: 484-485
Mitema ES, Kikuvi GM, Wegener HC, and Stohr K. An assessment of antimicrobial consump-tion in food producing animals in Kenya. Journal of veterinary pharmacology and therapeutics 2001; 24: 385-90
Molbak K, Baggesen DL, Aarestrup FM, Ebbesen JM, Engberg J, Frydendahl K, Gerner-Smidt P, Petersen AM, and Wegener HC. An outbreak of multidrug-resistant, quinolone-resistant salmonella enterica serotype typhimurium dt104. New England Journal of Medicine 1999;341:1420-1425
Molbak K, Gerner-Smidt P, and Wegener HC. Increasing quinolone resistance in Salmonella enterica serotype Enteritidis. Emerging Infectious Diseases 2002;8:514-5
Moore JE, Crowe M, Heaney N, and Crothers E. Antibiotic resistance in Campylobacter spp.
isolated from human faeces (1980-2000) and foods (1997-2000) in Northern Ireland: an update. Journal of Antimicrobial Chemotherapy 2001;48:455-7
178. Motschall E. Literaturdatenbanken für die Medizin. http://www.imbi.uni-
freiburg.de/biblio/evi.htm 2004
Murphy TM, McNamara E, Hill M, Rooney N, Barry J, Egan J, O'Connell A, O'Loughlin J, McFaddyen. Epidemiological studies of human and animal Salmonella Typhimurium DT104 and DT104b isolates in Ireland. Epidemiology and Infection 2001; 126: 3-9
Nachamkin I, Ung H, Li M. Increasing Fluoroquinolone Resistance in Campylobacter jejuni, Pennsylvania, USA, 1982-2001. Emerging Infectious Diseases 2002;8:1501-03
181. Nair US, Saeed AM, Muriana PM, Kreisle RA, Barrett B, Sinclair CL, and Fleissner ML.
Plasmid profiles and resistance to antimicrobial agents among Salmonella enteritidis isolates from human beings and poultry in the midwestern United States. Journal of the American Veterinary Medical Association 1995; 206: 1339-44
nano online. Feuerbrandbekämpfung; Antibiotikum im Honig.
www.3sat.de/nano/astuecke/15497/, 12.02.2001
Nap JP, Bijvoet J, Stiekema WJ. Biosafty of kanamycin-resistant transgenic plants. Transgenic Research 1992;1:239-249
Nascimento SM, dos Fernandes Vieira RH, Theophilo GN, Dos Prazeres Rodrigues D, Vieira GH. Vibrio vulnificus as a health hazard for shrimp consumers. Revista do Instituto de Medicina Trooical de Sao Paulo 2001;43:263-6
Nolen S. FDA petitioned to ban certain food-animal antimicrobials used in human medicine. JAVMA 1999; 214:1137
Novick R. The development and spread of antibiotic-resistant bacteria as a consequence of feeding antibiotics to livestock. Annals of the New York Academy of Sciences 1981;386:23-59
187. O Brien TF, DiGiorgio J, Parsonnet KC, Kass EH, Hopkins JD. Plasmid diversity in
escherichia-coli isolated from processed poultry and poultry processors. Veterinary Micro-biology 1993;35:243-255
Österblad M, Pensala O, Peterzens M, Heleniusc H, Huovinen P. Antimicrobial susceptibility of Enterobacteriaceae isolated from vegetables. Journal of Antimicrobial Chemotherapy 1999.;43:503-9
189. Orden Gutierrez JA and de la Fuente Lopez R. Impact on public health of quinolone
resistance in animal-origin bacteria. Rev Esp Salud Publica 2001; 75: 313-20
Pantosti A, Del Grosso M, Tagliabue S, Macri A, and Caprioli A. Decrease of vancomycin-
resistant enterococci in poultry meat after avoparcin ban. Lancet 1999;354:741-2
Parsonnet KC and Kass EH. Does prolonged exposure to antibiotic-resistant bacteria increase the rate of antibiotic-resistant infection? Antimicrobial Agents & Chemotherapy 1987;31:911-4
Pedersen KB, Aarestrup FM, Jensen NE, Bager F, Jensen LB, Jorsal SE, Nielsen TK, Hansen
HC, Meyling A, and Wegener HC. The need for a veterinary antibiotic policy. The Veterinary Record 1999; 145: 50-3
Perreten V, Schwarz F, Cresta L, Boeglin M, Dasen G, and Teuber M. Antibiotic resistance
spread in food. Nature 1997;389:801-2
Phillips I. The use of bacitracin as a growth promoter in animals produces no risk to human health. Journal of Antimicrobial Chemotherapy 1999;44:725-8
195. Piddock LJ, Ricci V, Pumbwe L, Everett MJ, Griggs DJ. Fluoroquinolone resistance in
Campylobacter species from man and animals: detection of mutations in topoisomerase genes. J Antimicrob Chemother 2003;51:19-26
196. Piddock LJ. Fluoroquinolone resistance in Salmonella serovars isolated from humans and
food animals. FEMS Microbiology Reviews 2002;26:3-16
Piddock LJ, Ricci V, Stanley K, and Jones K. Activity of antibiotics used in human medicine for Campylobacter jejuni isolated from farm animals and their environment in Lancashire, UK.
Journal of Antimicrobial Chemotherapy 2000;46:303-306
Pohl P, Glupczynski Y, Marin M, Van Robaeys G, Lintermans P, and Couturier M. Replicon typing characterization of plasmids encoding resistance to gentamicin and apramycin in Escherichia coli and Salmonella typhimurium isolated from human and animal sources in
Belgium. Epidemiology & Infection 1993;111:229-238
QS-Fleischsiegel ‚nur ein kleiner Schritt vorwärts'. DNR Deutschland-Rundbrief 08.02; 8
QS Verbraucherseite http://www.q-s.info/verbraucher/about_us/kriterien
201. Quirk M. Antibiotic-resistant bacteria in food animals on the rise. The Lancet Infectious
Diseases 2001; 1: 293
Rabsch W, Tschaepe H, and Baumler AJ. Non-typhoidal salmonellosis: Emerging problems.
Microbes & Infection 2001;3:237-247
Rerat A. Impact of the agricultural and food sector on public health in Europe. Medecine et Nutrition 1991;27:229-239
Richard J. Des antimicrobiens naturels pour des fromages sains. Natural antimicrobials for
safe cheeses. Biofutur 1998;177:28-30
Richwine L. US Outlines Stepps to study animal antibiotic risk. Reuters health information 2003, 23. Oktober
Riley MA and Wertz JE. Bacteriocins: evolution, ecology, and application. Annual Review of Microbiology 2002.;56:117-37
Robert Koch Institut (RKI). Surveillance nosokomialer Infektionen sowie die Erfassung von Erregren mit speziellen Resistenzen und Multiresistenzen. Bundesgesundheitsbl – Gesund-heitsforsch – Gesundheitsschutz 2000; 43: 887-890
Robert Koch Institut (RKI). Verbot von Antibiotika als Leistungsförderer in der Tiermast. Epi-demiologisches Bulletin 2003; 41: 329-331
Roosen J, Hennessy DA. An equilibrium analysis of antibiotics use and replanting decisions in apple production. Journal of Agricultural and Resource Economics 1999;26; 2:539-553
210. Ruiz J, Capitano L, Nunez L, Castro D, Sierra JM, Hatha M, Borrego JJ, and Vila J.
Mechanisms of resistance to ampicillin, chloramphenicol and quinolones in multiresistant salmonella typhimurium strains isolated from fish. Journal of Antimicrobial Chemotherapy
Saenz Y, Zarazaga M, Brinas L, Lantero M, Ruiz-Larrea F, and Torres C. Antibiotic resistance in Escherichia coli isolates obtained from animals, foods and humans in Spain. International
Journal of Antimicrobial Agents 2001;18:353-8
212. Saenz Y, Zarazaga M, Lantero M, Gastanares MJ, Baquero F, and Torres C. Antibiotic
resistance in Campylobacter strains isolated from animals, foods, and humans in Spain in 1997-1998. Antimicrobial Agents & Chemotherapy 2000;44:267-71
Salisbury JG, Nicholls TJ, Lammerding AM, Turnidge J, and Nunn MJ. A risk analysis frame-work for the long-term management of antibiotic resistance in food-producing animals. Inter-national Journal of Antimicrobial Agents 2002;20:153-64
Salminen S, von Wright A, Morelli L, Marteau P, Brassart D, de Vos WM, Fonden R, Saxelin M, Collins K, Mogensen G, Birkeland SE, Mattila-Sandholm T. Demonstration of safety of probiotics -- a review. International Journal of Food Microbiology 1998;44:93-106
Sauter SN and Blum JW. Probiotics in veterinary medicine: a review. Schweiz Arch Tierheilk
2003; 145: 507-18
216. Sax H. Erfolgreiche Strategien wider die zunehmende Antibiotikaresistenz. Successful
strategies against increasing antibiotic resistance. Therapeutische Umschau. Revue thera-
peutique 2002;59: 51-5
Schauzu M. Antibiotika-Resistenzgene in transgenen Pflanzen - eine Gefahr fur die Gesund-heit des Verbrauchers? Ernährungs-Umschau 1999;46; 4:126-128
218. Schmidt, Charles W. Antibiotic resistance in livestock: More at stake than steak. Environ-
mental Health Perspectives 2002;110:A396-A402. http://www.ehponline.org
Schouten MA, Voss A, and Hoogkamp-Korstanje JA. VRE and meat. Lancet 1997;349:1258
Schroeder CM, Meng J, Zhao S, Debroy C, Torcolini J, Zhao C, McDermott P, Wagner D,
Walker R, White D. Antimicrobial Resistance of Escherichia coli 026, 0103, 0111, 0128, and 0145 From Animals and Humans. Emerging Infectious Diseases 2002;8:1409-14
Schulz S, Kunz C. Probiotics, Prebiotics, Colonic Food. Definition and Potential Applications.
Monatsschrift Kinderheilkunde 2002;150:808-12
Schuman J, Zottola E, Harlander S. Preliminary characterization of a food-borne multiple-anti-biotic-resistant Salmonella typhimurium strain. Applied & Environmental Microbiology 1989;55:2344-8
Schuster A and Daschner F. Antibacterial products in the home: chance or hazard? [German]. Deutsche Medizinische Wochenschrift 2002;127:2340-4
Schwarz S, Celle and Werckenthin C.The risks of antibiotic use in veterinary medicine and agricultural animal production. Risiken des Antibiotika-Einsatzes in Veterinaermedizin und
landwirtschaftlicher Tierproduktion. Chemotherapie Journal 2001(a);10:6 197-202
Schwarz S, Kehrenberg C, and Walsh TR. Use of antimicrobial agents in veterinary medicine and food animal production. International Journal of Antimicrobial Agents 2001(b);17: 431-7
226. Schwarz S and Chaslus-Dancla E. Use of antimicrobials in veterinary medicine and
mechanisms of resistance. Vet Res 2001; 32: 201-25
227. Sefton AM. Mechanisms of antimicrobial resistance: their clinical relevance in the new
millennium. Drugs 2002; 62:557-66
228. Seyfarth AM, Wegener HC, and Frimodtmoller N. Antimicrobial resistance in salmonella
enterica subsp. Enterica serovar typhimurium from humans and production animals. Journal of Antimicrobial Chemotherapy 1997;40:67-75
229. Shoemaker NB, Wang GR, Salyers AA. Evidence for natural transfer of a tetracycline
resistance gene between bacteria from the human colon and bacteria from the bovine rumen. Applied and Environmental Microbiology 1992; 58: 1313-1320
230. Shryock TR. Relationship between usage of antibiotics in food-producing animals and the
appearance of antibiotic resistant bacteria. International Journal of Antimicrobial Agents 1999;12:275-8
231. Sidhu MS, Heir E, Sorum H, and Holck A. Linkage between penicillin and benzalkonium
chloride resistance in staphylococci from clinical and food environments. Abstracts of the Interscience Conference on Antimicrobial Agents and Chemotherapy 2000;40:131
Simonsen GS, Haaheim H, Dahl KH, Kruse H, Lovseth A, Olsvik O, Sundsfjord A. Trans-
mission of VanA-type vancomycin-resistant enterococci and vanA resistance elements bet-ween chicken and humans at avoparcin-exposed farms. Microbial Drug Resistance 1998;4:313-8
Singer R. Antibiotic resistance – the interplay between antibiotic use in animals and human beings. Lancet Infectious Deseases 2003;3:47-51
Sixl W, Wisidagama E, Sixl-Voigt B, Stunzner D, Kock M, and Withalm H. Bacteriological investigations and resistance patterns in beef and goat's meat in Colombo's slaughter-house.
Geographia Medica 1989;Supplement 3:73-6
Smith DL, Johnson JA, Harris AD, Furuno JP, Perencevich EN, Morris JG. Assessing Risks for a Pre-Emergent Pathogen: Virginiamycin Use and the Emergence of Streptogramin
Resistance in Enterococcus Faecium. Lancet Infectious Diseases 2003;3:241-9
236. Smith JT, Lewin CS. Mechanisms of antimicrobial resistance and implications for epide-
miology. Veterinary Microbiology 1993;35:233-42
Smith KE, Besser JM, Hedberg CW, Leano FT, Bender JB, Wicklund JH, Johnson BP, Moore KA, and Osterholm MT. Quinolone-resistant campylobacter jejuni infections in minnesota, 1992-1998. New England Journal of Medicine 1999;340:1525-1532
238. Soltani M, Beighton D, Philpott-Howard J, Woodford N. Mechanisms of resistance to
quinupristin-dalfopristin among isolates of Enterococcus faecium from animals, raw meat, and hospital patients in Western Europe. Antimicrobial Agents & Chemotherapy 2000; 44:433-6
Soltani M, Philpott-Howard J, Beighton D, and Woodford N. Two distinct mechanisms confer
resistance to quinupristin/dalfopristin (Q/D) in satA-negative Enterococcus faecium (Ef) from animals, raw meat, and hospital patients in the EU. Abstracts of the Interscience Conference on Antimicrobial Agents & Chemotherapy 1999;39:103
240. Sorum H, Sunde M. Resistance to antibiotics in the normal flora of animals. Veterinary
Research 2001;32:227-41
Sorum H, and L'Abee-Lund TM. Antibiotic resistance in food-related bacteria--a result of inter-
fering with the global web of bacterial genetics. International Journal of Food Microbiology 2002;78:43-56
Stein HH. Experience of feeding pigs without antibiotics: A European perspective. Animal Bio-technology 2002;13:85-95 (http:/www.dekker.com/servlet/product/productid/ABIO)
Stobberingh EE and van den Bogaard AE. Spread of antibiotic resistance from food animals to man. Acta Veterinaria Scandinavica 2000; Supplementum(93):47-52
Stroh K. Antibiotika und Antibiotika-Resistenzen in Lebensmitteln und Umwelt. Fachinforma-
tion "Umwelt und Gesundheit" 2002 (http://www.bayern.de/lfu/umwberat/antibiot.htm)
Sundin GW, and Bender CL. Dissemination of the Stra-Strb Streptomycin-resistance genes among commensal and pathogenic bacteria from humans, animals, and plants. Molecular Ecology 1996;5:133-143
Swann Committee: Report of joint committee on the use of antibiotics in animal husbandry and veterinary medicine. Her Majesty's Stationery Office, London, September 1969
Swartz MN. Human diseases caused by foodborne pathogens of animal origin. Clinical Infec-
tious Diseases. 2002;34 Suppl 3:S111-22
Taljanski-Zygmunt W, Grzesiuk E, Zabielski R, and Pierzynowski SG. Is the use of antimicro-bial drugs in agriculture risky for human health? Journal of Animal & Feed Sciences
1998;7(Suppl 1):289-295
249. Tassios PT, Markogiannakis A, Vatopoulos AC, Katsanikou E, Velonakis EN, Kourea-
Kremastinou J, Legakis NJ. Molecular epidemiology of antibiotic resistance of Salmonella enteritidis during a 7-year period in Greece. Journal of Clinical Microbiology 1997;35:1316-21
Tauch A, Krieft S, Kalinowski J, and Puehler A. The 51,409-bp R-plasmid pTP10 from the multiresistant clinical isolate Corynebacterium striatum M82B is composed of DNA segments initially identified in soil bacteria and in plant, animal, and human pathogens. Molecular &
General Genetics 2000;263:1-11
251. Tauxe RV. Emerging foodborne pathogens. International Journal of Food Micro-
biology.2002;78:31-41
Taylor DJ. A realistic assessment of the risks of antimicrobial use in animals and its effects on food safety. Pig Journal 1997;40:46-59
253. Teale CJ. Antimicrobial resistance and the food chain. Symposium Series/The Society for
Applied Microbiology 2002;:85S-89S
Teshager T, Herrero IA, Porrero MC, Garde J, Moreno MA, and Dominguez L. Surveillance of antimicrobial resistance in Escherichia coli strains isolated from pigs at Spanish slaughter-houses. International Journal of Antimicrobial Agents 2000;15:137-42
Teuber M. Antibiotic resistant bacteria in foods. Mitteilungen aus Lebensmitteluntersuchung und Hygiene 2001;92: 10-27
Teuber M, Meile L, Schwarz F. Aquired antibiotic resitance in lactic acid bacteria from food.
Antonie van Leeuwenhoek 1999;76:115-137
Teuber M and Perreten V. Role of milk and meat products as vehicles for antibiotic-resistant bacteria. Acta Veterinaria Scandinavica – 2000;Supplement 93:75-87; discussion 111-7
258. Teuber M. Antibiotika-resistente Bakterien in Lebensmitteln. Umwelt-Medizin-Gesellschaft.
Teuber M. Spread of antibiotic resistance with food-borne pathogens. Cellular & Molecular Life Sciences 1999;56:755-63
260. Threlfall EJ, Ward LR, Frost JA, Willshaw GA. The emergence and spread of antibiotic
resistance in food-borne bacteria. International Journal of Food Microbiology 2000(a);62:1-5
261. Threlfall EJ. Antibiotics and the selection of food-borne pathogens. Society for Applied
Bacteriology Symposium Series 1992;21:96S-102S
Threlfall EJ, Ward LR, Frost JA, and Willshaw GA. Spread of resistance from food animals to man--the UK experience. Acta Veterinaria Scandinavica – 2000(b);Supplement 93:63-8; dis-cussion 68-74
Tollefson L. Antibiotics in food animals. The human health impact and surveillance and control strategies. Journal of the Association of Food and Drug Officials 1999; 63: 33-37
Tollefson L, Altekruse SF, Potter ME. Therapeutic antibiotics in animal feeds and antibiotic
resistance. Revue Scientifique et Technique 1997;16:709-15
Tollefson L and Miller MA. Antibiotic use in food animals: controlling the human health impact. Journal of AOAC International. 2000;83:245-54
Tollefson L, Angulo FJ, and Fedorka-Cray PJ. National surveillance for antibiotic resistance in zoonotic enteric pathogens. Veterinary Clinics of North America - Food Animal Practice 1998;14: 141-150
Tollefson L, Fedorka-Cray PJ, and Angulo FJ. Public health aspects of antibiotic resistance
monitoring in the USA. Acta Veterinaria Scandinavica – 1999;Supplement 92:67-75
268. Tollefson L and Flynn WT. Impact of antimicrobial resistance on regulatory policies in
veterinary medicine: status report. AAPS PharmSci 2002; 4: 37
Torriani S, Randazzo CL, Tomarchio VF, Knijff E. Presenza di ceppi di Enterococcus faecium vancomicina-resistenti in formaggi italiani. Occurrence of vancomycin-resistant Enterococcus faecium strains in Italian cheeses. Industria del Latte 2001;37:29-40
Tsiodras S, Gold HS, Sakoulas G, Eliopoulos GM, Wennersten C, Venkataraman L, et al. Linezolid resistance in a clinical isolate of Staphylococcus aureus. Lancet 2001; 358:207-8
271. UN AGENCIES: Overuse of Antibiotics in Livestock, Results in Resistant Strains. Public
Health Reports 1998;113:104
272. Vaarkamp H. Maximum residue levels (MRL's) of veterinary medicines in relation to food
safety. MRL's really do matter--the Benzaprocpen case. Tijdschr Diergeneeskd 2002; 127: 2-6
van den Bogaard AE, Hazen M, Hoyer M, Oostenbach P, and Stobberingh EE. Effects of
flavophospholipol on resistance in fecal Escherichia coli and enterococci of fattening pigs. Antimicrobial Agents & Chemotherapy 2002;46:110-118
van den Bogaard AE, Mertens P, London NH, Stobberingh EE. High prevalence of coloni-
zation with vancomycin- and pristinamycin-resistant enterococci in healthy humans and pigs in The Netherlands: is the addition of antibiotics to animal feeds to blame? Journal of Antimicro-bial Chemotherapy 1997;40:454-6
van den Bogaard AE, Stobberingh EE. Antibiotic resistance epidemiology: Links between anti-
biotic use in food animals and resistance in human bacteria. Mitteilungen aus Lebensmittel-untersuchung und Hygiene 2001;92:42-58
van den Bogaard AE, Stobberingh EE. Epidemiology of resistance to antibiotics. Links bet-
ween animals and humans. International Journal of Antimicrobial Agents 2000;14:327-35
van den Bogaard AE. A veterinary antibiotic policy: a personal view on the perspectives in The Netherlands. Veterinary Microbiology 1993;35:303-12
van den Bogaard AE and Stobberingh EE. Antibiotic usage in animals - impact on bacterial
resistance and public health. Drugs 1999;58:589-607
van den Braak N, van Belkum A, van Keulen M, Vliegenthart J, Verbrugh HA, Endtz HP. Molecular characterization of vancomycin-resistant enterococci from hospitalized patients and
poultry products in The Netherlands. Journal of Clinical Microbiology 1998;36:1927-32
Vose D, Acar J, Anthony F, Franklin A, Gupta R, Nicholls T, Tamura Y, Thompson S, Threlfall EJ, Vuuren Mvan, White DG, Wegener HC, Costarrica ML. Antimicrobial resistance: risk ana-
lysis methodology for the potential impact on public health of antimicrobial resistant bacteria of animal origin. Revue Scientifique et Technique Office International des Epizooties 2001;20: 811-827
Wagner J, Hahn H. Zunahme bakteriel er Resistenz in der Humanmedizin durch Resistenz-
gene von Bakterien fleischliefernder Tiere. Berliner und Munchener Tierarztliche Wochen-schrift 1999;112:380-384
Wallinga D. Antimicrobial use in animal feed, an ecological and public health problem. Minne-
sota Medicine 2002;85:12-6
283. Wallmann J, Schroter K, Wieler LH, Kroker R. National antibiotic resistance monitoring in
veterinary pathogens from sick food-producing animals: the German programme and results from the 2001 pilot study. Int J Antimicrob Agents 2003; 22: 420-8
Walsh D, Duffy G, Sheridan JJ, Blair IS, McDowell DA. Antibiotic resistance among Listeria, including Listeria monocytogenes, in retail foods. Journal of Applied Microbiology 2001;90:517-22
Wegener HC. The consequences for food safety of the use of fluoroquinolones in food ani-
mals.[comment]. New England Journal of Medicine 1999;340:1581-2
Wegener HC, Aarestrup FM, Gerner-Smidt P, and Bager F. Transfer of antibiotic resistant bacteria from animals to man Acta Veterinaria Scandinavica – 1999;Supplement 92:51-7
Wegener HC, Aarestrup FM, Jensen LB, Hammerum AM, and Bager F. Use of antimicrobial growth promoters in food animals and Enterococcus faecium resistance to therapeutic anti-microbial drugs in Europe. Emerging Infectious Diseases 1999;5:329-35
288. Werber D; Bergann T. Modelluntersuchungen zum impedimetrischen Antiinfektivanachweis
unter besonderer Berucksichtigung der Milch. Model experiments on the impedimetric detection of antibiotics with special regard to milk. Archiv fur Lebensmittelhygiene 1998;49; 6:133-138
Werner G, Klare I, Heier H, Hinz KH, Bohme G, Wendt M, Witte W. Quinupristin/dalfopristin-resistant enterococci of the satA (vatD) and satG (vatE) genotypes from different ecological origins in Germany. Microbial Drug Resistance 2000;6:37-47
Werner G, Klare I, Witte W. Arrangement of the vanA gene cluster in enterococci of different ecological origin. FEMS Microbiology Letters 1997;155:55-61
Werner G, Hildebrandt B, Klare I, and Witte W. Linkage of determinants for streptogramin A, macrolide-lincosamide-streptogramin B, and chloramphenicol resistance on a conjugative
plasmid in Enterococcus faecium and dissemination of this cluster among streptogramin-resistant enterococci. Ijmm International Journal of Medical Microbiology 2000;290:543-548
Wheelock V. Antibiotic resistance and food safety: Lessons from Denmark. International Food
Ingredients 2000;2: 41-44
293. White DG. The food safety perspective of antibiotic resistance. Animal Biotechnology
White DG, Zhao S, Simjee S, Wagner DD, and McDermott PF. Antimicrobial resistance of foodborne pathogens. Microbes & Infection 2002;4:405-12
295. Whiteley RK, Pajkos A, and Vickery K. Biofilms that impact on human health. Journal of
Pharmacy Practice & Research 2002;32:153-158
WHO. Evaluation of certain food additives and contaminants. World Health Organ Tech Rep Ser. 2002;909:i-x, 1-171
Winckler C, Grafe A. Charakterisierung und von Abfällen aus der Massentierhaltung unter Be-
rücksichtigung verschiedener Böden. Umweltbundesamt 2001; Forschungsbericht 297 33 911 UBA-FB 000074 (http://www.scientificjournals.com/sj/ehs/Pdf/aId/3751)
Winokur PL, Brueggemann A, DeSalvo DL, Hoffmann L, Apley MD, Uhlenhopp EK, Pfaller MA, and Doern GV. Animal and human multidrug-resistant, cephalosporin-resistant Salmo-nella isolates expressing a plasmid-mediated CMY-2 AmpC beta-lactamase. Antimicrobial
Agents & Chemotherapy 2000;44:2777-2783
Wise R and Soulsby EJ. Antibiotic resistance--an evolving problem. Vet Rec 2002; 151:371-2
Wissing A, Nicolet J, Boerlin P. The current antimicrobial resistance situation in Swiss veteri-nary medicine. Schweiz Arch Tierheilkd 2001; 143: 503-10
301. Witte W, Klare I, Werner G. Selective pressure by antibiotics as feed additives. Infection
1999(a);27 Suppl 2:S35-8
302. Witte W. Ecological impact of antibiotic use in animals on different complex microflora:
environment. International Journal of Antimicrobial Agents 2000(a);14:321-5
Witte W. Selective pressure by antibiotic use in livestock. International Journal of Antimicrobial Agents 2000(b);16 Suppl 1:S19-24
Witte W, Klare I, and Werner G. The use of antibiotics as growth promoters in animal hus-bandry and antibiotic resistance in bacterial pathogens of humans. Fleischwirtschaft 1999(b);79:90-94
Witte W, Klare I, and Werner G. Molecular ecological studies on spread of antibiotic resistance
genes. Animal Biotechnology 2002;13:57-70 http:/www.dekker.com/servlet/product/productid/ABIO
306. Witte W, Klare I, and Werner G. Transfer of antibiotic resistance genes in Enterococcus
faecium of animal and human origin and the significance of meat products. Mitteilungen aus Lebensmitteluntersuchung und Hygiene 2001;92:28-41
Woodford N. Glycopeptide-resistant enterococci: a decade of experience. Journal of Medical Microbiology 1998;47:849-862
Wu TL, Su LH, Chia JH, Kao TM, Chiu CH, Kuo AJ, Sun CF. Molecular Epidemiology of Nalidixic Acid-Resistant Campylobacter Isolates From Humans and Poultry by Pulsed-Field Gel Electrophoresis and Flagellin Gene Analysis. Epidemiology and Infection 2002;129:227-
Wuschko S, Kunter U, Schwabe KH, Kalvelage H. Erythromycin im Euter - Ergebnisse einer Studie zur biologischen Verfübarkeit. Praktische Tierarzt 1998;79;12:1157-1159
A1. Zugelassene Antibiotika/Antimykotika in der Landwirtschaft und Lebens-
mittelproduktion [Quelle: BfR 2004]
Substanz Antibiotika-Substanzgruppe
1 AMOXICILLIN-TRIHYDRAT
3 COLISTINSULFAT
Polypeptid-Antibiotikum
4 LINCOMYCINHYDROCHLORID-MONOHYDRAT Lincosamid 5 AMPICILLIN-TRIHYDRAT
6 GENTAMICINSULFAT
7 NEOMYCINSULFAT
BENZYLPENICILLIN - PROCAIN 1 H2O
9 CLOXACILLIN-BENZATHIN
10 CLOXACILLIN-NATRIUM
11 SULFADIMIDIN-NATRIUM
14 TIAMULINFUMARAT
15 CHLORTETRACYCLINHYDROCHLORID
16 OXYTETRACYCLIN-DIHYDRAT
17 TETRACYCLINHYDROCHLORID
18 TYLOSIN[(R,R)-TARTRAT]
19 SPECTINOMYCINSULFAT
20 SULFADIMETHOXIN
21 OXYTETRACYCLINHYDROCHLORID
23 TILMICOSINPHOSPHAT
25 VALNEMULINHYDROCHLORID
26 SULFADIAZIN-NATRIUM
27 AMPICILLIN-NATRIUM
28 APRAMYCINSULPAT
29 BENZYLPENICILLIN-KALIUM
30 DANOFLOXACINMESILAT
32 KALIUMCLAVULANAT
34 DIFLOXACINHYDROCHLORID
35 MARBOFLOXACIN
36 SPECTINOMYCINDIHYDROCHLORID 5 H2O
37 SULFACLOZIN-NATRIUM 1 H2O
38 SULFAQUINOXALIN-NATRIUM
41 TYLOSINPHOSPHAT
42 CEFACETRIL-NATRIUM
43 CEFALEXIN-MONOHYDRAT
44 CEFAPIRIN-BENZATHIN
46 CEFQUINOMSULFAT
47 CEFTIOFUR-NATRIUM
48 DIHYDROSTREPTOMYCINSULFAT (2:3)
49 ERYTHROMYCINTHIOCYANAT
51 OXACILLIN-NATRIUM 1 H2O
52 SULFAMETHOXYPYRIDAZIN
54 AMOXICILLIN-NATRIUM Betalaktam 55 BENZYLPENICILLIN-NATRIUM
56 CEFOPERAZON 2 H2O
57 CEFTIOFURHYDROCHLORID
58 CHLORTETRACYCLIN
59 DICLOXACILLIN-NATRIUM
60 DOXYCYCLINHYCLAT
62 KANAMYCINSULFAT
63 NAFCILLIN-NATRIUM
65 OXACILLIN-NATRIUM
66 PIRLIMYCINHYDROCHLORID 1 H2O
67 SULFACLOZIN-NATRIUM
69 SULFATHIAZOL-NATRIUM
A2. Datenbankbeschreibungen
BIOSIS Previews
BA70, BA83, BA90, BA93
Inhalt: Biologie,
BA70: 8.123.668 Dokumente
BA83: 4.771.053 Dokumente
BA90: 1.615.286 Dokumente
BA93: 5.507.655 Dokumente
Update: Wöchentlich
Typ: Literaturdatenbank
Sprache: Englisch
Hersteller: BIOSIS
BIOSIS Previews enthält Nachweise der internationalen Literatur aus den Bereichen der
Biologie (Zoologie, Botanik, Mikrobiologie), Human- und Veterinärmedizin, Verhaltens-
forschung, Biochemie, Biophysik und Umweltschutz. Quellen sind ca. 4.400 internationale
Zeitschriften, Bücher, Konferenzbeiträge, technische Berichte, Nomenklaturen und Patente
aus USA (bis Ende 1989). Suchbar sind bibliographische Angaben, Deskriptoren und
Abstracts (ca. 50 %).
Schlüssel: ET80
Inhalt: Biotechnologie
Umfang: 1.605.593
Update: Wöchentlich
Typ: Literaturdatenbank
Englisch; Originaltitel suchbar
Hersteller: Elsevier
BIOTECHNOBASE ist eine Literaturdatenbank in englischer Sprache auf dem Gebiet der
Biotechnologie. Besondere Schwerpunkte sind Entwicklung von Arzneimitteln, Gesundheits-
pflege, mikrobielle Biotechnologie, Landwirtschaft, Nahrungsmittelproduktion und Umwelt-
schutz. Die Datenbank enthält Angaben aus über 70 Ländern. Quellen sind ca. 280 inter-
nationale Zeitschriften, Konferenzberichte und Monographien. Suchbar sind bibliographische
Angaben, Deskriptoren und Abstracts (ca. 80 %).
CAB Abstracts
Inhalt: Landwirtschaft,
Veterinärmedizin, Humanmedizin
Umfang 4.286.085
Update: Monatlich
Typ: Literaturdatenbank
Englisch; Originaltitel suchbar
CAB Abstracts enthält Nachweise der internationalen Literatur aus dem Gesamtbereich der
Agrarwissenschaften einschließlich Tiermedizin, Biotechnologie, Ernährungs- und Forst-
wissenschaft, Lebensmittelkunde, Humanmedizin und alle verwandten Gebiete. Quellen sind
ca. 14.000 internationale Zeitschriften, Bücher, Konferenzbeiträge, Patente, insbesondere
aus Europa und aus den Entwicklungsländern. Suchbar sind bibliographische Angaben,
Institutsadressen, Deskriptoren und Abstracts (85 %)
Elsevier BIOBASE
Schlüssel: EB94
Inhalt: Biologie,
Biowissenschaften
Umfang: 2.093.627
Update: Wöchentlich
Typ: Literaturdatenbank
Sprache: Englisch
Hersteller: Elsevier
Elsevier BIOBASE entspricht dem gedruckten Current Awareness in Biological Sciences
(CABS). Quellen sind ca. 1.700 internationale Zeitschriften. Suchbar sind bibliographische
Angaben, Deskriptoren und Abstracts (ca. 70 %).Angewandte Mikrobiologie und Biotech-
nologie, Krebsforschung, Zell- und Entwicklungsbiologie, Klinische Chemie, Umweltwissen-
schaften, Endokrinologie und Metabolismus, Genetik und Molekularbiologie, Immunologie
und Infektionskrankheiten, Neurowissenschaften, Botanik, Biochemie der Proteine, Toxi-
Angewandte Mikrobiologie und Biotechnologie, Krebsforschung, Zell- und Entwicklungs-
biologie, Klinische Chemie, Umweltwissenschaften, Endokrinologie und Metabolismus,
Genetik und Molekularbiologie, Immunologie und Infektionskrankheiten, Neurowissen-
schaften, Botanik, Biochemie der Proteine, Toxikologie.
EM74, EM83, EM90
Medizin und Randgebiete
EM74: 9.193.021 Dokumente
EM83: 6.903.182 Dokumente
EM90: 5.085.219 Dokumente
Update: Wöchentlich
Typ: Literaturdatenbank
Englisch; Originaltitel suchbar
Hersteller: Elsevier
Excerpta Medica Database (EMBASE) enthält Nachweise der internationalen Literatur auf
dem Gesamtgebiet der Humanmedizin einschließlich der biologischen Grundlagenwissen-
schaften. Einen besonderen Schwerpunkt bilden Arzneimittel und Wirkstoffe (Pharmakologie,
Wirkungen, Nebenwirkungen), Gesundheitsökonomie und Krankenhauswesen, Umwelt-
medizin und Umweltschutz, forensische Wissenschaften und Drogenprobleme. Die Daten-
bank enthält alle Dokumente der Excerpta Medica Referatezeitschriften sowie zusätzliche
Literatur. Quellen sind ca. 4.100 internationale Zeitschriften. Suchbar sind bibliographische
Angaben, Deskriptoren und Abstracts (ca. 80 %).
Schlüssel: FS69
Inhalt: Lebensmittelwissenschaften
Update: Wöchentlich
Typ: Literaturdatenbank
Englisch; Originaltitel suchbar
International Food Information Service
Food Science and Technology Abstracts (FSTA) enthalten Nachweise der internationalen
Literatur zu allen Bereichen der Lebensmittelwissenschaften einschließlich Hygiene,
Toxikologie, Warenkunde, rechtliche Aspekte und Grundlagenforschung. Quellen sind ca.
1.800 Zeitschriften, Bücher, Patente, Dissertationen, Gesetze und Verordnungen. Suchbar
sind bibliographische Angaben, Institutsadressen, Herstellernamen, Patente und Abstracts
Schlüssel: KL97
Naturwissenschaften, Medizin, Geisteswissenschaften, Mathematik,
Informatik, Rechtswissenschaften
Update: Mehrmals
Typ: Literaturdatenbank
Sprache: Englisch
Kluwer Academic Publishers
Die Kluwer-Verlagsdatenbank ist eine Literaturdatenbank, deren Dokumente mit den zu-
gehörigen Volltexten verknüpft sind. Die Literaturdatenbank umfasst neben den biblio-
graphischen Angaben Stichworte und häufig einen englischen Abstract. Die Volltexte werden
in der Originalsprache als pdf-Dateien ausgegeben. Eine weitere Besonderheit stellt die Ver-
knüpfung der Kluwer-Volltexte mit entsprechenden Publikationshinweisen aus anderen
Literaturdatenbanken wie Medline oder Embase dar. Die Quellen sind über 600 Zeitschriften
des Kluwer-Verlages.Das DIMDI bietet die Kluwer-Verlagsdatenbank in Kooperation mit der
Deutschen Zentralbibliothek für Medizin (ZBMed) an.
MEDLINE, PreMedline
ME00, ME66, ME83, ME90, ME95
Medizin und Randgebiete
ME00: 1.305.783 Dokumente ME66: 11.857.101 Dokumente ME83: 7 753 824 Dokumente ME90: 5.415.442 Dokumente ME95: 3.453.103 Dokumente
täglich (außer Nov. u. Dez.)
Typ: Literaturdatenbank
Englisch; Originaltitel suchbar
US National Library of Medicine (NLM)
MEDLINE enthält Nachweise der internationalen Literatur aus allen Bereichen der Bio-
medizin, einschließlich der Zahn- und Veterinärmedizin, Psychologie und des öffentlichen
Gesundheitswesens. Die Datenbank entspricht dem gedruckten Index Medicus und einigen
anderen gedruckten Bibliographien. Quellen sind ca. 4.500 internationale Zeitschriften.
Suchbar sind bibliographische Angaben, Deskriptoren (Englisch, Deutsch, Französisch) und
Abstracts (76 %).
Schlüssel: SM78
Inhalt: Sozialmedizin
öffentliches Gesundheitswesen
Wird nicht aktualisiert
Typ: Literaturdatenbank
Deutsch, Englisch; Originaltitel suchbar
Landesinstitut für den öffentlichen Gesundheitsdienst des Landes Nord-
rhein-Westfalen (lögd)
SOMED (Sozialmedizin) enthält Nachweise der internationalen Literatur auf den Gebieten
Arbeitsmedizin, industrielle Toxikologie, öffentliches Gesundheitswesen, Gesundheits-
erziehung, Suchtkrankheiten, Rehabilitation, Epidemiologie und Medizinalstatistik, Umwelt-
hygiene, Umweltmedizin und Umwelttoxikologie. Quellen sind ca. 700 internationale
Zeitschriften, Bücher, deutsche Dissertationen und graue Literatur. Suchbar sind biblio-
graphische Angaben, Deskriptoren und Abstracts (ca. 70 %). Ca. 85 % der nachgewie-senen
Literatur ist über den idis-Literaturschnell-dienst verfügbar.
SP97, Preprint: SPPP
Medizin; Naturwissenschaften; Mathematik; Informatik; Ingenieur-
wissenschaften; Psychologie, Wirtschafts- und Rechtswissen-
Update: Mehrmals
Typ: Literaturdatenbank
Hauptsächlich Englisch (ca. 15% der Dokumente sind mit deutschem
Vokabular recherchierbar)
Springer Verlag GmbH & Co. KG
Die Springer-Verlagsdatenbank ist eine Literaturdatenbank, deren Dokumente mit den zu-
gehörigen Volltexten verknüpft sind. Sie beinhaltet neben den bibliographischen Angaben
Schlagworte und häufig englische und/oder originalsprachliche Abstracts. Die Volltexte
werden in der Originalsprache als pdf-Dateien ausgegeben.
Eine Besonderheit stellt die Verknüpfung der Springer-Volltexte mit entsprechenden Publika-
tionshinweisen aus anderen Literaturdatenbanken wie Medline oder Embase dar. Quellen
sind ca. 200 internationale Fachzeitschriften des Springer-Verlages.
Das DIMDI bietet die Springer-Verlagsdatenbank in Kooperation mit der Deutschen Zentral-
bibliothek für Medizin (ZBMed) an.
Schlüssel: TV01
Medizin und Randgebiete
Update: Mehrmals
Typ: Literaturdatenbank
Sprache: Englisch
Hersteller: Thieme
Die Thieme-Verlagsdatenbank ist eine Literaturdatenbank, deren Dokumente mit den zuge-
hörigen Volltexten verknüpft sind. Die Datenbank enthält Dokumente aus derzeit ca. 80 me-
dizinischen und wissenschaftlichen Zeitschriften des Thieme-Verlages seit 2002. Sie be-
inhaltet die bibliographischen Angaben und englische Abstracts (ca. 80 % der Dokumente).
Die Volltexte werden in der Originalsprache (englisch, deutsch, französisch) im pdf-Format
ausgegeben. Eine weitere Besonderheit stellt die Verknüpfung der Volltexte mit ent-
sprechenden Publikationshinweisen aus anderen Literaturdatenbanken wie Medline oder
Das DIMDI bietet die Thieme-Verlagsdatenbank in Kooperation mit der Deutschen Zentral-
bibliothek für Medizin (ZBMed) an.
Inhalt: Toxikologie,
3 Mio. Dokumente
Die Toxline Datenbank ist die bibliographische Datenbank für Toxikologie der National
Library of Medicin (NLM). Die Datensätze enthalten bibliographische Informationen zu bio-
chemischen, pharmakologischen, physiologischen und toxikologischen Auswirkungen von
Medikamenten und anderen Chemikalien.
Über ReDI Freiburg:
Current Contents - Agriculture, Biology & Environmental Sciences (OVID) (nur 1994-
Zitiertitel: CC - Agriculture, Biology & Environmental Sciences
Berichtszeit: 1994 - 1999
Aktualisierung: Wöchentlich (Inhalte fast identisch mit Web of Science)
Informationsanbieter: Institute for Scientific Information (ISI)
Infotyp: Bibliographische Datenbank
Inhaltsbeschreibung: Current Contents - Agriculture, Biology & Environmental Sciences speichert, Überwiegend mit kurzen Zusammenfassungen, Hinweise auf Veröffentlichungen in ca. 940 internationalen Fachzeitschriften aus den Bereichen Agrarwissenschaften, Bio-logie und Umweltwissenschaften. Zu den inhaltlichen Schwerpunkten der ausgewerteten Quellen gehören u.a.: Agronomie, angewandte Mikrobiologie, Biotechnologie, Bodenkunde, Botanik, Fischereiwissenschaften, Forstwissenschaften, Meeresbiologie, Lebensmittel-chemie und -technik, Nutztierforschung, Ökologie, Ornithologie, Ozeanologie, Veterinär-medizin und -pathologie, Zoologie. Der wöchentlich aktualisierte Informationsdienst, der auch in gedruckter Form und online verfügbar ist, kann auch in Kombination mit weiteren Teil-beständen der Current Contents-Reihe bezogen werden.
Sachgebiete: Biologie; Land- und Forstwirtschaft; Umweltschutz, Landschaftsgestaltung und
Science Citation Index / Web of Science
Berichtszeit: 1991 – 1996 (Science Citation Index CD-ROM, ab 1997 Web of Science
Aktualisierung: Wöchentlich
Informationsanbieter: Institute for Scientific Information (ISI)
Bibliographische Datenbank
Inhaltsbeschreibung: SCISEARCH enthält Nachweise der weltweit veröffentlichten Literatur
aus allen Bereichen der reinen und angewandten Naturwissenschaften, Technik und
Medizin. Die Datenbank entspricht dem "Science Citation Index". Quellen sind ca. 5.900 in-
ternationale Zeitschriften. Suchbar sind bibliographische Angaben, Referenzen, Deskriptoren
und Abstracts (ab 1991, ca. 65 %).
Chemie; Geowissenschaften; Biologie; Medizin und Pharmazie; Technik allgemein
Die komplette Datenbank Journals@Ovid mit den Volltexten mehrerer hundert Zeitschriften
verschiedener Verlage (alphabetische Liste). Ein Einschränkung des Suchergebnisses auf
die für die Uni Freiburg lizensierten Volltexte in Journals@Ovid ist mit dem Limit "Ovid Full
Text Available" möglich. Bei den nicht lizensierten Zeitschriften sind nur die biblio-
graphischen Angaben, im allgemeinen inklusive Abstracts und References, zugänglich.
Zitiertitel: GEOBASE
Berichtszeit: 1980 ff
Aktualisierung: Vierteljährlich
Informationsanbieter: SilverPlatter Information Inc.
Infotyp: Bibliographische Datenbank
Links: Kurzanleitung zu GEOBASE
Inhaltsbeschreibung: GEOBASE dokumentiert mit Kurzzusammenfassungen weltweit er-scheinende Veröffentlichungen in allen Sprachen zu den Fachdisziplinen Physische Geo-graphie, Kulturgeographie, Geowissenschaften, Ökologie, Umweltwissenschaften, Ozeano-graphie und Entwicklungsländer / Dritte Welt. Der Datenbestand entspricht den Geographical Abstracts, Geological Abstracts, Ecological Abstracts, International Development Abstracts, Geomechanics Abstracts und der Oceanographic Literature Review. Ausgewertet werden mehr als 3000 Zeitschriften und über 2000 weitere Quellen wie Kon-ferenzbände, Forschungsberichte, Serien, aber auch Monographien und Kartenwerke. Die Datenbank enthält über 770.000 Dokumente mit jährlichem Zuwachs von etwa 50.000 Literaturnachweisen. Zu den inhaltlichen Schwerpunkten von GEOBASE gehören u.a. Geologie, Mineralogie, Umweltgeologie, Geomechanik, Geomorphologie, Bodenkunde, Hydrologie, Ozeanographie,
Meteorologie, Klimatologie, GIS, Remote Sensing, Kartographie, Ökologie, Umwelt-verschmutzung, Land- und Forstwirtschaft, Industrie-, Bevölkerungs- und Stadtgeographie, Ländliche Entwicklung, Raumordnung, Landschafts- und Umweltplanung, Tourismus, Dritte Welt, Verstädterung, Weltgesundheit und -ernährung, Entwicklungsstudien, Internationale Beziehungen etc. Sachgebiete: Geowissenschaften; Land- und Forstwirtschaft; Umweltschutz, Landschafts-
gestaltung und Raumplanung; Geographie und Länderkunde.
Umwelt-CD
Zitiertitel: UMPLIS
Berichtszeit: 1989 ff (ULIDAT), 1979 ff (UFORDAT)
Aktualisierung: Regelmäßige Aktualisierung
Informationsanbieter: Umweltbundesamt Berlin
Infotyp: Bibliographische Datenbank
Links: Portal zur deutschen Umweltinformation (GEIN)
Inhaltsbeschreibung: Die Umwelt-CD ist eine Fachbibliographie des Umweltbundesamtes. Umfasst im Rahmen des Umweltplanungs- und Umweltinformationssystems (UMPLIS) die Umweltliteraturdatenbank ULIDAT (mehr als 180.000 Hinweise zu allen Sachgebieten des Umweltschutzes) und die Umweltforschungsdatenbank UFORDAT (mehr als 30.000 Hin-weise zur Umweltforschung im deutschsprachigen Raum). Sachgebiete sind Abfall, Boden, Umweltchemikalien (Schadstoffe), Gefahrgut, Umweltaspekte von Land- und Forstwirtschaft, Energie und Rohstoffe, Gentechnik, Luft, Klima, Lärm etc. Sachgebiete:
Chemie; Geowissenschaften; Biologie; Umweltschutz, Landschaftsgestaltung und Raum-
SwetScan
Berichtszeit: 1994 ff.
Aktualisierung: Wöchentlich
Inhaltsbeschreibung: Die Zeitschriftendaten umfassen die Inhaltsverzeichnisse von ca.
14.000 Zeitschriften. Der Inhalt ist international und multidisziplinär, d.h. aus allen Bereichen
der Wissenschaft. Die Daten sind seit 1.1.1994 erfasst. Jeder Jahrgang hat eine eigene
Datenbank, die zusammen ca. 11,1 Mio. Einträge umfassen (Dezember 1998). Über die
Funktion "Standortsuche" können aus der Titelaufnahme des Heftes die besitzenden Biblio-
theken ermittelt werden.
Die Datenbank wird wöchentlich aktualisiert, wodurch der Bestand jeweils um ca. 30.000
Sachgebiete: Naturwissenschaften, Technik und Medizin interdisziplinär; Sozial- und Wirt-
schaftswissenschaften interdiziplinär; Geisteswissenschaften interdisziplinär.
Suchstrategien für die verschiedenen Datenbanken
Die linke Spalte gibt die fortlaufende Nummer des Suchschrittes (jeweils eine zusammen-
hängende Anfrage an die Datenbank) an. Als Ergebnis wird in der rechten Spalte angezeigt,
wie viele Artikel von allen in der Datenbank enthaltenen die Anforderung erfüllen. Die ge-
fundenen Ergebnisse lassen sich mit den Booleschen Operatoren „und" („and") bzw. „oder"
(„or") verknüpfen. Als Ergänzung zur Suche mit kontrolliertem Vokabular (z.B MeSH-Thesau-
rus) wird soweit sinnvoll eine Textwortsuche durchgeführt, da trotz fest vorgegebener Regeln
bei der Verschlagwortung nicht durchgängig davon auszugehen ist, dass der zutreffendste
MeSH-Begriff auch tatsächlich verwendet wurde [Greenhalgh 1997]. Z.T. wird eine Trun-
kierung durchgeführt.
Beispiele für Datenbankrecherchen
Ovid Technologies, Inc. Email Service: Medline main database gesucht am 18.3.03
Search for: 18 and 19
Citations: 1-224
Database: MEDLINE <1966 to March Week 1 2003>
Search Strategy: Food2 18-03-03: medline main 18-03-03
exp food industry / (47565)
food chain / (614)
exp Food / (247495)
Eating / (24508)
exp Animal Feed / (41490)
Nutrition / (22766)
Food Microbiology / (12423)
drug residues / (1561)
drug resistance, microbial / or exp drug resistance, bacterial / (64904)
or / 1-8 (309032)
or / 1-7 (308347)
or / 8-9 (66427)
12 and 13 (2512)
limit 15 to human (790)
limit 16 to yr=1990-2003 (545)
limit 17 to (Dutch or English or French or German or Italian or Spanish) (526)
exp Antibiotics / (365067)
from 20 keep 1-224 (224) -Æ nach Elimination doppelter
Ovid Technologies, Inc. Email Service ------------------------------
Search for: from 21 [limit 18 to (Dutch or English or French or German or Italian or Spanish)]
Database: CC / Agri,Bio,Environ Sci <1993 - 1999>
Search Strategy:
1. Spezifische Suche (stärker eingeschränkt mit food adj3 produc$ adj3 animal$)
antibiotic$.mp. [mp=abstract, title, author keywords, keywords plus] (4349)
anti biotic$.mp. [mp=abstract, title, author keywords, keywords plus] (2)
3 antimicrob$.mp.
anti microb$.mp. [mp=abstract, title, author keywords, keywords plus] (67)
resist$.mp. [mp=abstract, title, author keywords, keywords plus] (33279)
food$.mp. [mp=abstract, title, author keywords, keywords plus] (40371)
residu$.mp. [mp=abstract, title, author keywords, keywords plus] (19987)
(meat$ or poultr$ or egg$ or cheese or honey or milk or fish$).mp. [mp=abstract, title, author keywords, keywords plus] (77656)
(food$ adj3 produc$ adj3 animal$).mp. [mp=abstract, title, author keywords, keywords plus] (190)
8 or 10 (106766)
13 or 14 or 16 (425)
limit 19 to (Dutch or English or French or german or Italian or Spanish) (364)
limit 18 to (Dutch or English or French or german or Italian or Spanish) (54)
from 21 keep 1-54 (54)
Erweiterte Datenbankrecherche
Das Suchergebnis erwies sich nach Durchsicht der gefundenen Arbeiten als zu wenig aus-
sagekräftig; deshalb wurde eine detailliertere Suchstrategie entwickelt (hier für die Daten-
bank MEDLINE dargestellt).
MEDLINE-Suche <1966 to April Week 3 2003>
exp food industry /
exp Animal Feed /
Food Microbiology /
(food$ adj2 produc$ adj2 animal$).mp.
10 drug resistance, microbial / or exp drug resistance, bacterial /
12 exp antibiotics /
14 exp case-control studies /
15 exp Cohort studies /
16 Cross-sectional studies /
19 exp epidemiologic factors /
25 (causation$ or causal$).tw.
27 (etiol$ or aetiol$).tw.
28 (et or ep or ge or pc or ae or po or to or ci).fs.
30 (clinical trial or controlled clinical trial or meta analysis or multicenter study or 378172
randomized controlled trial).pt.
31 exp clinical trials /
32 Comparative Study /
34 exp Evaluation Studies /
36 Evidence-Based Medicine /
39 (human or humans or man).mp.
41 limit 40 to yr=1990-2003
42 limit 41 to (Dutch or English or French or german or Italian or Spanish)
46 European Union /
48 (euro$ or eu).tw.
(austria or belgium or denmark or eng or england or federal republic of ger-
many or finland or fraance or france or germany or germany east or germany
49 federal republic of or germany west or great britain or greece or ireland or itaiy 5115408
or italy or luxembourg or netherlands or norway or poland or portugal or scot-
land or spain or sweden or switzerland or swtizerland or west germany).cp.
54 (comment or editorial or letter).pt.
64 from 62 keep 1-32
65 from 63 keep 1-94
Durchsuchte Datenbanken: Food, antibiotics, Doublettencheck
Datenbank
Zeitraum, Gesucht
Anzahl Zitate
Dublettencheck mit
Datenbanken
1966-January 11.2.03
283 (von 285: 2
(Ovid Online Server
Word-Datei: Strategie
medline main daily
Medline Daily Update 7.2.03 11.2.03
(Ovid Online Server
Word-Datei: Strategie
medline main daily
(nach Löschen von
3 Premedline
(Ovid Online Server
via ReDI) Word-Datei: Strategie medline main daily
4-6: Neue Medline Strategie. Weitere Begriffe für Food, Bacteria und Bacterial infections weg-gelassen.
4 Medline
<(1966) Limit: 18.3.03 218
(Ovid Online Server
(von 224: 6 doppelte
andere Strategie:
Word-Datei: medline
Medline Daily Update 17.3.03 18.3.03 1
(Ovid Online Server
andere Strategie:
Word-Datei: medline
6 Premedline
18.3.03 (41), davon 1 völlig
(Ovid Online Server
irrelevant (Gabe von
Word-Datei: Strategie
premedline 18-03-03
Food):
40
Current Contents via 1993-1999 18.3.03 Spez.
Sens : 306
Agri,Bio,Environ Sci
Strategie Word Datei:
strategie CC doc
345
davon 52 spez
293 sens (zu viel)
8 Medline
1966 to March 21.3.03 76, nach Abzug v. 2 nach Abgleich
(Ovid Online Server
mit 1-6 und 7 (spez)
Medline Daily Update March 19,
(Procite File medline 21-
erweiterte Strategie:
Word-Datei: strategie medline erweitert 21-
03-03 (ohne Eingrenzung auf human, dafür Studien-
design, Publication
9 Swetscan
10 Medline
1966 to March 21.3.03 10, nach Abzug v. 1 nach Abgleich
(Ovid Online Server
mit 1-6 und 7 (spez) und
Medline Daily Update March 20,
(Procite File medline
food6 risk rest 21-03-03)
erweiterte Strategie:
Word-Datei: strategie
medline food6 risk
main und daily 21-03-
11 Medline
1966 to March 25.3.03
(Ovid Online Server
mit 1-6, 7 (spez), 8 und
Medline Daily Update March 24,
(Procite File medline
food4 bacter rest main
und daily 25-03-03)
erweiterte Strategie:
Word-Datei: strategie
medline food4 bacter
main und daily 25-03-
12 Current Contents via 1993-1999
mit 1-6, 7 (spez), 8 und
Agri,Bio,Environ Sci
10-11 und Löschen von
Strategie Word Datei:
eindeutig irrelevanten
strategie CC 26-03-
180
(Procite File CC rest 23-
13 BIOSIS Previews via
<1990 to 2003 27.3.03 132
mit 1-6, 7 (spez), 8 und
Strategie Word Datei:
10-12 und Löschen von
strategie Biosis 27-03-
eindeutig irrelevanten
verbleiben
104
(Procite File Biosis rest
Web of Science
Strategie Word Datei: Week 12
mit Summe aus 1-8 und
Web of Science 31-03-
Science Citation
(106 aus WoS und 17
Strategie Word Datei:
Web of Science 31-03-
(Procite File SCI-WoS
Summe aus 1-8 und 9-
14:
1044 Zitate
Procite File:
Medline CC Biosis SCI
alle bis 31-03-03 step14
15 Geobase
mit Summe aus 1-8 und
102
(Procite File Geobase
Summe aus 1-8 und 9-15:
1146 Zitate
Procite File: Medline CC Biosis SCI Geobase alle bis 01-04-03 step15
Davon:
Review im Titel: 124 Zitate
Comment im Titel: 41 Zitate
Selektion der 1146 Zitate in Procite mit
"(antibiotic* or anti-biotic*) and resist*" im Titel oder Abstract oder keyword Feld):
664 Zitate Procite File: "antibiotic and resist.pdt"
Davon:
Review im Titel: 82 Zitate
Comment im Titel: 31 Zitate
Restliche Zitate (1146-664) in Procite noch nach ((*cin or antimicrob*) and resist and (EU or europ* or
german*) gesucht (wegen Avoparcin, Vancomycin):
84 Zitate Procite File: "nicht relevant nach selektion anti resist step15.pdt"
664 + 84 Zitate = Procite Datei „rel 84 und 664.pdt": 748 Zitate
Eliminierte Zitate nach Step 15: Rest: 398 Zitate: Procite Datei: „eliminiert nach step15.pdt)
Darin Suche nach antimicrob* im Titel: 66 Zitate. Procite File: „antimicrob im titel von
eliminierten.pdt)
Restliche mit hoher Wahrscheinlichkeit nicht relevante Zitate: 332 Zitate, Procite File: eliminiert nach
step15 ohne antimicrob im titel.pdt
16 Journals@Ovid
1990 – 03. April 03 4.4.03 21
mit 748 Zitaten
10
(Procite File journals
ovid rest step16 04-04-
Summe:
824 Zitate
Procite File
„rel 84 und 664 und 66
Eingrenzung der bisherigen Strategien mit Methodischem Filter: Studiendesign
17 Medline
<1966 to April
28.4.03 30 Reviews
(Ovid Online Server via Week 3 2003>
(Procite Datei: med-
134 Zitate
line spez reviews 28-
Word-Datei: medline
strategie spez 28-04-03
93 Articles
(Procite Datei: me-
(keine relevanten Zitate
dline spez articles 28-
in Premedline und Med-
line Daily Update
11 Articles Consumer
Update Status 28.4.03)
protection (Procite Datei: med-line consumer pro-
tection 29-04-03)
18 Current
Contents
Agri,Bio,
29.4.03 76
Environ Sci
60 Zitate
Clinical
Medicine
1997 -1999
Social & Behav.
Sci
1997 -1999
BIOSIS Previews via
<1990 to 2003 29.4.03 149
Strategie Word Datei:
strategie Biosis 29-04-
115 Zitate
(Procite Datei: biosis 29-04-
Internetadressen, die im Rahmen der manuellen Suche (25.3.03) eingesehen wurden:
Europa http://dg3.eudra.org/F2/register/vreg.htm
Pharmaceuticals in the EU http://dg3.eudra.org/F2/pharmacos/docs/brochure/pharmaeu.pdf
Maximum Residue Limits of veterinary medicinal products in foodstuffs of animal origin http://dg3.eudra.org/F2/mrl/index.htm
(121 Seiten langes Paper der EU Kommission mit großem Literaturanhang)
German Network for Antimicrobial Resistance Surveillance http://www.genars.de/index-d.html
Artikel der Evidenzlevel IV und V
Aarestrup et al. 1998; Aarestrup 1998; Abrahim et al. 1998; Adesiyun et al. 1998; aid 2004;
Allerberger et al 1997; Basilico et al. 2001; Bates et al. 1994; Bonora et al. 2001; Butaye et
al. 2000; Campagnolo et al. 2002; Carramiñana et al. 1997(a); Carramiñana et al. 1997(b);
Chauvin et al. 2002; Conedera et al. 1997; Cordano and Virgilio 1996; Cormican et al. 1997;
Cruchaga et al. 2001; Curtis and Bowler 2001; Daly et al. 2000; Descheemaeker et al. 1999;
Deutz et al. 1998; Donabedian et al. 2003; Endtz et al. 1991; Endtz et al. 1997; Evans and
Wegener 2003; Gambarotto et al. 2001; Garau et al. 1999; Girardeau et al. 2003; Golding et
al. 2001; Hakanen et al. 2003; Hatha and Lakshmanaperumalsamy 1995; Herbers et al.
1992; Heuer et al. 2002; Hollinger et al. 1999; Hoszowski and Wasyl 2001; Kelley et al. 1998;
Khan and Malik 2001; Khan et al. 2002; Klein et al. 1998; Klein 2000; Kümmerer and Hen-
ninger 2003; L'Abée-Lund and Sørum 2001; Lemcke and Bülte 2000; Mammina et al. 2002;
Mårdh et al. 1978; Marre et al. 2002; Mehall et al. 2002; Millar et al. 2001; Mitema et al.
2001; Mølbak et al. 1999; Mølbak et al. 2002; Moore et al. 2001; Murphy et al. 2001;
Nachamkin et al. 2002; Nair et al. 1995; do Nascimento et al. 2001; O'Brien et al. 1993;
Österblad et al. 1999; Parsonnet and Kass 1987; Piddock et al. 2003; Piddock 2002; Piddock
et al. 2000; Pohl et al. 1993; Ruiz et al. 1999; Sáenz et al. 2000; Schroeder et al. 2002;
Schuman et al. 1989; Seyfarth et al. 1997; Shoemaker et al.1992; Sidhu et al. 2000; Sixl et
al. 1989; Smith et al. 1999; Soltani et al. 1999; Soltani et al. 2000; Tassios et al. 1997; Tauch
et al. 2000; Teshager et al. 2000; Torriani et al. 2001; van den Bogaard et al. 2002; van den
Braak et al. 1998; Walsh et al. 2001; Werner et al. 1997; Werner et al. 2000; Winokur et al.
2000; Wu et al. 2002
Aarestrup and Wegener 1999; Aarestrup 1999; Aarestrup 2000; Acar et al. 2000; Ahl and
Buntain 1997; Alderman and Hastings 1998; Altekruse et al. 1997; Altekruse et al. 1999;
Ammon and Bräunig 2003; Anadón and Martínez-Larrañaga 1999; Anderson et al. 2001;
Angulo et al. 2000; Anonym 1997; Bager et al. 2000; Barber 2001; Bartlett 2003; Barton
2000; Barza 2002; Bates 1997; Bellot and Bouvarel 2000; Berche 2000; Berends et al. 2001;
Bergogne-Bérézin 1998; Brandt 1999; Brown 1996; Bywater 1999; Catry et al. 2003; Cohen
2000; Collignon 1999; D'Aoust 1994; Dasen ; Davis et al. 2002; Engberg et al. 2001;
Espinasse 1993; Ferber 2003; Fields et al. 1999; Franklin et al. 2001; Franz et al. 1999;
Goldmann 1999; Goldsmith and Schur 2002; Gorbach 2001; Grave et al. 1999; Greenlees
2003; Greko 1999; Gustafson 1993; Hässig 1999; Hamer et al. 2002; Hammes 1998; Heinzl
1997; Hattan and Kahl 2002; Helmuth 1999; Hilbert et al. 2001; Hildebrandt 2002; Honikel
2002; Honkanen-Buzalski and Suhren 1999; Johnston 2001; Kamphues 1998; Kietzmann
2001; Kim and Thayer 1996; King and Khabbaz 2003; Kist 2002; Klein 1999; Kleter and
Kuiper 2002; Kommission der Europäischen Gemeinschaften 2001; Kondo and Johansen
2002; Kümmerer 2003; Kümmerer and Daschner 2003; Lack 2002; Lathers 2001; Lathers
2002(a); Lathers 2002(b); Laval 2000; Martel et al. 2001; Mayr 2001; McConnell 1996;
McDermott et al. 2002; McDonald et al 1997; Mitchell and Yee 1995; Nap et al. 1992; Nolen
1999; Novick 1981; Pantosti et al. 1999; Pedersen et al. 1999; Perreten et al. 1997; Phillips
1999; Quirk 2001; Rabsch et al. 2001; Rerat 1991; Richard 1998; Riley and Wertz 2002;
Robert Koch Institut (RKI) 2003; Roosen 1999; Salisbury et al. 2002; Salminen et al. 1998;
Sax 2002; Schauzu 1999; Schmidt 2002; Schouten et al. 1997; Schulz and Kunz 2002;
Schuster and Daschner 2002; Schwarz et al. 2001(a); Schwarz et al 2001(b); Sefton 2002;
Shryock 1999; Singer 2003; Smith et al. 2003; Smith 1993; Sørum and Sunde 2001; Sørum
and L'Abée-Lund 2002; Stein 2002; Stobberingh and van den Bogaard 2000; Stroh 2002;
Sundin and Bender 1996; Swartz 2002; Taljański-Zygmunt et al. 1998; Tauxe 2002; Taylor
1997; Teale 2002; Teuber 2000; Teuber 2001; Teuber 2002; Teuber et al. 1999; Teuber
1999; Threfall et al. 2000(a); Threfall et al. 2000(b); Threfall 1992; Tollefson 1999;Tollefson
et al. 1997; Tollefson et al. 1999; Tollefson and Miller 2000; Tollefson et al. 1998; UN
Agencies (Anonym) 1998; van den Bogaard and Stobberingh 2000; van den Bogaard and
Stobberingh 2001; van den Bogaard 1993; van den Bogaard et al. 1997; van den Bogaard
and Stobberingh 1999; Vose et al. 2001; Wagner and Hahn 1999; Wallinga 2002; Wegener
1999; Wegener et al. 1999; Wegener et al. 1999; Werber and Bergmann 1998; Werner et al.
2000; Wheelock 2000; White 2002; White et al. 2002; Whiteley et al. 2002; WHO 2002; Witte
2000(a); Witte 2000(b); Witte et al. 1999(a); Witte et al. 1999(b); Witte et al. 2002; Witte et al.
2001; Woodford 1998
A6. Abkürzungsverzeichnis
AVO Avoparcin C.
Campylobacter
(Konfidenzintervall)
European Federation of Animal Health
Gelelektrophorese
VRE Vancomycin-resistente
VREF Vancomycin-resistente
Enterococcus faecium
relative risk (Relatives Risiko)
Escherichia coli
EF Enterococcus
Source: http://www.ernaehrungswende.de/pdf/MB4_Antibiotika_final.pdf
Psychiatry and Clinical Neurosciences 2013; 67: 345–351 Excessive dosing and polypharmacy of antipsychotics causedby pro re nata in agitated patients with schizophrenia Junichi Fujita, MD,1,3* Atsushi Nishida, PhD,1,2 Mutsumi Sakata, BS,4 Toshie Noda, MD1 andHiroto Ito, PhD11Department of Social Psychiatry, National Institute of Mental Health, National Center of Neurology and Psychiatry,2Tokyo Institute of Psychiatry, Tokyo, 3Department of Child and Adolescent Psychiatry, Kanagawa Children's MedicalCenter, Kanagawa and 4Sasaguri Hospital, Fukuoka, Japan
Primatology, Wildlife Ecology & Conservation Field School in Kenya Locations: Laikipia Plateau and Tana River Primate National Reserve, August 1-28, 2010; Rutgers University Study Abroad Program, National Museums of Kenya and Kenya Wildlife Service Rutgers University and National Museums of Kenya Primate and Wildlife Ecology Fieldschool 2010


