Levitra enthält Vardenafil, das eine kürzere Wirkdauer als Tadalafil hat, dafür aber schnell einsetzt. Männer, die diskret bestellen möchten, suchen häufig nach levitra kaufen ohne rezept. Dabei spielt die rechtliche Lage in der Schweiz eine wichtige Rolle.
Salud reproductiva.qxd
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 281
"El pudor es una virtud relativa, según se tengan veinte,
treinta o cuarenta y cinco años"
Honoré de Balzac
JUAN JOSÉ ESPINÓS GÓMEZ
Los estados hiperandrogénicos están
constituidos por una serie de cuadros clínicos queen su conjunto se caracterizan por presentar unaoferta androgénica superior a los órganos diana.
Oferta androgénica superior
Ello implica que podemos encontrarnos ante una
en órganos diana
síntesis y/o secreción excesiva desde las glándulasesteroidogénicas hacia el torrente circulatorio, conanomalías en el transporte de los andrógenos y/ofinalmente con un aprovechamiento periféricosuperior. Clásicamente, el hirsutismo periférico oidiopático no ha sido considerado estrictamentecomo un estado hiperandrogénico, sin embargo suclínica puede ser similar a la que presentan loshiperandrogenismos y además en estos casosexiste una regulación metabólica periféricaanómala.
Los andrógenos son esteroides de 19 carbonos
con capacidad de unión al receptor androgénico.
Están producidos en las células estromales delovario, en la capa reticular de la glándulasuprarrenal y a partir de la conversión de otrosprecursores circulantes en el compartimentoperiférico (piel, grasa, hígado, etc.). La testosterona(T) es el principal andrógeno circulante y junto a ladihidrotestosterona (DHT) constituyen los
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 282
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
esteroides androgénicos más potentes. Ladehidroepiandrosterona (DHEA) y laandrostenodiona (³4) no tienen actividadandrogénica por sí mismos debiendo serconvertidos periféricamente para ejercer su acción.
Por último, existen metabolitos androgénicos de la
• 50% conversión periférica
DHT como el androstenodiol o la androsterona queson productos terminales. En una mujer normal se
producen diariamente de 0,2 a 0,3 mg de T
• 25% suprarrenal
procediendo el 50% de la conversión periférica, el25% del ovario y el 25% de la suprarrenal. La ³4procede a partes iguales por ambas glándulasmientras que la DHEA es producidapreferentemente en la glándula adrenal (un 90%).
La T circula unida a la proteína portadora deesteroides (SHBG) a la que se une con una altaafinidad siendo la fracción libre del 1 al 2%. Laproducción y el metabolismo de la SHBG estánregulados por los esteroides y la insulina. Losestrógenos aumentan sus concentraciones mientrasque el hiperandrogenismo y el hiperinsulinismo seacompañan de concentraciones más bajas.
Una forma práctica de clasificar los estados
hiperandrogénicos es dependiendo de su fuente,en ováricos, suprarrenales o periféricos. Sinembargo, no es infrecuente la existencia de formasmixtas en las que un mismo defecto favorece unincremento de la androgénesis ovárica y
suprarrenal. Independientemente de la fuente,otro sistema de clasificación es el que se basa en elgrado de autonomía correspondiendo, las formasfuncionales a aquellos cuadros en los que existeuna dependencia (de las gonadotrofinas en elovario o de la ACTH en la suprarrenal) y lastumorales cuando la hiperproducción no requiereun estímulo específico. La mayoría de los estadoshiperandrogénicos corresponden al síndromedescrito en 1935 por Stein y Leventhal yrebautizado posteriormente como síndrome delos ovarios poliquísticos, que en su forma clásicase caracteriza clínicamente por hirsutismo,anovulación, esterilidad, obesidad y ovarios de
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 283
aspecto poliquístico. En la actualidad sabemos,gracias a la incorporación de nuevos métodos
Distintas etiologías con el
diagnósticos (radioinmunoensayo, pruebas de
estimulación y frenación, ecografía transvaginal dealta definición, biología molecular, etc.), quediferentes cuadros etiológicos pueden manifestarsecon un fenotipo similar por lo que podremosestablecer un diagnóstico diferencial de diferentesentidades. En este capítulo analizaremos la mayoríade los cuadros que cursan con hiperandrogenismoaunque dada su elevada frecuencia así como lasrepercusiones tanto a corto como a largo plazo noscentraremos básicamente en la anovulaciónhiperandrogénica (AH) o hiperandrogenismoovárico funcional (HOF).
CAUSAS DE HIPERANDROGENISMO
Síndrome de ovarios poliquísticos (SOPQ)
Con el paso de los años ha recibido diferentes
denominaciones siendo hoy las más aceptadas laAH o el HOF ya que reflejan de forma más
Es la endocrinopatía más
fidedigna el origen de este complejo problema. El
común en las jóvenes
HOF es la endocrinopatía más común en lapoblación joven y quizás también las másfrecuente en toda la población femenina. Un 1-5%de la población general reúne las característicasclínicas clásicas, aunque así excluimos a laspacientes con ciclos ovulatorios que podríancorresponder a formas leves. Un 20-25% de lasmujeres en edad reproductiva presentan criteriosecográficos de ovario poliquístico (OP), noobstante, sólo un 25% de éstas presentanalteraciones menstruales y menos de un 50%hirsutismo. Esta variabilidad en los porcentajes dela población supuestamente afecta vienecondicionada por las diferencias que existen entrelos diferentes autores para definir que pacientes
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 284
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
tienen una AH. La conferencia de consenso delInstituto Nacional de la Salud americano de 1990establecía como criterios básicos elhiperandrogenismo asociado a la anovulacióncrónica, tras haber sido descartadas otras causas de
anovulación como la hiperprolactinemia o las
enfermedades congénitas enzimáticassuprarrenales. Esta definición que incluye unporcentaje elevado de estas pacientes, no refleja demodo fidedigno el estado actual de la cuestión yaque criterios que son y fueron considerados porotros autores esenciales para el diagnóstico puedenestar presentes solos o asociados sin que exista unperfil característico que permita diferenciar gruposetiopatogénicos. Una de las conclusiones másimportantes que se derivan es que nosencontramos ante una población heterogénea en laque es difícil delimitar grupos específicos y aúnmas complicado homogeneizar criterios clínicos ydiagnósticos como lo demuestra la gran disparidadde resultados que presentan los diferentesestudios. Es por ello por lo que, a riesgo de queparezcan datos inconexos, presentaremos algunosevidencias actuales que reflejan cual es el estadoactual de la AH.
Se desconoce la causa
Se desconoce una causa única y común a todos
los casos de HOF, por lo que se acepta que suorigen es multifactorial. El hiperandrogenismoovárico, común denominador en la mayoría depacientes, está condicionado por factoresgenéticos, disfunciones neuroendrocrinas,anomalías enzimáticas y/o metabólicas ocombinaciones de varias de las anteriores. Elproblema reside en saber si una paciente conalteraciones menstruales, ovario poliquístico perosin hiperandrogenismo es lo mismo que otra conciclos atáxicos, hiperandrogenismo pero ovarioecográficamente normal o que una terceraclínicamente asintomática pero con una imagen
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 285
sonográfica compatible con una poliquistosisovárica y así continuar comparando con lasmúltiples combinaciones posibles. Siconsideramos la respuesta como afirmativaentonces sería fácil suponer que existe un origen
Distintas etiologías con
común y que las condiciones ambientales
modificarían las características fenotípicas de cadacaso. Sin embargo, este extremo no ha podido serdemostrado. Es más lógico pensar que estaspacientes sólo compartirían características clínicassimilares siendo el punto de partida diferente encada caso. De ello se deducen aspectos quedespués comentaremos como la posibilidad de queexistan diferentes factores etiológicos o lanecesidad de dar un enfoque personalizado tantoterapéutico como de pronóstico.
1.
Factores genéticos. La evidencia clínica de
que existía una alta prevalencia familiar llevó a larealización de estudios con el objetivo deestablecer un patrón común de transmisiónhereditaria. Un factor genético de base explicaría
• Asotónico dominante
dos características casi patognomónicas de este
• Distintos genes
síndrome: el inicio precoz de la sintomatología y elcarácter crónico de la enfermedad. Existen almenos cuatro estudios en los que se hadeterminado un tipo de herencia autosómicodominante con una penetrancia superior al 90%,en la que los hombres con calvicie prematura yunas concentraciones más elevadas de andrógenosactuarían como portadores. Sin embargo, tambiénse han publicado otros posibles patrones deherencia. Entre los genes afectos se encuentra elCYP17 que codifica para el citocromo P450c17 delque se han identificado polimorfismos enpacientes con HOF. Recientemente, también se handetectado polimorfismos del gen CYP11A quecodifica para el citocromo P450scc responsable dela esteroidogénesis en sus primeros pasos.
Asimismo, se han comunicado delecciones delbrazo corto del cromosoma X. En los síndromes deinsulinoresistencia (IR) grave se han detectadomutaciones del gen que codifica para el receptor
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 286
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
de la insulina. Se han descrito hasta 39 mutacionescon diferentes patrones de transmisión(dominantes y recesivos). La mayoría de casoscorresponden a cambios simples de un par debases que dan lugar a sustituciones de unaminoácido por otro en la proteína del receptorpara la que codifican. Otras alteraciones tienen unabase epigenética con cambios en la expresión delDNA pero sin modificaciones de su secuencia. Sinembargo, en la mayoría de los casos en los queexiste una IR, ésta se atribuye a defectospostreceptor sin que hasta la fecha se hayanpodido demostrar alteraciones del gen que codificapara el dominio de la tirosin-cinasa ni que existauna base genética para los problemas defosforilación. Otro de los genes estudiados es elresponsable de la producción de insulina ya queen los casos de HOF se ha apreciado anomalías en
Alteración en la glándula
la primera fase de su secreción. En particular el
VNTR (insulin gene variable number tandemrepeat) del cromosoma 11p15,5. Los resultadosdemuestran una asociación entre los alelos declase III de este gen y el SOPQ.
2.
Adrenarquia exagerada. En la "hipótesis de
la adrenarquia" el hiperandrogenismo ovárico seorigina a partir de un desarrollo anómalo de laglándula suprarrenal. Un defecto enzimáticoprimario o estímulos desconocidos no ACTH-dependientes inducirían una hiperplasia de la
zona reticular. Esta alteración adrenal en la fase
precoz de la maduración sexual o "adrenarquiaexcesiva" se acompaña de un hiperandrogenismoque conduciría a cambios neuroendocrinos y aalteraciones de la homeostasis ovárica.
3.
Alteraciones hipotálamo-hipofisarias. Una
tercera escuela es la "top-down" que defiende quelas alteraciones neuroendocrinas, secundarias aanomalías en los núcleos centrales y en elhipotálamo, constituyen el defecto primario. Se hadescrito que una exposición precoz (peripuberal)del eje central a los andrógenos podría cambiar su
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 287
patrón de secreción en sentido masculino. Otrashipótesis destacan los defectos congénitos de la
Alteraciones en la teca a
dopamina, la disminución del tono opiáceo central
o los déficits de un factor atenuante del pico de LHque se produce por los folículos de pequeño ymediano tamaño.
4.
Teoría de la disregulación enzimática. El
hiperandrogenismo parece ser la consecuencia deuna disregulación en la producción de andrógenospor las células de la teca. Estas células respondenmediante la producción de esteroides ante elestímulo de dosis bajas de LH. Sin embargo,cuando sus concentraciones superan los rangosfisiológicos no se obtiene un incremento paralelode andrógenos debido a la desensibilización que laLH ejerce sobre sí misma. Las pruebas deestimulación ovárica indican que el ovario deestas pacientes escapa a la regulación negativaobteniéndose un patrón característico de secreciónde andrógenos. Barnes y Rosenfield gracias a laadministración única de un análogo de la GnRHobjetivaron una hiperactividad de algunas enzimasde la esteroidogénesis que dependen del citocromoP450α17. Éste regula entre otras la actividad de la17 hidroxilasa y de la 17,20 liasa tanto ováricacomo adrenal. En situación basal existiría unasobreactividad de ambas que escaparía a laregulación negativa de los estrógenos sobre la LH.
El resultado es un aumento de la producción de la17 hidroxiprogesterona y de la androstenodiona.
Tras un estímulo con GnRH esta situación se hacemás evidente, apreciándose una respuesta de la 17OHP a las 24 horas similar a la que presentan loshombres. Paradójicamente el aumento de ³4 no esparalelo al de la 17 OHP. De ello se deduce que la17,20 liasa sí que respondería parcialmente a laregulación negativa tras un estímulo agudo. Estasalteraciones están presentes ya desde la menarquiay se han detectado también en mujeres con ciclos
ovulatorios. Se podría concluir que las alteracionesse derivan de una anomalía en el metabolismocelular, y que por lo tanto, no sería necesario una
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 288
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
hiperplasia o hipertrofia de la teca o unincremento excesivo de LH para que semanifestara el hiperandrogenismo.
5.
Teoría de la insulinoresistencia e
hiperinsulinismo secundario. Un 60-70% de laspacientes con HOF presenta una IR e
hiperinsulinismo (HI) secundario. En un estudio
realizado en nuestro centro se apreció tras tres
determinaciones basales de insulina (I) y glucosa(G) y una sobrecarga oral con 100 g que lasconcentraciones de insulina, el cociente I/G y lasáreas bajo las curvas respectivas eran superiores alas de un grupo control (figura nº 1). La IR esindependiente del grado de obesidad, aunque suseveridad está ligada al sobrepeso. Durante años hasido motivo de discusión qué fenómeno eraprimario, si el hiperandrogenismo o elhiperinsulinismo. Las diferentes líneas deinvestigación que apoyan la hipótesis de que lahiperinsulinemia causa hiperandrogenismo sepueden resumir en tres: en primer lugar la I y/o el
Figura 1. Área bajo la curva de la insulina (I), glucosa (G), cociente I/G 1 en pacientes con
HOF (n = 14) y en un grupo control (n = 9).
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 289
IGF 1 tienen receptores en el ovario y su estímuloinduce una respuesta funcional estimulando lasíntesis y el acumulo de ³4, testosterona ydihidrotestosterona en la teca y la estroma, laactividad del sistema del citocromo P450 o lainducción de losreceptores de LH. En segundo lugar, laadministración aguda de insulina o glucosa a laspacientes afectas de ovario poliquístico induce unincremento en las concentraciones de andrógenos.
Por último, en las mujeres obesas con ovariopoliquístico, la dieta y el ejercicio que consiguenuna pérdida de peso se acompañan de un descenso
Alteraciones en receptor de
en las concentraciones de insulina y
secundariamente de los andrógenos. Losmecanismos por los que el HI puede dar lugar a unHOF son múltiples y van desde la acciónestimuladora directa de la I sobre el ovario alefecto depresor sobre la SHBG, los efectos sobre laesteroidogénesis adrenal y/o a ni elneuroendrocrino central. La disminución en lasensibilidad a la insulina como ya se hacomentado puede estar condicionada por undéficit congénito de receptores de insulina.
También se ha descrito la existencia deautoanticuerpos contra el receptor de la insulinacomo en los casos de la IR tipo B de Khan en laque suelen asociarse otras enfermedadesautoinmunes. En la mayoría de pacientes conHOF e IR no se han apreciado alteraciones en losgenes que codifican para el receptor nodisminuyendo el número y/o la afinidad de losmismos. Recientemente, Adashi y cols. trabajandocon adipocitos abdominales apreciaron que losreceptores eran menos sensibles a la I. Resultadossimilares son los de Dunaif y cols en fibroblastos ymúsculo esquelético. En un 50% de los casos lacapacidad de autofosforilación insulin-dependiente era normal, y en consecuencia, laincorporación de fosfato a la tirosin-cinasa eracomparable a la de un grupo control. Sin embargo,el resto de pacientes presentaba una capacidad de
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 290
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
autofosforilación subóptima a expensas de una
incorporación del fosfato a los residuos de serina,
proceso insulin-independiente. Los residuos de
serina fosforilados inhiben la actividad tirosin-
cinasa, de la cual dependen entre otras, la
movilización del GLUT4 que facilita la entrada de
glucosa en el citoplasma celular. Asimismo, la
fosforilación de residuos regula la actividad de la
17-20 liasa por lo que una etiología única podría
explicar el hiperinsulinismo y el
Figura 2. Fisiopatología del síndrome de ovarios poliquísticos. Círculo vicioso descrito
por Yen.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 291
En el HOF el hipotálamo, la hipófisis, el ovario
• Atresia folicular
y el compartimento periférico modifican su
• Aromatización
respuesta en virtud del estímulo que reciben. Por
lo tanto, se establece una situación que Yen definió
• Aumento de andrógenos
de "circulo vicioso" con potenciales múltiples
• Disminución de SHB6
entradas (figura nº 2). Una vez establecida estasituación, el ciclo se autoperpetúa sin que persistanecesariamente el estímulo inicial. Los órganosinvolucrados mantienen indemne sufuncionalismo y, por lo tanto, no existe un sustratoanatómico específico. Cuando rompemos lasituación de círculo vicioso conseguimos restaurarel ciclo reproductivo. Las alteraciones mássignificativas se producen en el ovario donde escaracterístico un aumento de la concentración deandrógenos. La esteroidogénesis ovárica anómalaprecisa un soporte anatómico y otro funcional: elprimero viene condicionado por la atresia folicularcon predominio de las células teca-intersticialesproductoras de andrógenos sobre las células de lagranulosa que metabolizan los anteriores aestrógenos. Funcionalmente podemos distinguiralteraciones en el estímulo que recibe el ovario yen la respuesta del mismo: respecto al primero, lateca produce andrógenos bajo la acción de la LHque serán metabolizados a estrógenos en lagranulosa, proceso FSH-dependiente. En el HOFexisten dos grupos de pacientes: aquellas en lasque un aumento de la LH ejercería un efectotónico directo sobre la producción de andrógenos.
Un segundo grupo se acompañaría deconcentraciones normales de LH que sin embargogeneran un estímulo anómalo si otros metabolitoscomo la I, el IGF 1, la GH, etc. favorecen laadquisición de receptores para LH o aumentan susensibilidad. A esto se le añade que tambiénpodría existir un déficit relativo de FSH. Larespuesta del ovario a la LH está condicionada porla hiperfunción de la 17 hidroxilasa y la 17,20liasa. Sin embargo, no existiría unhiperandrogenismo si la capacidad de
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 292
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
aromatización fuera normal. En las células de lagranulosa del ovario poliquístico existe unaaromatización insuficiente. El principal factor quela condiciona es el déficit de FSH. También se hanapreciado mutaciones del gen que codifica para laactividad aromatasa del citocromo P450 o inclusofactores inhibidores de la aromatización que seproducen en los folículos atrésicos. El resultadofinal de la interacción de estos fenómenos es elaumento de la concentración de andrógenosintraováricos y un defecto en la producción deestradiol y progesterona. La testosterona es
Hiperestronismo porconversión periférica
secretada a la circulación general y vehiculada porla SHBG hacia los tejidos diana. Las pacientes con
HOF presentan unas concentracionesanormalmente bajas de SHBG. Este hecho se haatribuido clásicamente a la influencia negativa delos andrógenos sobre su producción hepática. Sinembargo, a concentraciones equiparables detestosterona la depresión de la proteína portadoraes muy superior en mujeres obesashiperinsulinémicas que en las pacientes delgadas.
Se ha demostrado que la I y el IGF 1 inhiben lasíntesis y la secreción de la SHBG por lo queconstituye un factor determinante. El resultadofinal es un aumento de la testosterona libre queaccede a los tejidos. Las pacientes obesas tienenuna capacidad aromatizadora periférica tambiénsuperior por el aumento de tejido graso. Al ser la Ty ³4 metabolizadas periféricamente se crea unasituación de hiperestronismo mantenido nocompensado por una adecuada producción deprogesterona. Ha sido motivo de controversia elefecto de los estrógenos (estrona (E1) y estradiol(E2)) sobre el eje hipotálamo-hipofisario. Si bien seaprecia una correlación entre las concentracionesde E1 y los pulsos de LH, la administración oinhibición de E1 no induce cambios en el patrónde secreción de las gonadotrofinas. Tampoco se hapodido concretar el papel de los andrógenos,aunque la mayoría de estudios señalan su escasainfluencia sobre la LH. En definitiva, una
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 293
alteración hipotalámica primaria o un feed backesteroideo anómalo, inducen un aumento de lapulsatilidad del GnRH y/o un sensibilidadhipofisaria superior al estímulo hipotalámico. Ellose refleja en unas concentraciones superiores deLH (aumento de la amplitud y posiblementetambién de la frecuencia de los pulsos) y en unasconcentraciones de FSH normales o disminuidas.
Este patrón de secreción de gonadotrofinas cierra
Hipertecosis: células tecales
el "círculo vicioso" ya que como describimos,
luteinizadas en estroma
induce un estímulo anómalo sobre las estructuras
Es un trastorno no tumoral caracterizado por la
presencia de islotes de células tecales luteinizadasen el estroma ovárico. Se asocia frecuentemente aobesidad, insulinoresistencia y acantosis nigricans.
En la actualidad se piensa que más que unaentidad clínica propia la hipertecosis constituiríauna forma más florida de hiperandrogenismoovárico funcional siendo sus síntomas en muchoscasos indistinguibles de los que se presentan entumoraciones ováricas de andrógenos. De hechoconstituye la única forma funcional clínicamentereconocible durante la menopausia. Se producecomo consecuencia de un proceso dediferenciación de las células intersticiales delovario en células estromales luteinizadas que sonesteroidogénicamente activas. Su etiología no esdel todo conocida aunque la LH por su capacidadde inducir hiperplasia de las células intersticialesy de que éstas adquieran el potencial necesariopara producir esteroides androgénicos podría serla principal responsable. Sin embargo, siexcluimos los casos que se presentan durante lamenopausia, el resto se caracteriza por presentarconcentraciones de LH normales. Por ello se hahipotetizado que podrían existir sustancias que
amplificaran su efecto. De ellas tanto la insulinacomo la IGF I son capaces de inducir luteinización
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 294
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
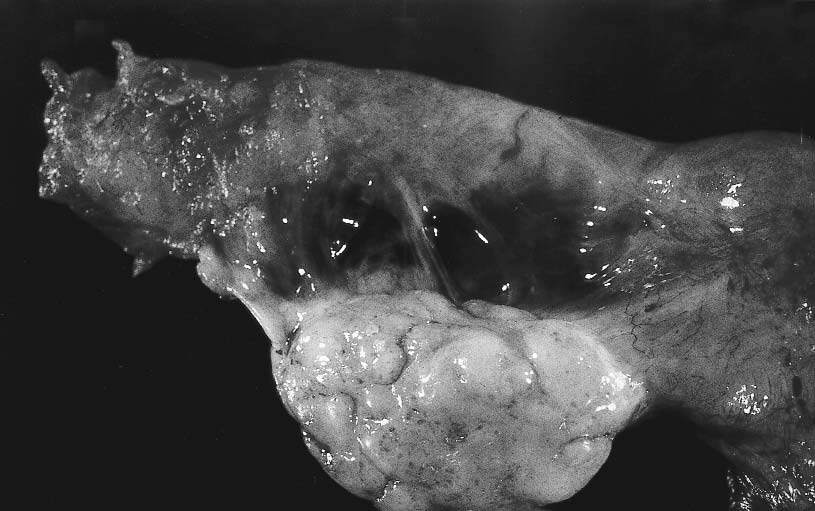
Figura 3. Aspecto macroscópico de la pieza quirúrgica de un ovario correspondiente a
una hipertescosis ovárica.
de las células estromales. De hecho la hipertecosisse asocia frecuentemente a IR e hiperinsulinismosecundario lo cual se traduce clínicamente enuna frecuencia superior de obesidad, diabetes,
hipertensión arterial o acromegalia.
La hipertecosis se caracteriza por la presencia
de unos ovarios de aspecto sólido aumentados detamaño con una cápsula engrosada de coloramarillento (figura nº 3). Microscópicamente seaprecian células luteinizadas (grandes ypoliédricas) en el estroma ovárico que en los casosmoderados se acompañan de múltiples folículosque están ausentes en casos más severos.
Tumores ováricos productores de andrógenos
Los tumores productores de andrógenos son
una entidad más bien infrecuente que dan lugar a
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 295
Tabla 1. Características de algunos tumores producidos por andrógenos
Edad (años) Tamaño (cm) Malignidad
Tumor de células
un hiperandrogenismo marcado, yconsecuentemente, a signos y síntomas devirilización. El origen del hiperandrogenismopuede tener lugar en la misma tumoración ocorresponder a la activación del estromacircundante de tumoraciones no productoras de
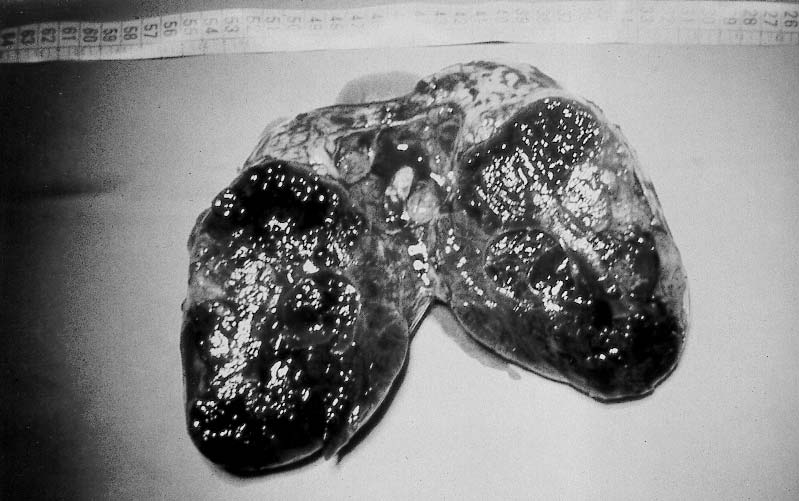
Figura 4. Tumor de Sertoli-Leydig. Aspecto macroscópico.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 296
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
esteroides. La mayoría se suelen presentar enedades avanzadas, sin embargo, su presencia nopuede ser descartada en la adolescencia por lo quea continuación se describen los más importantes(tabla nº 1).
Entre los primeros destacan los tumores de los
cordones sexuales-estroma. De ellos el fibroma-tecoma es el más frecuente aunque sólo un 10%producen andrógenos. Son tumoraciones benignas,unilaterales y que se presentan en edades
No hay una clasificación
avanzadas (media de 59 años). Las células típicas
del tecoma presentan abundantes lípidosintracitoplasmáticos, lo que confiere al tumor uncolor amari-llento característico. Algunos pueden presentarcélulas luteinizadas.
tumores de Sertoli-Leydig
(androblastomas o arrenoblastomas) (figura nº 4)
constituyen el 0,2% de las tumoraciones ováricas
presentándose en pacientes jóvenes (media de 25
años) que se acompañan de manifestaciones
androgénicas en un 25 a un 77% de los casos.
Suelen ser unilaterales, quísticos y/o sólidos y
lobulados variando su diámetro entre 5 y 20 cm.
Las tumoraciones de mayor tamaño corresponden
a aquellas que histológicamente son más
indiferenciadas. No existe un acuerdo unánime
respecto a cómo clasificar los diferentes subtipos,
habiéndose descrito desde las formas muy
diferenciadas hasta aquellas que tienen
componentes heterólogos (músculo esquelético,
cartílago o epitelio gastrointestinal). La mayoría se
suelen diagnosticar en estadio Ia y menos de un
2% se extienden más allá del ovario. La
supervivencia media a los 5 años es de un 66%.
Histológicamente las formas diferenciadas
contienen estructuras tubulares rodeadas de
estroma con células de Leydig que contienen los
típicos cristales intracitoplasmáticos de Reinke.
Las formas indiferenciadas presentan un escaso
desarrollo tubular rodeado de un estroma típico de
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 297
una gónada inmadura.
El ginandroblastoma es un tumor muy raro en
el que se combinan elementos ováricos (células dela granulosa-teca) y testicular (Sertoli-Leydig). Sontumores unilaterales de 2 a 25 cm de diámetro queaparecen en pacientes jóvenes.
Los tumores de los cordones sexuales con
túbulos anulares (SCTAT) están compuestos por
cordones sexuales en círculos concéntricos
rodeando material hialinizado eosinófilo. Un
tercio de estos casos se asocian al síndrome de
Peutz-Jeghers siendo en estos frecuentemente
bilateral y multifocal aunque benigno. Cuando se
presenta aislado es unilateral pero en cambio
puede metastatizar a los linfáticos.
Los tumores de las células esteroideas,
también denominados de células lipoideas, estánconstituidos por células semejantes a lasproductoras de esteroides ya sean luteinizadas, deLeydig o adrenocorticales, constituyendo el 0,1%de todos los tumores ováricos. El luteoma delestroma que se presenta en mujerespostmenopaúsicas (media de 58 años) estáconstituido por células luteinizadas rodeadas deestroma que frecuentemente presenta áreas dehipertecosis. Suele ser pequeño y unilateralacompañándose raramente de hiperandrogenismoque en la mayoría de casos se deriva de la
Tumores no productores
hipertecosis circundante. El tumor de células deLeydig que puede ser de tipo hiliar (80% de loscasos) o no, también se suele presentar en edadavanzada (media de 61 años), unilateralmente, depequeño tamaño y características benignas. En lamayoría de casos producen testosterona dandolugar a cuadros de virilización. Se componen decélulas poligonales con citoplasma eosinofílico yvacuolado en cuyo interior se identifican loscristales de Reinke. Los tumores de célulasesteroides de tipo corticoadrenal son raros y deorigen controvertido (restos de la corteza adrenal
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 298
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
del ovario situados ectópicamente o directamentede las células de Leydig). Al igual que losanteriores suelen ser pequeños, unilaterales ybenignos. Por último, los más frecuentes sonaquellos imposibles de clasificar. Un elevadoporcentaje produce andrógenos (básicamente ³4)siendo tumores de aproximadamente 7 a 10 cm,color anaranjado y en un 6% de los casosbilaterales. Hasta un 25% de los mismos sonmalignos, la mayoría de ellos grandes y conmitosis y zonas de necrosis y hemorragia.
Produce una virilización enel feto hembra
Un segundo grupo está constituido por los
tumores no productores de andrógenos conestroma funcionante. La activación del estromapuede estar producida por la HCG de tumores quecontienen células sincitiotrofoblásticas o duranteel embarazo en pacientes que tenían un tumor deKrukenberg. Para el resto de los casos lahiperproducción androgénica se atribuye a unincremento del volumen estroma estimulado porsustancias HCG-like. Este hecho se ha descrito contumoraciones diversas entre las que se incluyentumores primarios tanto epiteliales (serosos ymucinosos), como teratomas, disgerminomas,quistes benignos y tumores metastásicos.
Hiperandrogenismo y embarazo
Se han descrito entidades que cursan con
hiperandrogenismo durante el embarazo:
• Luteoma. De etiología desconocida aunque
probablemente ligada al estímulo de la HCG,
No produce virilización
cursa en un 10-50% (media del 35%) de loscasos con síntomas de virilización durante lagestación y diferentes grados de masculinizaciónde los fetos hembra en el momento delnacimiento (hasta un 75% de los fetos hembra sila madre tenía síntomas de virilización). Suincidencia es desconocida siendo en muchoscasos un hallazgoaccidental durante el curso de una cesárea. Se
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 299
trata de una lesión pseudotumoral sólida,amarillenta y frecuentemente bilateral hasta enun 50%) de 6 a 10 cm de diámetro. Tanto lasalteraciones ováricas como la clínica dehiperandrogenismo suelen regresarespontáneamente tras el embarazo.
• Quistes teca-luteínico (hiperreactio lutcinalis).
Suelen aparecer en mujeres con antecedentes deanovulación y ovario poliquístico comoconsecuencia de un aumento de la sensibilidaddel ovario a la HCG. Asimismo se asocia aconcentraciones muy elevadas de HCG como lasque acompañan a gestaciones múltiples, hidropsfetalis, molas hidatidiformes o neoplasiastrofoblásticas. Clínicamente se aprecian ovariosaumentados de tamaño (hasta 30 cm dediámetro) con múltiples quistes de líquido claroo hemorrágico. Microscópicamente existe unamarcada luteinización de la teca interna y de lagranulosa. También suelen ser un hallazgoaccidental aunque un 25% de las pacientespresentan síntomas de virilización, pero adiferencia de la entidad anterior no inducenalteraciones fetales lo que probablemente sedebe al efecto protector de la placenta que actúametabolizando los esteroides. También regresade forma espontánea tras la finalización de lagestación.
La glándula suprarrenal, al igual que el ovario,
posee toda la maquinaria suficiente para la síntesisde hormonas esteroideas. Por lo tanto, alteracionesintrínsecas de la esteroidogénesis como unestímulo excesivo de origen externo pueden darlugar a un aumento en la producción deandrógenos. La frecuencia de estos cuadros esclaramente inferior en la mujer si lo comparamoscon los casos en que el hiperandrogenismo tieneun origen ovárico, sin embargo no por ello son
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 300
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Tabla 2. Formas más comunes de hiperplasia suprarenal congénita
en defecto
21 hidroxilasa
11 hidroxilasa
11 dexosicortisol,
DOC: Desoxicortisol, DHEA: Dehidroepiandrosterona, 17 OHP: 17 hidroxiprogesterona, ³4: androstenodiona.
menos importantes ya que en muchos casos esposible una terapia específica. Entre lasalteraciones se pueden destacar:
Hiperplasia suprarrenal congénita (HSC)
Constituyen un conjunto de cuadros, heredados
de forma autosómica recesiva, en los que losenzimas responsables de la metabolización de losdiferentes productos de la cascada esteroideafuncionan de forma anómala. El resultado es unacúmulo de los metabolitos previos al lugar endonde se encuentra el enzima afectado junto a undéficit de productos terminales, lo que se traducees una activación del sistema de retroalimentaciónnegativo entre la suprarrenal y la hipófisis. Elconsiguiente incremento de ACTH conducirá a
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 301
una hiperplasia de la glándula adrenal. Tanto la
Correlación entre defecto
cantidad como el tipo de esteroides acumulados
genético y clínica
así como las deficiencias dependerá de donde seproduce el bloqueo y si este es parcial o total. Entrelos diferentes procesos se pueden destacar (tabla nº2):
Déficit de 21-hidroxilasa
La 21 hidroxilasa media la síntesis de 11
desoxiconisol a partir de la 17 OHP en una vía queconduce a la producción de cortisol y aldosteronacomo productos finales. Constituye el defecto másfrecuente (entre el 90-95% de todos los casos deHSC). La frecuencia depende de la poblaciónestudiada variando de 1/600 a 1/12.000 para laforma clásica o total y de 1/27 a 1/300 para lasformas parciales de HSC. En las mujeres conhiperandrogenismo ésta última es la responsablede un 1-5% de todos los casos.
La 21 hidroxilasa es catalizada por el citocromo
P450c21 que está codificado por el gen CYP21 y elpseudogen CYP21P, cada uno de ellos con 10exones y 9 intrones, localizados cerca de los genesdel complemento C4B y C4A en el brazo corto delcromosoma 6. Ambos genes son homólogos en el98% de las secuencias de nucleótidos de losexones y en un 96% de los intrones. Todas las
• Pérdida de sal
mutaciones descritas son el resultado de
• Virilización
delecciones de CYP21 o de conversiones delmismo como consecuencia de transferencias defragmentos mutados desde el pseudogen. Engeneral existe una correlación entre la severidaddel defecto genético y el de las manifestacionesclínicas, aunque no siempre es posible relacionarun fenotipo con un genotipo determinado.
Formas clínicas
Se han descrito tres formas clínicas siendo las
que cursan con pérdida de sal y la virilizanle las
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 302
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
que presentan características específicas. Laprimera, que corresponde a un 75% de los casos, secaracteriza por una producción inadecuada dealdosterona lo que se traduce en la apariciónprecoz (segunda semana de vida) de crisis de
• Hipertensión arterial
vómitos, decaimiento y falta de incremento
• Retención de líquidos
ponderal. La afectación suele ser mayor en varonesya que la ausencia de genitales ambiguos retarda sudiagnóstico. La alteración hidroelectrolítica secaracteriza por una hiponatremia, hiperpotasemia,disminución de la excreción de sodio y unaumento de la actividad de la renina plasmáticaque si no se corrigen llegan al fallecimiento delneonato. En la forma virilizante hay cierto grado deproducción de cortisol y aldosterona por lo que lasmanifestaciones se limitaran a una masculinizaciónde los genitales externos (clitoromegalia, fusión depliegues labioescrotales y alteraciones deldesarrollo del seno urogenital). La elevadaexposición a los andrógenos confiere un aspectomasculino (incremento de la masa muscular, vellopubiano, etc.) y favorece el cierre precoz de lasepífisis siendo la talla final corta. La pubarquiasuele estar adelantada siendo habitual la calviciefrontotemporal, la voz ronca, la hipoplasiamamaria y el acné severo. En tercer lugar tenemoslas formas parciales o no clásicas de HSC. En estoscasos la actividad enzimática es suficiente paraque la producción de cortisol y aldosterona seencuentren dentro de los límites de la normalidadmientras que el acúmulo de esteroidesandrogénicos (básicamente 17 OHP) se manifiestade forma prácticamente indistinguible a la delHOF.
Déficit de 11ß-hidroxilasa
Constituyen el 5% de los cuadros de HSC. El
gen que codifica la 11 hidroxilasa se encuentra enel cromosoma 8. Su déficit da lugar a un acúmulode 11 desoxicortisol y 11 desoxicorticosteronadando lugar a retención de líquidos e hipertensión
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 303
arterial. Dependiendo de la gravedad y momentoen que se produce el hiperandrogenismo lasmanifestaciones fenotípicas van desde unaambigüedad sexual (clitoromegalia, fusión del
hipospadias, etc.) a unos genitales externosnormales.
Déficit de 3ß hidroxiesteroide deshidrogenasa
Su déficit se comporta una alteración en la
transformación de metabolitos de la vía delta 5(pregnenolona y 17 hidropregnenolona) a la víadelta 4 (progesterona y 17 OHP). Se desconocenlos genes implicados siendo muy raro su déficittotal. La precariedad de cortisol y aldosteronaconlleva una clínica similar a la forma perdedorade sal que acompaña al defecto de la 21hidroxilasa. Al acumularse sólo andrógenosdébiles (DHEA y su forma sulfatada)(SDHA) no seproducen signos de virilización siendo losgenitales externos normales o existiendo sólo unaligera clitoromegalia.
Se han descrito otros defectos entre los que se
incluyen los de la colesterol desmolasa, la 17,20
Hipersensibilidad a
liasa, la 17 hidroxilasa o la corticosteona-metil-
oxidasa de los que sólo existen casosreferenciados.
Tumoraciones suprarrenales productoras
de andrógenos
Los adenomas suprarrenales son tumores
benignos pequeños de menos de 7 cm de diámetromás frecuentes en la mujer y que se diagnosticanen la cuarta década de la vida. Pueden produciruno o más andrógenos adrenales y/o testosterona.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 304
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Los carcinomas adrenocorticales son tumores
de gran tamaño que frecuentemente en elmomento de diagnóstico ya presentan cierto gradode invasividad local. La mitad son funcionantesproduciendo tanto andrógenos comocorticosteroides y/o mineralcorticoides. Puedenmetastatizar a pulmón, hígado, cavidad peritoneal,hueso, etc.
Diagnóstico por exclusión
HIRSUTISMO IDIOPÁTICO O PERIFÉRICO
En la actualidad es motivo de controversia si el
hirsutismo periférico constituye una entidadpropia. En teoría deberían incluirse en este grupoa las pacientes que presentan síntomas dehiperandrogenismo (hirsutismo asociado o no a
Amplio espectro clínico
acné), ciclos menstruales regulares y parámetroshormonales androgénicos (T, ³4, etc.) en el rango dela normalidad. Sin embargo, se ha apreciado quepacientes catalogadas de hirsutismo idiopáticopresentaban concentraciones bajas de SHBG (y enconsecuencia un incremento de la testosteronalibre) y/o incrementos leves de la producciónovárica y/o suprarrenal de andrógenos que no sedetectaban con los métodos convencionales deestudio (determinaciones hormonales basales) o unpatrón ecográfico de ovario poliquístico. Desde unpunto de vista etiopatogénico estas pacientesdeberían presentar un aumento de la sensibilidadperiférica a un estímulo androgénico normal. Lahipersensibilidad vendría condicionada por unaumento de la conversión periférica detestosterona a DHT (principio activo) o por unaumento de la sensibilidad y/o afinidad delreceptor androgénico. No obstante, los diferentesmétodos de estudio que disponemos no hanaportado datos clarificadores al respecto. Noexisten diferencias entre los niveles de DHT entrelas pacientes con o sin hirsutismo. Suponiendoque existiera un aumento del número dereceptores o de la afinidad de éstos a los
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 305
debería existir un aumento paralelo de losmetabolitos de la DHT. En este sentido el 3 alfaandrostenodiol y/o su forma glucuronada podrían
Síntoma casi constante
constituir un buen marcador del metabolismoperiférico. Sin embargo, tanto las pacientes conhiperandrogenismo como aquellas en las que no sedetecta hiperproducción androgénica presentanvalores que se correlacionan con lasconcentraciones de andrógenos plasmáticos. Enconclusión, no existen parámetros objetivos de una"aprovechamiento periférico superior", y en estoscasos el diagnóstico suele realizarse por exclusión.
Las pacientes con hiperandrogenismo
presentan un amplio espectro clínico debido a lagran heterogeneidad etiológica. Los signos ysíntomas están condicionados tanto por el carácter
Alteraciones en la ovulación
y la cantidad de andrógenos secretados como porel momento de la vida en que se inician lostrastornos y la evolución de cada cuadro. Estasdiferencias son tangibles cuando el diagnósticodiferencial se establece entre una forma tumoral(ovárica o suprarrenal) o una funcional (como elHOF o las formas no clásicas de HSC) o cuando elhiperandrogenismo es precoz como en los cuadrosclásicos de HSC o tardío siendo un ejemplo lastumoraciones ováricas que suelen diagnosticarsedurante la menopausia. El mapa se complica sitenemos en cuenta que una misma enfermedadpuede presentarse con una diversidad defenotipos, siendo el HOF el máximo exponente deeste grupo ya que una paciente con alteracionesmenstruales, ovario poliquístico pero sinhiperandrogenismo, otra con ciclos atáxicos,hiperandrogenismo pero ovario ecográficamentenormal o una tercera clínicamente asintomáticapero con una imagen sonográfica compatible conuna poliquistosis ovárica pueden corresponder al
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 306
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
mismo grupo etiopatogénico. A continuación sedescribirán los diferentes síntomas.
No sólo es la anovulación
ALTERACIONES MENSTRUALES
Y DE LA FERTILIDAD
Constituye un síntoma casi constante de los
estados hiperandrogénicos y abarca desde la ataxiamenstrual (oligomenorreas y polimenorreas) hastala amenorrea. En las formas funcionales estánpresentes en un 75-80% de las pacientes siendocaracterístico que las alteraciones menstruales seinicien tras la menarquia. De éstas, un 40-50%cursan con amenorrea y un 25-30% conoligomenorrea. En cambio las pacientes contumores productores de andrógenos se caracterizanpor presentar ciclos menstruales regulares previosy el deterioramiento es progresivo en un cortoespacio de tiempo. Las alteraciones menstrualesson en la mayoría de casos la consecuencia de losciclos anovulatorios y en el resto de insuficienciasdel cuerpo lúteo.
La imposibilidad de gestación esta asociada a
las alteraciones en los procesos normales dedesarrollo folicular, ovulación y formación delcuerpo lúteo. Hull en 1987 apreció que un 73% delas mujeres con infertilidad por anovulacióncorrespondían a pacientes con HOF. Basándonosen criterios ecográficos en una población de 1741mujeres con ovario polifolicular existía un 23% demujeres estériles. En cambio, el análisis de 1.079mujeres con HOF diagnosticadas por biopsia
ovárica reflejó un porcentaje del 74%.
Clásicamente la esterilidad se ha atribuido a laanovulación. No conocemos todos los mecanismosinvolucrados en las alteraciones del desarrollofolicular de estas pacientes. Básicamente el excesode la LH o el incremento de su actividad quecondicionan otros factores metabólicos como lainsulina, la GH y IGF 1 favorecen unahipersecreción ovárica de andrógenos. Ello unido
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 307
a un déficit relativo (disminución de lasensibilidad de la célula de la granulosa) oabsoluto de FSH (niveles circulantes bajos)condiciona una producción subóptima de estradioly una androgenización folicular. La consecuencia
Aumento de pelo terminal
de todos estos fenómenos es que existe undesarrollo folicular deficiente entrando losfolículos en un proceso de atresia. Sin embargo,todos los casos de esterilidad no pueden seratribuidos exclusivamente a la anovulación, ya queel porcentaje de pacientes con HOF que lapresentan no supera el 50%. Se ha demostrado unnexo de unión entre el incremento en lasconcentraciones de LH, una disminución en lastasas de fertilización y/o un incremento de la deabortos. Este efecto parece estar mediado por lainfluencia negativa que unas concentracionesanormalmente elevadas de LH (en general superiora 10 UI/I) en fase folicular temprana y mediaejercen sobre el folículo. Dekel en 1990 demostró
Acantosis nigricans
que la LH en exceso puede inducir una disrupciónde los procesos de intercambio en el espaciointercelular que existe entre las células del cúmuloy el oocito. Como consecuencia se produciría unadisminución del AMPc intrafolicular y deinhibidor de la maduración oocitariareanudándose la meiosis. La maduración precozdel oocito condicionaría un intervalo superiorentre la finalización del proceso de maduración ysu potencial fertilización quedando éstacomprometida, y en caso contrario, favoreciéndosela fecundación poliespermática con elconsiguiente aumento de la tasa de abortos.
Las manifestaciones cutáneas constituyen el
síntoma más característico de los estadoshiperandrogénicos. En los cuadros funcionaleslos síntomas se suelen iniciar de forma precoz trasla menarquia siendo las primeras manifestaciones
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 308
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
el acné y la dermatitis seborreica que se presentanen un 25-30% de los casos y en un 10-20% de losmismos, respectivamente. El acné comomanifestación única y en la etapa peripuberal nosuele ser signo de un hiperandrogenismoespecialmente si su presentación es cíclica conrelación a las menstruaciones. Se produce comoconsecuencia de un estímulo excesivo de lasecreción de la glándula sebácea que se acompañade alteraciones en la composición del sebo yqueratinización anormal. El hirsutismo que afectaa un 60-70% de las pacientes, se caracteriza por unaumento de pelo terminal en las zonas andrógeno-sensibles, preferentemente el labio superior, elmentón y la zona infraumbilical. Otras zonasafectadas son la parte superior e inferior de laespalda, el tórax, el antebrazo y los muslos.
Aparece de forma progresiva y su intensidad estáen relación con el grado del hiperandrogenismo, eltiempo de evolución y la sensibilidad periférica.
También existen factores genéticospredeterminados que condicionan que el númerode folículos pilosos a estimular por unidad desuperficie sea diferente, hecho que es obviocuando comparamos poblaciones como la asiáticay la mediterránea. Por último, la acantosis
Obesidad es un factor de
nigricans (AN) es una alteración dermatológica
caracterizada clínicamente por la presencia delesiones verrugosas, aterciopeladas ehiperpigmentadas localizadas en la nuca, axila,pliegue submamario, y ocasionalmente en otrospliegues de la piel. Su examen anatomopatológicoevidencia una proliferación de los queratinocitosde la epidermis (hiperqueratosis), papilomatosis ehiperpigmentación. Cerca de estas zonas puedenapreciarse otras alteraciones, en especialacrocordomas. Mediante técnicas dehistocitoquímica se ha determinado la existenciaen la dermis papilar, y en las propias lesiones, deun acúmulo de glicosaminoglicanos, en especialde ácido hialurónico. No se conoce la causa de estaalteración. Inicialmente se pensó que esta lesión
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 309
podría tener un origen autoinmune o ser elresultado del exceso de andrógenos que presentan
• Obesidad androide: en la
estas pacientes. Sin embargo, existe una relación
directa entre el grado de hiperinsulinemia y el de
• Obesidad ginecoide: en la
acantosis, lo que implica un posible estímulodirecto de la insulina sobre la epidermis. La AN esun epifenómeno de otras enfermedades benignas ymalignas. Se ha utilizado como un marcador devarios tipos de adenocarcinoma, siendo el deestómago el tumor con el que más frecuentementese asocia. Si la AN se presenta en ausencia deenfermedad maligna, en un 90% de los casosexiste una IR marcada. A la asociación dehiperandrogenismo, AN e IR se le ha denominado"
hairan''. No existen fundamentos sólidos de que setrate de una síndrome con entidad propiacorrespondiendo a formas graves o avanzadas de
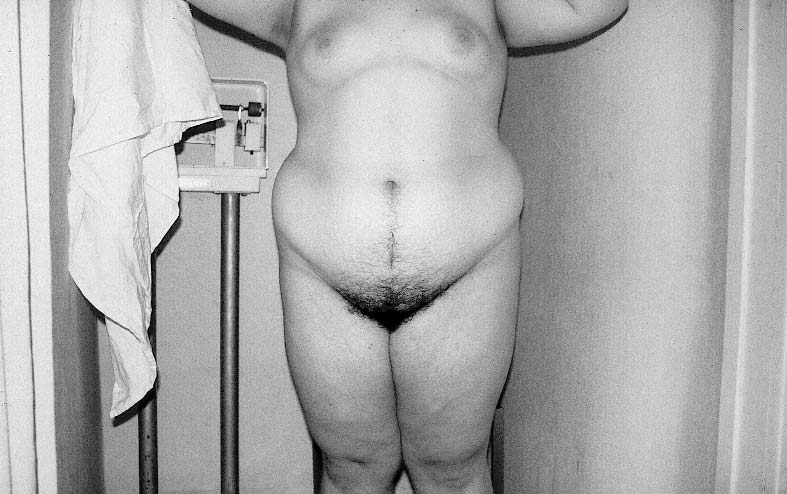
Figura 5. Paciente diagnosticada de HOF en la que se aprecia un hirsutismo moderado
junto a una obesidad de predominio superior o androide.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 310
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
hiperandrogenismo funcional. La mayoría de estoscuadros se acompañan de hipertecosis ováricaaunque también se han descrito asociados a
Riesgo de patología en la
ovarios poliquísticos. En estos casos la clínica de
hiperandrogenismo suele tener un curso tórpido yde larga evolución a semejanza del HOF clásico.
Sin embargo, se producen altas concentraciones deandrógenos que muchas veces están en el rango delas tumoraciones por lo que no es infrecuente queal hirsutismo le acompañen síntomas devirilización.
La obesidad clásicamente formaba parte de los
síntomas signos y síntomas que definían el SOPQ.
Hoy sabemos que sólo se asocia al HOF en un 35 al60% de los casos. El hiperandrogenismo puedealterar el índice de masa corporal (IMC)incrementando la masa muscular o estimulando laingesta de alimentos. Sin embargo, no se hanencontrado diferencias respecto a estos parámetros
Alteraciones en los lípidos
en pacientes obesas y no obesas. También se haninvolucrado alteraciones en el consumoenergético. Independientemente de los aspectospuramente estéticos, la reducción de peso conllevaen un porcentaje elevado de casos la restauraciónde ciclos menstruales normales y unanormalización de los parámetros bioquímicos.
Ambos datos indican que la obesidad podríaconstituir un cofactor a considerar en lafisiopatología del HOF. Cuando ésta es mórbida sesuele asociar a insulinoresistencia ehiperinsulinismo y es característica la presencia deacantosis nigricans. Se han descrito dos tipos deobesidad: la "androide" o de predominio superioren la que el acumulo de tejido graso en la cinturapredomina sobre el de la cadera y la obesidad"ginecoide" o de predominio inferior en la que larelación es inversa (figura nº 5). Recientemente seha apreciado una relación directa entre la IR y el
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 311
grado de hiperinsulismo y la presencia de unaobesidad androide. También se ha demostrado suasociación a otras alteraciones entre las quedestacan las enfermedades cardiovasculares, los
Activación de la coagulación
accidentes cerebrovasculares, la diabetes o elcáncer.
COMPLICACIONES A LARGO PLAZO
Las características fenotípicas de algunas
pacientes, entre las que cabe destacar como ya seha comentado la obesidad de predominio superior,así como las alteraciones bioquímicas(básicamente el hiperinsulinismo y elhiperandrogenismo) que se asocian con el HOF
dan lugar a toda una serie de alteracionesmetabólicas que aumenta el riesgo de diferentespatologías a partir de la cuarta o quinta década dela vida.
Entre los cambios en el metabolismo cabe
destacar los detectados en el perfil lipídicoderivados de una disminución de la actividadlipolítica, alteraciones en la actividad de lalipoproteinlipasa hepática y de las proteínasresponsables de la transferencia de los ésteres delcolesterol. Ello se traduce en un incremento de lasconcentraciones de VLDL, IDL, LDL y triglicéridosy un descenso de las HDL. Cuando predomina la
Mayor riesgo de HTA
grasa a nivel abdominal, sus adipocitos poseencaracterísticas diferenciales de los que seencuentran en los tejidos periféricos. Su volumenes mayor y presenta una tasa de lipolisis elevada.
Esta alta sensibilidad al estímulo lipolíticoprobablemente consecuencia de la altaconcentración de receptores beta-adrenérgicos.
Los andrógenos aumentan el número de receptoresbeta del tejido adiposo. El resultado neto es unaalta concentración de los ácidos grasos libres en lacirculación portal que accederán al hígado.
Estudios recientes sugieren que la acción de lainsulina en los hepatocitos es sensible a los ácidos
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 312
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
grasos libres. Producen una inhibición de lacapacidad de unión de la insulina, consecuenciade una disminución en el número de receptores
Siete veces más riesgo de
y/o de una alteración de la capacidad funcional del
complejo insulina-receptor. Los ácidos grasostambién estimulan la gluconeogénesis mediante laactivación de los enzimas específicos y favorecenla síntesis de VLDL, con aumento de la LDL y de laapoB.
También son destacables las alteraciones que se
producen sobre el sistema de la homeostasis. Elhiperandrogenismo favorece un aumento de laactivación plaquetar. A su vez la IR se acompañade un incremento de la capacidad de adhesión delas plaquetas, favorece la expresión deglicoproteínas de superficie que se unen alfibrinógeno y aumentan la producción detromboxano. En conjunto hay una activación de lacascada de la coagulación lo que se traduce en unaumento del fibrinopéptido A y de los complejostrombina-antitrombina que a su vez activan alfactor X y el PAI 1 que disminuyen la capacidad defibrinolisis.
En su conjunto, todas las alteraciones
metabólicas pueden traducirse a largo plazo en unincremento del riesgo relativo de diferentesenfermedades:
Intolerancia a los carbohidratos y diabetes del
adulto. La primera alcanza una prevalencia en las
Ambiente hormonal
pacientes con HOF de un 30-40% y la diabetes se
presenta hasta en un 15% de la población afecta,porcentaje muy superior al 2-3% del grupocontrol. Además es característico que en estoscasos el cuadro debute a edades más tempranas(entre los 30 y 40 años).
Hipertensión arterial. No existen datos que
demuestren diferencias significativas entre las
cifras tensionales de pacientes con HOF respecto a
los grupos control en edades jóvenes aunque si que
se aprecian tendencias hacia unas tensiones
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 313
superiores. En cambio, en edades avanzadas si quese ha demostrado un riesgo de hasta 3 veces más
Aumenta riesgo de Ca. de
alto, constituyendo las alteraciones del ciclo
(intervalo superior a 40 días) un factor predictivodel riesgo de hipertensión arterial. Entre losfactores implicados se encuentran el aumento de laactividad simpática consecuencia delhiperinsulismo, la liberación adrenal decatecolaminas y glucocorticoides y factoreshemodinámicos como el incremento del volumencardíaco, la vasoconstricción vascular periférica oel aumento de la reabsorción renal de sodio.
Enfermedad cardiovascular. Se ha descrito un
incremento de riesgo de infarto agudo de
miocardio (IAM) de entre 4 y 11 veces superior en
pacientes con HOF. Dahlgren usando un modelo
predictivo sobre la base de los factores de riesgo de
enfermedad cardiovascular, atribuyó a esta
población una probabilidad 7 veces superior de
IAM. Asimismo en estudios relativamente cortos
se ha apreciado una incidencia superior de
arteriosclerosis. No obstante, Pierpont no apreció
diferencias significativas respecto a la mortalidad
por enfermedad cardiovascular hecho que atribuyó
al efecto beneficioso que podría tener el
hiperestronismo relativo en estas pacientes. La
predisposición a una enfermedad cardiovascular
probablemente está condicionada por los factores
de riesgo asociados entre los que destaca la
obesidad, la hiperlipemia, la hipertensión arterial
o la diabetes.
Complicaciones durante la gestación.
Diferentes estudios han demostrado un aumentode la incidencia de diabetes gestacional y estadoshipertensivos del embarazo (EHE). Los resultados
Individualizar cada caso
difieren situándose la incidencia de la primeraentre un 16 y un 38% de las mujeres conantecedentes de HOF respecto a un 25% de lapoblación normal, datos que sitúan el RR en 4,6.
Los datos respecto a los EHE son menosconcluyentes aunque los resultados disponibles
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 314
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
también demuestran una incidencia superior. Enambos casos la obesidad parece ser un factorindependiente del incremento del riesgo.
Como ya se ha comentado los estados
hiperandrogénicos se acompañan de un ambientehormonal anómalo. De todas las causas deanovulación es la única que se acompaña de unestrogenismo basal mantenido a expensas de unincremento de la metabolización periférica deandrógenos a estrógenos. Ello se traduce en laexistencia de un hiperestronismo mantenido sincontraprestación gestagénica por ausencia deactividad luteínica. Como consecuencia se hademostrado un aumento de la incidencia decuadros de hiperplasia endometrial y cáncer deendometrio especialmente en mujeres jóvenes. Seha cifrado la prevalencia de neoplasia endometrialen mujeres con HOF en un 1% y el riesgo relativo
Tabla 3. Características de la anamnesis de pacientes que consultan por signos
o síntomas de hiperandrogenismo
Inicio y evolución
Si está presente la pubertad y la evolución ha sido lenta o en cambio es de aparición tardía
y rápida evolución.
Otros síntomas acompañantes
Acné, piel grasa, alteraciones menstruales, aumento del tamaño clitorideo, cambios de
volumen de la voz o en el hábito corporal, caída del cabello (especialmente parietal y
occipital), aumento de la líbido.
Otros síntomas acompañantes sugestivos de una endocrinopatía
Acromegalia, hipotiroidismo, etc.
Factores que pudieran modificar la evolución del observador
• Si realiza algún método de depilación o cosmético. Frecuencia con la que se aplica
estos métodos.
• La edad. El ciclo de crecimiento del pelo cambia con la edad en zonas del cuerpo como
la cara, los dedos o el cuero cabelludo.
• La época del año. Durante el verano el ritmo de crecimiento es superior al invierno.
• La toma de medicamentos, ya sea antiandrógenos o drogas que puedan inducir un
crecimiento superior como los corticosteroides, los andrógenos sintéticos, la fenitoína,los anticonvulsivantes o el minoxidil.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 315
de 3. Más controvertida es la relación entre HOF ycáncer de mama. Los datos de que disponemospresenta resultados contrapuestos y van desde unincremento de riesgo en mujerespostmenopaúsicas de 3,6 hasta una disminuciónde la OR (0,47; IC:0,26-0,85) pasando por laausencia de interferencia entre ambos procesos.
Medición del pelo
Este término define la presencia de signos
cutáneos de hiperandrogenismo severo a los que seañaden otros síntomas entre los que destacan unaumento del tamaño del clítoris, un incremento dela masa muscular de aspecto masculino, unagravamiento de la voz, el aumento de la líbido, lahipotrofia mamaria y/o la caída de pelopreferentemente en la región frontotemporal. Engeneral reflejan una exposición a hormonas conactividad androgénica, en especial a latestosterona, y suelen acompañar a lastumoraciones productoras de andrógenos y a loscuadros de hiperplasia suprarrenal congénita ensus formas completas.
El diagnóstico de los estados hiperandrogénicos
requiere un enfoque global de cada paciente del
que forman parte los datos de la anamnesis y laexploración física, las determinacioneshormonales incluyendo las pruebas dinámicas, ypor último, las exploraciones radiológicas.
Asimismo es necesario individualizar cada casoadaptándose las diferentes pruebas a lascaracterísticas clínicas y al contexto de cadapaciente. A continuación se expondrá la mayoríade estas pruebas para posteriormente realizar unenfoque racionalizado de las mismas.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 316
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
La consulta por hirsutismo es consecuencia de
la percepción corporal subjetiva de la paciente. Enestos casos debe tenerse en cuenta cual es elámbito cultural y social que la rodea. Situacionescomo la dificultad en encontrar pareja, la reacciónde su pareja tras un primer contacto íntimo, laposibilidad de hirsutismo en su descendencia o lasimple migración a otra población decaracterísticas étnicas diferentes son factores quepueden obligar a una mujer a buscar consejomédico. Tras esta valoración previa, elinterrogatorio debe encaminarse hacia los posiblesfactores etiológicos que figuran en la tabla nº 3.
La evaluación del crecimiento piloso se puede
realizar por métodos cuantitativos o
Figura 6. Sistema de evaluación del hirsutismo descrito por Ferriman y Gallwey. Las
diferentes zonas andrógeno-sensibles se puntúan de 1 a 4 correspondiendo la puntuación
total a la suma de las diferentes áreas.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 317
semicuantitativos. Los primeros son más objetivos,aunque también más sofisticados y, enconsecuencia, limitados a estudios clínicos. Entreestos destacan:
1. Rasurado y pesado o medición del pelo.
Zonas más específicas de
Consiste en rasurar una zona del área corporal
definida, y tras un período de crecimiento
predeterminado proceder a un nuevo rasurado y
evaluación. Se requiere la evaluación de un
número determinado de pelos en cada paciente
(entre 10 y 20). El pesado se realiza con unamicrobalanza y tiene el inconveniente que partedel peso obtenido corresponde a células muertaspor descamación. La medición se realiza con unmicroscopio de 10 aumentos al que se incorporauna regla milimetrada que se hace coincidir conambos extremos del pelo. Sólo se medirán aquellospelos con ambos extremos en forma de bisel (yaque sólo estos corresponden a los previamenterasurados).
2. Burgess y Edwards describieron la técnica de
la fotografía. Mediante un método fotográfico semide la relación del crecimiento piloso. Sinembargo, este método no permite evaluar lapigmentación de la médula ni el calibre del pelo.
3. La técnica de Peerebomm-Wynia se basa en
la medición de la densidad y diámetro del pelo enzonas determinadas.
4. Existen tricómetros especialmente diseñados
que se acompañan de una lupa binocular. Sesuelen asociar a una localizador de la zona con
Cociente abdomen/cadera
brazos ajustables.
Los métodos semicuantitativos, aunque menos
objetivos, son de fácil aplicación clínica. Desde losestudios pioneros de Danforth y Trotter muchostrabajos han evaluado diferentes tests que incluíanun número variable de zonas del cuerpo (dos, tres,etc., hasta 29), que a su vez eran graduadas sobre labase del color, textura o longitud del pelo (desde 2
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 318
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
hasta 9 grados). Los más destacables son:
1. Calificación facial simple de Bardin y Lipsett.
Método sencillo que valora la presencia (+l) oausencia (0) de pelo facial en tres regiones: labiosuperior, mentón y mejillas. A la barba completa sele asigna 4.
2. Método de Ferriman y Gallwey, modificado
por Hacht (figura nº 6). Es el método másdifundido ya que proporciona una apreciación delpelo total del cuerpo, teniendo en cuenta sudistribución y crecimiento. Esta técnica permiterealizar un diagnóstico y un seguimiento posteriorde la paciente, evaluando la respuesta del pelo alos diferentes tratamientos. Básicamente se valorande 11 áreas del cuerpo androgenosensibles. Cadazona es graduada de 0 a 4 con relación al volumen,textura y color del pelo. Para la mayoría de autoresuna puntuación superior a 8 tras la suma de lasdiferentes áreas es diagnóstico de hirsutismo. Sinembargo, algunos investigadores sólo consideran aun paciente hirsuta cuando presentan unapuntuación superior a 10. Este hecho se debe a queeste método que no establece diferencias de tipoétnico o genético y un 15% de las mujeresnormales presentan puntuaciones superponibles ala de mujeres hirsutas. Por esta razón, se haninvestigado las zonas que tendrían una capacidad
Pruebas dinámicas son un
superior de discriminación entre ambos grupos.
Estas corresponden al abdomen, los brazos, laespalda y el mentón. En definitiva, la mayorsensibilidad y especificidad (y por tanto la nosuperposición de puntuaciones) se obtiene tras lasuma de las puntuaciones del labio superior, elmentón, el abdomen inferior y el muslo. Se hademostrado que la puntuación total guarda buenacorrelación con el grado de hiperandrogenismo.
Asimismo, existe una escasa variabilidad entre lasevaluaciones de diferente observadores en unamisma paciente. Estas razones justifican que sea elmétodo más utilizado en la actualidad.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 319
La virilización representa un estadío más
avanzado de hiperandrogenismo. Entre sus
Test gestágenos positivo:
síntomas destaca la clitoromegalia que
consideramos cuando la longitud del clítoris desde
estrogenismo endógeno
la base es superior a 1 cm. Otra posibilidad escalcular el índice clitorideo mediante el productolargo x ancho considerándose como diagnóstico sies superior a 35 mm2.
La exploración física también incluirá una
revisión ginecológica si procede, el cálculo delíndice de masa corporal (IMC) mediante lafórmula: Peso/Talla2. Aunque no existe un acuerdounánime la mayoría de autores adoptan un IMC de25 kg/m como límite entre el normopeso y laobesidad. El cociente entre el perímetro delabdomen (a la altura del ombligo) y de la cadera (ala altura del trocánter) o "waist-hip ratio" (WHR)permite evaluar el tipo de obesidad. Un cocientesuperior a 0,85 es reflejo de una obesidad depredominio superior o androide.
DETERMINACIONES HORMONALES BASALES
Proporcionan información sobre la existencia o
no de un hiperandrogenismo y el origen delmismo. En mujeres con ciclo conservado lasdeterminaciones deberían realizarse en fasefolicular temprana (de los días 2 a 5 del ciclo)mientras que cuando estamos ante una amenorreaexisten discrepancias si deben practicarsepostdeprivación gestagénica o pueden realizarseen cualquier momento. Entre estas tenemos:
• Determinación de gonadotrofinas: FSH y LH.
• Prolactina (PRL).
• Esteroides gonadales y suprarrenales: T, ³4, 17
OHP, SDHA, cortisol, desoxicortisol.
• Otras determinaciones: I y G, SHBG.
El índice de testosterona libre (ITL) se puede
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 320
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
determinar directamente pero en la práctica seobtiene del cociente entre la T y la SHBG por 100.
Las pruebas dinámicas constituyen un
complemento de las determinaciones basales y serecurre a ellas con el objetivo de aumentar lacapacidad diagnóstica del resto de pruebas. Enalgunos casos constituyen elementos claves en elproceso diagnóstico ya que permiten discriminarentre diferentes patologías. Genéricamente laspodemos dividir en aquellas que están orientadasen el diagnóstico diferencial del tipo de amenorreacomo la prueba de impregnación como gestágenos,las que permiten investigar si elhiperandrogenismo es funcional o tumoral como lasupresión con análogos de la GnRH o por últimolas que ayudan a diferenciar su origen como laestimulación con ACTH o con análogos. Acontinuación describiremos las más utilizadas:
• Test de impregnación con gestágenos. Con ella
pretendemos evaluar el estrogenismo basal. Paraello junto a la determinación del estradiol
Buena correlación con el testde testosterona libre
plasmático también se han descrito otraspruebas que valoran el trofismo vaginal. En estecaso se evalúa el grado de impregnaciónestrogénica endometrial. Consiste en laadministración de progesterona natural (100 a200 mg/d durante 5 días) o acetato demedroxiprogesterona (AMP) (10 mg/d/5 días).
Un test positivo (hemorragia por deprivacióntras el tratamiento) implica que existe unestrogenismo endógeno correspondiendo lamayoría de estos casos a anovulacioneshiperandrogénicas. Un test negativo puedecompletarse con la práctica de una prueba deimpregnación con estrógenos y gestágenos (conun preparado contraceptivo oral combinado omediante la asociación de valerianato deestradiol y progesterona o AMP). Si esta prueba
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 321
es positiva existe una integridad anatómica delútero y vagina e indica la existencia de unaanovulación hipoestrogénica.
• El test de supresión con dexametasona y el de
estimulación con ACTH tienen como objetivodiscriminar entre el origen ovárico o adrenal delos andrógenos. En ambos casos el metabolitoestudiado es la 17 OHP basal y postestímulo yeventualmente el cortisol. La supresión condexametasona puede ser corta (1 mg de DXM alas 11 de la noche y determinacioneshormonales a las 8 de la mañana del díasiguiente) o larga (2 mg al día de DXM durante 7días consecutivos). En ambos casos losindividuos normales presentan un cortisolinferior a 5 ng/ml mientras que en la enfermedadde Cushing los valores suelen ser superiores. Laprueba de estimulación com ACTH se utilizapara el diagnóstico de las formas parciales dehiperplasia suprarrenal congénita estandoespecialmente indicada cuando obtenemosvalores basales de 17 OHP moderadamenteelevados (superiores a 6 nmol/l o dos veces másaltos que los valores de la población normal einferiores a los considerados como diagnósticos).
Consiste en la administración de 250 mcg detetraocsátido soluble por vía endovenosa conmedición de la 17 OHP basal, a los 30 y/o 60minutos. Si las concentracionespostestímulo son superiores a 30 nmol/l o elincremento (17 OHP a los 30' menos 17 OHPbasal) superior a 9,5 nmol la paciente esportadora de una deficiencia enzimáticasuprarrenal. La medición de 17
Técnica muy laboriosa
hidroxipregnenolona, la SDHA y el 11desoxicortisol también permite descartar otrosdefectos como los de 3 betahidroxiesteroidedeshidrogenasa o los de 11betamonooxigenasa.
• El test de estimulación con agonistas de la
GnRH (nafarelina o leuprolerina) tiene como
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 322
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
objetivo determinar alteraciones enzimáticas enla esteroidogénesis ovárica. Consiste en laadministración de acetato de leuprolerina (500mcg por vía subcutánea) con determinación de17 OHP a las 21 horas del estímulo. La respuestade la 17 OHP en pacientes con HOF essignificativamente superior (de más de 4,75nmol/l) a la obtenida en mujeres normales o conotras causas de hiperandrogenismo. Ehrmanndemostró que en un 85% de los casos existía unabuena correlación entre esta prueba y lasconcentraciones de testosterona libre tras lasupresión con dexametasona. Sólo un 50% delas pacientes con LH elevada o una imagenecográficamente compatible con ovariopoliquístico presentan esta prueba positiva.
• La evaluación del grado de IR tiene su interés
tanto pronóstico (dada su relación con unaincidencia más alta de diabetes tipo II oenfermedad cardiovascular) como terapéutico(administración de fármacos que mejoren lasensibilidad a la insulina). Existen múltiplespruebas de laboratorio diseñadas con el objetivode evaluar el grado de IR. El test de toleranciaoral a la glucosa constituye el método más
Sólo con altos niveles deandrógenos
difundido en la actualidad. La resistencia a lainsulina se pone de manifiesto por la apariciónde hiperinsulinemia durante la prueba. Noobstante, constituye una prueba poco específicay de baja reproductibilidad. Del apartadoanterior se desprende que puede ser ventajosa lautilización de métodos que eviten el feedbackentre la célula beta pancreática y elaprovechamiento de la glucosa a nivel celular. Eltest de tolerancia intravenosa a la glucosapermite evitar el metabolismo enterohepático.
Bergman propuso el "minimal model" paradistinguir la compleja interacción entre lasecreción de insulina, su acción periférica, sumetabolismo, así como, la acción de otrashormonas contrareguladoras. Este modelopermite mediante un análisis computado
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 323
evaluar el metabolismo de la glucosaindependientemente de su respuesta a la I, ydeterminar la sensibilidad tisular a la misma. DeFronzo y cols describieron un método("euglycemic insulin clamp") que consiste en lainfusión de insulina para mantener sus
Varios criterios ecográficos
concentraciones plasmáticas constantes aniveles elevados (1.000 U/ml) o a niveles bajos(100 U/ml). Simultáneamente se administra Gpara mantener unas concentraciones prefijadas.
Cuando se administra la I el consumo de glucosaaumenta, disminuyendo su producción a partirdel glucógeno. El resultado es un descenso de laG plasmática, que puede ser estimado mediantela medición de la cantidad de glucosaperfundida. Si se mantienen estables lasconcentraciones de glucosa obtenemos el efectoneto de la I perfundida sobre el metabolismoglucídico y procedemos de la misma forma.
Esta técnica es extremadamente laboriosa yparticularmente molesta para la paciente, ya querequiere dos cateterizaciones intravenosas. Eltest de tolerancia intravenosa a la insulinaconsiste en estimular la incorporación de G alcomportamiento intracelular. Una sensibilidadsuperior implica un descenso más rápido de laglucemia. Este descenso de la glucosa plasmáticapuede ser cuantificado mediante una constante(KITT) que se expresa en por ciento y porminuto. Por último, el test de supresión de lainsulina se basa en la capacidad de inhibición
de la producción de I mediante la
administración de epinefrina, propanolol osomatostatina, junto a la administración exógenade G e I. Se asume que la infusión concomitantede estos productos actúa suprimiendo elmetabolismo hepático de la G. La cantidad deglucosa perfundida representará la G total que esincorporada al organismo.
• Prueba de supresión con análogos de la GnRH o
anticonceptivos hormonales orales (AHO). Elobjetivo de este test es determinar el grado de
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 324
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
dependencia de la producción de andrógenosováricos. Por ello se ha utilizado en eldiagnóstico diferencial entre las formasfuncionales y las tumorales. Consiste en laadministración de un análogo de depósito o unAHO de 30 mcg o macrodosificado y evaluar larespuesta a la frenación de los andrógenos y másconcretamente de la testosterona. Ladeterminación concomitante de lasgonadotrofinas servirán como parámetro decontrol de la inhibición del eje hipotálamo-hipofiso-ovárico. Sólo tiene interés cuando losniveles basales de andrógenos son compatiblescon los de una tumoración. El principalinconveniente de esta prueba es que se handescrito tumoraciones que son gonadotropin-dependientes en las que se aprecian
disminuciones de las concentraciones de T
• Hiperandrogenismo
durante la frenación.
ovárico funcional
• Tumores productores• Defectos enzimáticos
DIAGNÓSTICO POR LA IMAGEN
• Patología sistémica
Estas pruebas complementan los datos
obtenidos con la exploración física y lasdeterminaciones hormonales y en algunos casosconstituyen una pieza fundamental en eldiagnóstico. Las más utilizadas son:
• Ecografía transvaginal. La sonda de 7,5 MHz
permite la visualización de ambos ovariosofreciendo toda una serie de características(tamaño, morfología, etc.) que junto al dopplercolor puede orientar hacia una u otra patología.
Para algunas escuelas la ecografía constituye uncriterio fundamental para el diagnóstico delHOF. En la actualidad siguen vigentes loscriterios diagnósticos de Franks y Adams quedefinen el ovario poliquístico por la presenciade 8 o más folículos inferiores a 10 mm dediámetro y localizados en la periferia del ovario(imagen en "rueda de carro") junto a un refuerzodel estroma que se muestra hiperecogénico. A
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 325
éstos se han incorporado nuevos parámetroscomo una superficie ovárica de más de 6 cm2, elengrosamiento de su cápsula, un índice deesfericidad superior a 0,7 o una velocidad demás de 15 cm/s registrada con el doppler.
Incluso se han establecido subclasificaciones deHOF sobre la base de la morfología sonográficaovárica. En la práctica siguen siendo los criteriosclásicos los comunmentes utilizados. Laecografía también se utiliza para el diagnósticode tumoraciones ováricas ya que hoy pueden servisualizadas tumoraciones de hasta 0,5 cm dediámetro. En estos casos la tomografía axialcomputerizada (TAC) o la resonancia magnética
Inicio rápido de hirsutismo
nuclear (RMN) no aumentan la capacidad
es típico de los tumores
diagnóstica de la ecografía.
• La TAC abdominal constituye el método de
elección para descartar tumoracionessuprarrenales y debe realizarse siempre queexiste una sospecha tumoral, y sobre todo, si laecografía de ambos ovarios es normal.
• Cateterización venosa selectiva. Constituye un
método agresivo de diagnóstico que consiste enla introducción de un catéter en una venaperiférica que es guiado hasta localizar las venasováricas y suprarrenales en donde se realizanextracciones para la determinación de losparámetros androgénicos. Su utilización ha deser excepcional y sólo reservada a aquelloscasos en que las otras técnicas de imagen seannegativas, exista una probabilidad muy elevadade que exista una tumoración y el equipo deradiólogos estén familiarizados con la técnica.
No existen suficientes estudios que indiquencual ha de ser el gradiente entre las diferentesdeterminaciones que confirme la localización dela tumoración aunque concentracionessuperiores a 270 ng/ml son altamente negativas.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 326
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
De lo expresado en los apartados anteriores se
podría deducir que tanto la orientación diagnósticade los estados hiperandrogénicos puede serrelativamente fácil o muy compleja y dependerá delo que el observador desee encontrar y de suexperiencia en el campo y de los medios de que
Testosterona es el parámetro
disponga. Antes de plantearse un esquema de
más discriminador
decisión deberíamos preguntamos que es lo quebuscamos, con qué frecuencia se presenta y cómolo definimos. En la práctica podríamos encuadrarlos estados hiperandrogénicos en cuatro grupos: elhiperandrogenismo ovárico funcional (HOF), lostumores productores de andrógenos, los defectosenzimáticos y los casos asociados a otrasenfermedades (Sd de Cushing, hiperprolactinemia,acromegalia, etc.). Se pueden resumir los objetivosdel diagnóstico diferencial en:
1. Evidenciar si existe una hiperproducción
androgénica o un aprovechamiento periféricosuperior.
2. En los casos en que la producción
androgénica está elevada, discriminar entre lostrastornos funcionales y tumorales.
3. Descartada la patología tumoral, apreciar si el
17 OHP diferencia
origen del hiperandrogenismo es ovárico o
Existen una serie de datos de la anamnesis que
serán básicos para un correcto diagnósticodiferencial de los estados hiperandrogénicos:
• Edad de la menarquia y patrón menstrual tras la
misma. Las alteraciones menstruales se suelenasociar a una hiperproducción androgénicaovárica. En el HOF son característicos que lossíntomas se inicien tras la menarquia y que laevolución sea lenta y progresiva. No suelep
tarse en los casos de hirsutismo idiopático, asícomo en las tumoraciones adrenales productorasde andrógenos poco potentes.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 327
Figura 7. Esquema diagnóstico utilizado en el Hospital de Santa Creu i Sant Pau para el
despistaje de las formas parciales de hiperplasia suprarrenal congénita.
• El momento en que la paciente tuvo la sensación
subjetiva de hirsutismo y que progresión hatenido. En los trastornos funcionales la clínica seinicia precozmente (tras la menarquia) y es delenta evolución. Los tumores productores de
SDHA suele estar elevado en
andrógenos se caracterizan por un inicio tardío
sin relación con la pubertad y una rápidaprogresión de los síntomas (1-2 años). Elhirsutismo debe diferenciarse de la hipertricosisque cursa con la presencia de vello fino, nopigmentado y distribuido en zonas noandrógeno-sensibles como la columna lumbar olos brazos (parte posterior). Los traumatismos,los procesos inflamatorios crónicos, laaplicación local de esteroides, el mixedemapretibial, los nevus o las anomalías congénitas(ej.: espina bífida) se acompañan de unahipertricosis localizada. De forma generalizadapuede asociarse a la anorexia nerviosa, elhipotiroidismo, la porfiria o a alteraciones delsistema nervioso central.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 328
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
• Historia familiar de diabetes, ataxia menstrual,
hirsutismo o neoplasias hormonodependientes(hiperplasias o adenocarcinomas de endometrio).
• Síntomas como la sudoración profusa, el
aumento o disminución de peso, las estrías rojo-vinosas, la obesidad troncular, etc. puedenorientar el diagnóstico hacia otros cuadros comoel hiper o hipotiroidismo o el síndrome deCushing.
Cociente LH/FSH no es tan
El primer objetivo del diagnóstico diferencial es
discriminar las formas funcionales dehiperandrogenismo de las tumorales (ováricas oadrenales). La historia clínica es de gran valor, yaque la patología tumoral suele ser de inicio brusco,relativa corta evolución y donde son característicoslos signos de virilización. La T constituye elparámetro más discriminador ya que valoressuperiores a 2,5-3 veces los de la población normal
Figura 8. Parámetros androgénicos basales y proteína portadora de esteroides. Porcentaje
de pacientes con HOF (n = 150) que presentan de cada uno de los metabolitos
estudiados alterado.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 329
son altamente sugestivos de tumoraciónproductora de andrógenos. El diagnóstico secompletará con la realización de una ecografía yuna tomografía axial computerizada suprarrenal.
En caso de duda pueden realizarse tests defrenación, aunque se han descrito tumoracionesque responden parcialmente a estas pruebas. Lalaparotomía exploradora constituirá el métododefinitivo de diagnóstico dado el gran número defalsos positivos y negativos de las exploracionesprevias. En la hipertecosis ovárica también suelenapreciarse concentraciones de T anormalmenteelevadas que se suelen acompañar dehiperinsulinismo y acantosis nigricans.
Una vez descartada la presencia de una
tumoración debe diferenciarse loshiperandrogenismos ováricos de los adrenales(figura nº 7). La determinación de 17 OHP se hademostrado como un buen parámetrodiscriminador. La 17 OHP puede estar aumentadaen las mujeres con HOF debido a la mencionada
Figura 9. Cociente LH/FSH en pacientes con HOF.
Salud reproductiva.qxd 9/10/2002 12:46 PM Page 330
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
disregulación del citocromo P-450, aunqueconcentraciones superiores a 6 nmol/l o 800 ng/dlen fase folicular temprana son altamentesugestivas de una hiperplasia suprarrenalcongénita en su forma tardía o parcial. Cada
Presencia de múltiples
laboratorio debe establecer a qué nivel se decide
folículos se acompaña de
indicar un test de ACTH para descartar una forma
parcial de HSC. En nuestro medio cuando las
concentraciones basales superan los 15 nmol/l nosencontramos ante una FPHSC. Si lasconcentraciones superan los 6 nmol/l o 2 veces losvalores de la población normal pero son inferioresa 15 nmol/l se deben realizar pruebas funcionalesde frenación (test de dexametasona) y/oestimulación (test de ACTH). La ausencia defrenación o el un incremento sobre la basal de másde 9 nmol/l respectivamente, son indicadores de unorigen adrenal. El diagnóstico definitivo sólo puedecompletarse con un estudio genético del que en lapráctica no disponemos. El SDHA suele estarelevado en los casos de hiperplasia suprarrenalcongénita (precoz y tardía), sin embargo se handescrito casos con valores normales.
Tras descartar estas patologías nos quedan los
hiperandrogenismos ováricos funcionales. Existendos aproximaciones diferentes: la hormonal y laecográfica. Ambas pueden combinarse con un testde gestágenos ya que nos encontramos anteprácticamente el único tipo de anovulación normoo hiperestrogénica. Sin embargo, existen falsospositivos que se producen en los casos dehipogonadismo hipogonadotropos que están enfase de resolución. Si a los parámetrosandrogénicos antes mencionados le añadimos laSHBG y calculamos el índice de testosterona librepodríamos detectar un hiperandrogenismo en un90% de los casos (figura nº 8). Las determinacionesde ³4 son de poco valor diagnóstico si no seacompañan del resto de determinacioneshormonales androgénicas. Dado su origen mixto(ovárico y adrenal) pueden apreciarseconcentraciones elevadas en adenomas adrenales,
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 331
Figura 10. Esquema diagnóstico de los estados hiperandrogénicos (modificada de los
documentos de la SEGO, 1998).
carcinomas, cuadros de hiperplasia suprarrenalcongénita y ocasionalmente en tumores ováricos.
Su aumento moderado aislado o coincidiendocon una elevación de la testosterona se aprecia enel HOF. El resto de parámetros androgénicos juntoal cociente LH/FSH ofrecerán pocas ventajasdiagnósticas respecto a los metabolitos antes
Si bloqueo enzimático es
citados. Concretamente de forma clásica se
importante se tratan con
consideraba criterio diagnóstico del HOF el
aumento de la concentración basal de LH con FSHnormal o algo superior y un cociente LH/FSHsuperior a 2 o 3. Sin embargo, existen evidenciasde dos grupos de pacientes (con LH alta y LHnormal o ligeramente aumentada) y por tanto no esun criterio válido para pacientes obesas coninsulina alta. Este hecho junto a la variabilidad dela LH consecuencia de su secreción pulsátil hacenque su sensibilidad y especificidad sean bajas enuna sola determinación (figura nº 9). En cambio
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 332
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
cuando se practican determinaciones seriadas sóloen un 10% de los casos se encuentran dentro de lanormalidad.
No existen datos que avalen el valor de
determinar sistemáticamente la glucosa y/oinsulina basal aunque sí es aconsejable enpacientes muy obesas o con antecedentes dediabetes gestacional realizar un test de toleranciaoral a la glucosa. Adornarían el diagnóstico ladeterminación del ITL previa supresión condexametasona o el test de estimulación con GnRH,pero en la práctica clínica diaria su interés es
Figura 11. Esquema terapéutico de los HOF (modificada de los documentos de la SEGO,
1998).
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 333
relativo con la ecografía podemos ampliar elespectro diagnóstico (recuerden los casos silentes)pero como prueba única tiene una bajasensibilidad y especificidad (en un 30% de laspacientes con anovulación hiperandrogénica losovarios son ecográficamente normales y hasta enun 90% de las formas parciales de hiperplasiasuprarrenal congénita el ovario cumple criterios deOP). Además sólo se ha validado cuando sepractica por vía transvaginal. La ecografía tiene
Si sobrepeso existe debemos
valor pronóstico cuando la paciente tenga deseos
tratarlo en primer lugar
gestacionales y es sometida a programas deinducción de la ovulación ya que la presencia demúltiples folículos se acompañará de un riesgosuperior de hiperestimulación y embarazomúltiple.
Las pacientes con hirsutismo y parámetros
androgénicos normales son catalogadas comohirsutismo idiopático o periférico. En estos casosexiste un aprovechamiento periférico superior yasea por un aumento de la metabolización periféricade testosterona a su metabolito activo, la DHT o porun aumento de la sensibilidad del folículo piloso.
Si bien en estos casos las concentracionesperiféricas de los metabolitos de la DHT (el 3αandrostenodiol y su forma glucuronada) estánelevadas, también lo están en los casos de HOF, porlo que su valor tienen escaso valor discriminatorio.
En la figura nº 10 se puede apreciar el algoritmopara el diagnóstico diferencial de los estadoshiperandrogénicos.
Tendencia a recuperar elpeso
Una vez finalizada la etapa diagnóstica la
decisión terapéutica variará en función de doselementos: la fuente del hiperandrogenismo y losobjetivos del tratamiento. En el caso de identificaruna causa tumoral se procederá a la extirpación dela tumoración. Teniendo en cuenta que puede
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 334
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
localizarse tanto en la suprarrenal como en elovario y que puede tratarse de distintos tipos detumores el proceso de toma de decisiones escomplejo y se adaptará a las circunstancias de cadapaciente. En algunos casos la decisión final puededepender del resultado del estudio preoperatorio.
En los casos funcionales de la suprarrenal
(déficits enzimáticos) la decisión de frenar lasuprarrenal dependerá del grado de afectación. Amayor grado de alteración enzimática más altos
Tres motivos de consulta:
serán los niveles de andrógenos y más
• Alteración menstrual
comprometida estará la actividad glucocorticoide.
• Manifestaciones
En los casos leves el tratamiento con
contraceptivos orales que contengan gestágenos
• Deseo gestacional
antiandrogénicos puede reducir la sintomatologíacutánea y normalizar el ritmo menstrual si estáalterado. Cuando el bloqueo enzimático esimportante el tratamiento con corticoides restauralos niveles de cortisol y frena el exceso deesteroides precursores. Se pueden administrardosis bajas de dexametasona (entre 0,25 y 1 mg endosis única por la noche) o hidrocortisona (10-20mg/m2 al día), usando como control los nivelesplasmáticos de ³4 y 17 OHP. Si se desea unembarazo y la administración de dexametasona nonormaliza la función ovulatoria puede recurrirse alas técnicas de inducción de la ovulación que seespecificarán más adelante. Cuando se obtiene unagestación se mantendrá la dosis de dexametasonay se aplicarán las técnicas de diagnóstico prenataladecuadas para detectar precozmente la afectaciónfetal e iniciar si procede el tratamiento concorticoides.
En la práctica la mayoría de los
hiperandrogenismos corresponden a diferentesformas clínicas de HOF. Dada la disparidad clínicaes sumamente importante que el enfoqueterapéutico siempre esté condicionado por lasnecesidades de cada paciente (figura nº 11).
Genéricamente los objetivos a conseguir son:
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 335
• Inhibir la hiperproducción de andrógenos.
• Corregir la clínica de hiperandrogenismo.
• Regulación de los ciclos menstruales.
Análogos de la GnRH nojustificados
• Restablecer la fertilidad de las pacientes u
ofrecer una protección contraceptivadependiendo de las necesidades de cada caso.
La primera medida terapéutica en mujeres con
sobrepeso, independientemente de que deseen ono una gestación, es intentar la reducción delmismo. Múltiples estudios han demostrado queuna reducción de un 5-10% del peso comportauna mejoría de la resistencia a la insulinaapreciándose reducciones en las concentracionesbasales y estimuladas de insulina, glucosa y ácidosg
libres y una mejoría del perfil androgénico(reducción de T, ³4, etc. y aumento de la SHBG)restableciéndose ciclos menstruales regulares y lafertilidad de estas pacientes. Se obtienen mejoresresultados con dietas bajas en grasas y ricas enproteínas que contengan durante las primerascuatro semanas entre 400 y 500 kcal/d paracontinuar con una dieta de mantenimiento de1.500 kcal/d, no siendo tan importante conseguirun peso ideal sino la propia restricción calórica, yaque se aprecian efectos beneficiosos con índices demasa corporal incluso superiores a 27 kg/m2. Sin
Acetato de ciproterona
embargo, lo que parece tan fácil en teoría no lo esen la práctica ya que muchas de estas pacientessuelen abandonar el tratamiento por falta demotivación y especial dificultad para experimentardescensos significativos del peso. Además enaquellas en las que se consiguen resultadospositivos se produce una recuperación del pesoinicial antes de un año del cese de la dieta. Ambosfactores parecen estar íntimamente relacionados auna alteración del metabolismo glucídico que esindependiente de la obesidad. Las mujeres afectasde HOF presentan una respuesta pancreáticaexagerada a un estímulo glucídico normal. Entre
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 336
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
los factores responsables se han señalado unvolumen superior de células beta-pancreáticas y/ouna sensibilidad superior. En ambos casos elhiperinsulinismo que será primario y central
estimularía la ingesta de carbohidratosfavoreciendo la obesidad y creando anovulacióncon el consiguiente déficit de progesterona. Ello seacompañaría de un aumento de la actividad delcortisol en el tejido grado, y por lo tanto, de unatasa superior de lipolisis que junto a la obesidaddarían lugar a una IR periférica secundaria.
En la práctica diaria una paciente afecta de un
hiperandrogenismo ovárico o suprarrenalfuncional puede consultar por tres razones, quepueden darse de forma aislada o concomitante:alteración menstrual, manifestacionesandrogénicas cutáneas o deseo gestacional.
PACIENTES QUE NO DESEAN EN
LA ACTUALIDAD UNA GESTACIÓN O
CON DESEOS GENERATIVOS YA CUMPLIDOS
Podríamos clasificar las modalidades de
tratamiento en cuatro:
Aquellas que suprimen la fuente de andrógenos
Los anticonceptivos orales constituyen el
tratamiento de elección en estas pacientes. Alinhibir el eje hipotálamo-hipofiso-ovárico reducenla producción de andrógenos en el ovario. Elcomponente estrogénico aumenta la producción deSHBG limitando el acceso de los andrógenos alcompartimento periférico. Asimismo inducen unpatrón menstrual regular con pérdidas periódicaspor deprivación. Ya que el objetivo básico esactuar sobre el eje reproductivo, puede prescribirsecualquier anticonceptivo oral microdosificado.
Sin embargo, dado que uno de los objetivos esactuar sobre la clínica de hiperandrogenismo sonrecomendables las preparaciones con un gestágeno
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 337
antiandrogénico (acetato de ciproterona) o el usode nuevos compuestos de baja potenciaandrogénica (desogestrel o gestodeno).
La administración de análogos de la GnRH de
depósito o de forma continua da lugar a unahipofisectomía química, y en consecuencia, reduce
Screening previo de
los niveles de LH, ³4 y T. Su acción es dosis
dependiente, y tras la interrupción del tratamientose restablece la relación anómala entre la LH y laFSH. Los efectos secundarios derivados de su
administración a largo plazo, junto a su elevadocoste no justifican su utilización en los estadoshiperandrogénicos
Aquéllas que sólo regulan el patrón menstrual
Los gestágenos cíclicos vía oral(5 a 10 mg de
AMP desde los días 15 al 25 del ciclo), continuos(30 mg/d) o los preparados de depósito de lamedroxiprogesterona (150 mg cada 3 meses vía imo 30 mg/d vía oral) son una alternativa válida.
Estos preparados son útiles sólo en aquellos casosen los que predominan las alteracionesmenstruales.
Fármacos con efecto antiandrogénico periférico
Son sustancias que bloquean la metabolización
de la T a DHT inhibiendo la 5αreductasa y/ocompiten por el receptor periférico de losandrógenos. El más utilizado en Europa es elacetato de ciproterona (AC), gestágeno de síntesisderivado de la 17 OHP. Principalmente actúacomo antigonadotropo y antiandrogénico, aunquetambién favorece el aclaramiento de la testosteronay aumenta las concentraciones periféricas deSHBG. El AC se almacena en el tejido graso, por loque la administración durante un período de 10días permite mantener durante un mes unosniveles detectables en sangre periférica. Las dosisrecomendadas son de 25 a 100 mg diarios. Suadministración se suele asociar a un CHO o a
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 338
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Tabla 4. Diferentes modalidades terapeúticas en los estados hiperandrogénicos.
Mecanismo de acción, vías y dosis de administración y efectos secundarios
EspironolactonaFlutamida Finasteride Cimetidina Ketoconazol
Inhibicióneje HH
50-150 mg 100-200 mg 125-750 mg
10-12 d/mes C. invertido
Galactorrea Hiper TGC
ACP: Acetato de ciproterona, AHO: Anticonceptivos hormonales orales.
etinilestradiol (30 kg) en ciclo invertido desde eldía 5 al 14. Entre sus erectos secundarios destacanlas alteraciones menstruales, el aumento de peso,la disminución de la líbido, las náuseas y lascefaleas.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 339
La espironolactona es un antagonista de la
aldosterona con una alta afinidad por el receptorde la DHT utilizado como diurético en eltratamiento de la hipertensión leve. Su metabolitoactivo es la canrenona. También actúa sobre laesteroidogénesis ovárica y suprarrenal ya queinhibe el citocromo P150c17. Las dosisrecomendadas varíandesde 25 a 200 mg/día. Las polimenorragias ehipermenorreas son el efecto adverso másfrecuente por lo que no suele indicarse en los casosen los que el ciclo menstrual no está conservado.
También se han descrito náuseas, cefaleas,cansancio o lasitud.
La flutamida es un antiandrógeno no esteroideo
puro sin actividad gluco o mineralcorticoide quese une al receptor intracitoplasmático de ladihidrotestosterona formando complejos inactivos.
Además de impedir que los andrógenos accedan alreceptor periférico se ha demostrado quedisminuye la actividad del citocromo P450 yaumenta la metabolización de los andrógenos. Enlos ensayos iniciales se administraba a dosis de750 mg/día, aunque estudios recientes señalan quecon 250 mg/d se obtiene un resultado similar porlo que las dosis recomendadas se sitúan entre 125y 500 mg. Se ha mostrado efectivo en la reduccióntanto del hirsutismo como del acné siendo suefecto ya positivo a partir de los dos meses detratamiento. Los estudios comparativos,básicamente con espironolactona, muestran unaeficacia como mínimo similar. Entre los efectossecundarios se encuentra la sequedad de piel, el
incremento del apetito o la disminución de lalíbido. Un comentario aparte merece los casos dehepatitis medicamentosa asociados a laadministración de flutamida. Se han registradohasta 14 muertes en Estados Unidos siendo laincidencia aproximada del 0,36%. Se ca-racteriza por un incremento agudo de lastransaminasas junto a cambios anatomopatológicoshepáticos compatibles con un proceso inflamatorio
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 340
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
agudo (necrosis y esteatosis). En general se suelepresentar durante las primeras cuatro semanas detratamiento y se resuelve espontáneamente a laspocas semanas de suspender la medicación. Noexisten evidencias de que con dosis bajas (125 a250 mg/d) se hayan producido cuadros dehepatopatía aunque se recomienda un screeningprevio al inicio del tratamiento y controlesperiódicos.
El Finasteride es un inhibidor de la 5α
reductasa que también se ha demostrado efectivoen el tratamiento del hirsutismo y el acné. Suefecto parece superior si se asocia a unanticonceptivo hormonal oral siendo losprincipales efectos secundarios las cefaleas y lasmolestias gastrointes-tinales.
Existen otros antiandrógenos como el
ketoconazol o la Cimetidina, sin embargo sólo sonefectivos a dosis altas e inducen importantesefectos secundarios. En la tabla nº 4 se exponen lasprincipales características de las diferentesmodalidades terapéuticas.
Las modalidades de tratamiento médico
descritas inhiben la transformación de vello apelo terminal, sin embargo no suprimencompletamente el vello terminal pre-existente. Serequieren métodos físicos para inducir a cortoplazo una mejoría del hirsutismo. Entre estosfiguran:
• Rasurado. Aunque suele ser un método
rechazado por las pacientes, no hay evidenciasde que induzca cambios en la textura, color ocantidad del vello. Es el mejor método paraeliminar el pelo terminal de las extremidades.
• Cremas depilatorias. La mayoría contienen
tioglicolato cálcico, que actúa sobre los enlacesbisulfuro de la queratina. Inducen unadestrucción temporal del pelo ya que el
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 341
crecimiento se reinicia en 24-48 horas. La únicadiferencia respecto al método anterior es quetras su aplicación el pelo al crecer adquiere unaspecto más blando y menos aparente.
• Depilación con cera. Este método permite la
depilación de áreas circunscritas. Escosméticamente muy bien aceptado y lapaciente puede aplicárselo ella misma. Lafrecuencia de aplicación dependerá de lascaracterísticas de la paciente, aunque se requiereun crecimiento mínimo del pelo para que seaefectivo.
• Depilación con pinzas. Es práctico para
superficies muy pequeñas. Es muy doloroso ypuede producir una foliculitis si no se aseapreviamente el área a depilar.
• Electrólisis. Se basa en la aplicación de una
corriente eléctrica de alta frecuencia. Para quesea efectiva debe aplicarse de forma repetida
No tratamiento idóneo
sobre una misma área con un intervalo de dos otres semanas. Entre los efectos secundarios sehan descrito el dolor durante el tratamiento,cuadros inflamatorios, y en raras ocasiones, latransmisión de la hepatitis B.
• Recientemente se ha incorporado la
fotodepilación por pulsos continuos de láser-rubí que parece ser un método muy prometedor.
Fármacos que aumentan la sensibilidad
a la insulina
Hasta hace pocos años siempre se había
actuado directamente sobre el hiperandrogenismo,sin embargo, si consideramos que elhiperinsulinismo es primario su correccióndebería comportar de forma secundaria unaresolución parcial de la hipersecrecciónandrogénica. Las primeras experiencias selimitaban a estudios a corto plazo con el objetivode investigar mecanismos fisiopatológicos. Al
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 342
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Diazóxido le siguieron los análogos de lasomatostatina. Estos últimos se han demostradoeficaces a dosis de 200 mcg/d al reducir lasconcentraciones de insulina postestímulo y deandrógenos (testosterona y androstenodiona) sin
Dieta y ejercicio
modificaciones del índice de masa corporal. Sinembargo, el efecto sobre los andrógenos pareceatribuible a la acción directa del análogo sobre lahipófisis ya que concomitantemente induce unadisminución en las concentraciones de LH. Apesar de ello, Fulghesu y cols. tras administraroctreotido durante 6 semanas apreciaron que ladisminución de insulina, andrógenos y LH sólo seapreciaba en pacientes hiperinsulinémicas y no ennormoinsulinémicas. Aun así, la elevadaincidencia de efectos secundarios (diarrea ydescompensación del metabolismo glucídico)
Citrato de Clomifeno
hacen que su aplicación a más largo plazo sea pocoviable.
La Metformina es una biguanida cuyo
mecanismo de acción es desconocido aunqueparece que disminuye la producción hepática deglucosa y aumenta su captación periférica. Suaplicación en pacientes obesos einsulinoresistentes comportó una mejoría de lasensibilidad a la insulina, una disminución de lascifras tensionales y una franca mejoría del perfillipídico. El primer estudio en pacientes con HOFa dosis de 500 mg/8h mostró resultadosesperanzadores con reducciones del 30-40% de lasinsulinemias basales y estimuladas, de un 40-50% de los diferentes andrógenos estudiados y unincremento de la SHBG de un 33%. Sin embargo,diferentes autores no aprecian cambiossignificativos. Esta puede estar condicionada por elgrado de restricción calórica y a la perdida depeso, ya que sólo en estos casos se han apreciadoresultados positivos. El tratamiento conMetformina tampoco parece modificarostensiblemente las concentraciones degonadotrofinas ni la esteroidogénesis ovárica,habiendo sido este último punto comprobado in
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 343
vitro. Sin embargo, recientemente el grupo deNestler ha apreciado una disminución del AUC deI del 53% acompañada de un descenso tanto de la17 OHP basal como de la postestimulada conGnRH tanto en mujeres obesas como delgadas yademás sin apreciarse un cambio significativo en
Máximo efecto en los tres
el peso de las pacientes, concluyéndose que el
hiperinsulinismo podría alterar el funcionamientodel citocromo P450alfa.
Más recientemente se ha introducido la
Troglitazona a dosis de 400 mg al día. Es underivado de las tiazolidinedionas que aumenta lasensibilidad insulínica en el hígado, tejido adiposoy muscular. Actúa como ligando de un receptorque aumenta la transcripción de factores quepromueven el aprovechamiento de la glucosa. Sumayor impacto es sobre la biodisponibilidad deglucosa. Dunaif y cols en 1996 apreciaron queaumentaba la sensibilidad a la I, disminuía lasconcentraciones de andrógenos y de LHindependientemente de las variaciones en elíndice de masa corporal. Ehrmann apreció unadisminución del activador del plasminógeno 1 quese ha asociado a la IR y a un incremento del riesgode enfermedad coronaria. Sin embargo, serequieren más estudios a más largo plazo queevalúen de forma objetiva el efecto de latroglitazona en el HOF.
Si falta CC se continúa congonadotrofinas
PACIENTES QUE DESEAN UNA GESTACIÓN
No existe un tratamiento idóneo de la
disfunción ovulatoria probablemente porque noconocemos las causas íntimas que condicionan lasalteraciones del desarrollo folicular. Por lo tanto eltratamiento siempre es sintomático y el objetivo essimular lo mejor posible un ciclo normal (obtenerovulaciones monofoliculares). Como ya se hacomentado el tratamiento siempre deberáindividualizarse ya que la respuesta difiere depaciente a paciente sin que conozcamos todos los
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 344
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
factores que condicionan desde la falta o pobrerepuesta folicular a la hiperespuesta, siendo lafrontera entre ambas variable de ciclo a cicloincluso en una misma paciente. Sabemos quetanto el sobrepeso (y en especial la obesidad depredominio superior o androide) como laexistencia de niveles tónicos de LH elevados sonfactores de mal pronóstico. Será prioritario quepreviamente o concomitantemente al tratamientoinductor de la ovulación se pongan a contribuciónmedidas que intenten normalizar el peso. Kiddydemostró que la reducción de un 5% del pesocorporal, incluso sin llegarse al normopeso,comportaba en un porcentaje elevado de casos larestauración espontánea de ciclos ovulatorios.
Asimismo la respuesta al tratamiento se hademostrado más eficaz cuando se acompaña demedidas dietéticas. Aunque se han propuesto
Figura 12. Días de tratamiento y dosis necesaria para obtener un desarrollo folicular
óptimo en pacientes del grupo II de la OMS. Estudio comparativo multicéntrico europeo
entre la FSH urinaria y la FSH recombinante.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 345
tratamientos médicos (Metformina, Troglitazona,etc.) en la actualidad la dieta y el ejercicio físicoconstituyen las alternativas más utilizadas.
También se han propuesto medidas específicaspara las pacientes con niveles elevados de LH(tanto basales como durante la administración de
inductores) entre las que cabe destacar: laadministración concomitante de análogos de laGnRH, el tratamiento previo al inicio de lainducción de la ovulación con progesterona o lamultipunción ovárica vía perlaparoscópica.
El tratamiento de elección es el Citrato de
Clomifeno (CC). El CC es un derivado trifeniltilenocompuesto de una mezcla racémica de dosisómeros: el en y el zuclomifeno con capacidad de
unión a los receptores esteroideos actuando
Figura 13. Pautas de administración de gonadotrofinas para el tratamiento de la ana-
ovulación hiperandrogénica.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 346
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
dependiendo del órgano diana como antiestrógenoo como estrógeno débil. Aunque puede actuar adiferentes niveles, existe un consenso de que suacción se desarrolla preferentemente a nivelhipotalámico uniendo a los receptores de E2. Conello se interfiere que los estrógenos endógenosactiven el sistema de retroalimentación negativoque condiciona en estas pacientes una alteraciónen la secreción de GnRH. Se ha demostrado que
Cuando folículo alcanza
tras su administración se normaliza la secreción
18-20 mm administrar HCG
del factor liberador de gonadotrofinas y se produceun incremento en las concentraciones de FSH yLH. Se administra por vía oral a dosis de 25 a 250mg/d durante 5 días, iniciándose la toma entre elsegundo y el quinto día del ciclo. Dado que elporcentaje de embarazos múltiples no supera el 5-10% y el de hiperestimulaciones el 1% no precisamonitorización ecográfica del desarrollo folicular,siendo suficiente la determinación diaria de latemperatura basal para comprobar la existencia ono de ovulación. Se consiguen hasta un 75-80% deciclos ovulatorios mientras que el porcentaje degestaciones está entre un 30 y 40%. Las diferenciasentre ovulaciones y gestaciones se han atribuido alefecto deletéreo que podría ejercer el incremento
Indicaciones de FIV:
de las concentraciones de LH junto a la acción
• Fracaso inducción
antiestrogénica que ejerce el CC sobre el
endometrio y el moco cervical. El máximo
• Hiperestimulación
porcentaje de gestaciones se obtiene con dosis de
50 a 100 mg y durante los tres primeros meses detratamiento. No se aconseja prolongar eltratamiento más allá de 6 a 9 meses ya que su usoprolongado se ha relacionado con un incrementode la incidencia de cáncer de ovario. Para evitarlos efectos deletéreos e incrementar el porcentajede ciclos ovulatorios y embarazos se ha propuestoextender los días de tratamiento a 10, asociar el CCa Dexametasona a dosis de 0,25-0,5 mg/d, aBromocriptina en los casos de hiperprolactinemiao administrar HCG (entre 5.000 y 10.000 UI) paraprovocar el picoovulatorio. Recientemente la asociación de
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 347
Metformina (500 mg/d) a CC permitía obtener un90% de ciclos ovulatorios en pacientes quepreviamente habían sido resistentes al CC. Seconsidera un fallo del CC cuando no se obtiene laovulación con dosis máxima (que en generalsuelen ser de 150 mg) o cuando existe 6 o 9 ciclos
Altas concentraciones de
ovulatorios sin que se haya producido la gestación.
estradiol (> 2.500 pg/ml)tienen peor pronóstico para
Cuando existe un fallo del CC el tratamiento
debe continuarse con la administración degonadotrofinas. De éstas se han comercializadosproductos obtenidos de la orina de mujeresmenopáusicas que son mezcla de FSH y LH (HMG)o que contienen básicamente FSH (y escasacantidad de LH). No existen diferencias en losresultados obtenidos con HMG y FSH, aunque laexistencia de niveles normales o incluso elevadosde LH endógena hace innecesaria la asociaciónconcomitante de LH a la FSH. Recientemente hasido introducida la FSH recombinante. Susventajas residen en la ausencia de actividad LH, deproteínas contaminantes con actividad biológica yel disponer de una fuente inagotable. En un ensayomulticéntrico europeo en el que se comparaba laFSH recombinante con su homónima la urinaria sedemostró que manteniendo una misma eficacia seconseguía una mayor eficiencia (menos días detratamiento y dosis administrada) (figura nº 12).
Estas diferencias podrían ser atribuidas a laausencia de proteínasantiFSH o la existencia en el producto sintético deisoformas con mayor actividad biológica.
Los primeros intentos de inducción de la
ovulación o lo que hoy conocemos como"protocolos clásicos" no tenían en cuenta losaspectos fisiológicos del ciclo ovulatorio. Asemejanza de las pautas de hiperestimulación de laovulación se iniciaban con la administración de150 a 225 UI de FSH al día, dosis que seincrementaba en 75 cada 3-4 días. De su aplicaciónse obtuvieron tasas de gestación del 20 al 25%. Sinembargo, el porcentaje de embarazos múltiples se
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 348
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
situaba entre un 20 y un 40% y el dehiperestimulaciones graves entre un 10 y un 15%.
Para evitar estos efectos secundarios se idearon loque hoy denominamos "protocolos lentos" de losque en la actualidad existen dos aproximaciones
Laparoscopia similar en
diferentes. La experiencia más importante se ha
eficacia a laparotomía
acumulado con los protocolos tipo "step up" (o dedosis creciente) en los que la estimulación seinicia con 50 o 75 Ul/día y se mantiene la dosisestable hasta 14 días. En el caso de que no existierarespuesta se incrementaría en 37,5 Ul hasta unmáximo de 225 UI/día. En ciclos sucesivos la dosisinicial se establecería sobre la base de la dosisefectiva del ciclo anterior. Con estas pautas elporcentaje de gestaciones es algo inferior(alrededor del 15-20%) pero sólo se aprecian un10% de embarazos múltiples y apenas existencasos de hiperestimulación grave. La pauta de"step down" o decreciente intenta remedar elciclo natural. Se inicia con dosis altas de FSH (150U/d) que se mantienen hasta que el folículoadquiere un diámetro de 10 mm, momento en quese reducen hasta 112,5 U durante tres días y denuevo se baja la dosis a 75 U hasta que se completeel crecimiento folicular (figura nº 13). Losresultados de esta pauta son similares a losdescritos para el protocolo anterior. En todos los
No aumenta el fallo ovárico
casos la administración de gonadotrofinas se
acompaña de la de HCG para provocar laovulación cuando los folículos alcanzan undiámetro de 18 a 20 mm. Es indispensable que semonitorize la respuesta ecográficamente. Paraevitar los embarazos múltiples y lashiperestimulaciones se suspenderá el tratamientosi se aprecian más de 3 folículos de más de 16 mmde diámetro, si hay más de 6 de más de 13 mm o silas concentraciones de estradiol son superiores a3.000 pmol/l.
Otras opciones terapéuticas
Fecundación in vitro
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 349
Los protocolos de fecundación in vitro estarían
indicados cuando: se ha producido un fracaso dela inducción de la ovulación o lo que es lo mismotras 12 ciclos ovulatorios tras tratamiento congonadotrofinas sin gestación después de habersedescartado otras causas de esterilidad o sicoexisten el HOF y otra causa de esterilidad que laindique (factores tubáricos, seminales, etc.).
También se puede considerar esta técnica cuandoen el curso de una inducción de la ovulación seproduce una hiperestimulación ovárica.
Si no desea gestación:
Básicamente los protocolos de inhibición-
• AHO combinado
estimulación utilizados en estas pacientes no
• Métodos cosméticos
difieren de otras indicaciones de FIV, si excluimosque dado los efectos negativos del CC éste no sueleemplearse. En estos casos es importante la
Si desea gestación:
asociación a gonadotrofinas de análogos de laGnRH con el fin de evitar las luteinizaciones
• Inductores de la ovulación
prematuras, aumentar las tasas de fecundación y
• Gonadotrofinas
disminuir la de abonos. En general se obtienen
• Multipunción
porcentajes de fecundación del 70-80% y hasta un20-30% de gestaciones. Se ha demostrado que laobesidad y más específicamente la IR y elhiperinsulinismo que la acompañan son factoresde mal pronóstico acompañándose de una malacalidad oocitaria. Asimismo el alto reclutamientofolicular se acompaña de concentraciones deestradiol muy elevadas. Valores superiores a 2.500pg/ml (preHCG) se acompañan de tasas deimplantación y gestación inferiores y si los nivelesson superiores a 1.500 pg/ml en los días 3-6postHCG no se producen gestaciones. En estoscasos también existe un riesgo más elevado dehiperestimulación habiéndose propuesto lacongelación selectiva de todos los embriones y suposterior transferencia en ciclos sustituidos conestrogestágenos.
Otra opción que será interesante en los
próximos años son los antagonistas de la GnRH. Yaexisten estudios que combinan su administracióncon la de GnRH pulsátil. Los resultados no sonmejores de los que ya disponíamos de la
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 350
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
asociación con análogos reforzándose la hipótesisde que más que una disfunción hipotálamo-hipofisaria nos encontramos ante un problemaovárico. Una alternativa a explorar de gran interéses la aplicación de antagonistas en los casos deabortos de repetición. De todas formas losbeneficios obtenidos por los agonistas de la GnRHen la reducción de la tasa de abortos han aportadoresultados controvertidos.
Durante muchos años se propuso la resección
• Multipunción
en cuña perlaparotómica de ambos ovarios como
tratamiento alternativo. Con éste abordaje, si biense conseguían unas altas tasas de gestación (entreel 40 y el 70%), suponía una pérdida importantede potencial ovárico y el porcentaje de adherenciaspostquirúrgicas era elevado (entre un 30 y un50%). Gjonnaess en 1984 introdujo unamodificación de esta técnica mediante abordajelaparoscópico basada en la electrocoagulaciónovárica múltiple (realizar de 8 a 15 coagulacionesselectivas de 2 a 4 mm de profundidad con 300-400 W durante 2-4 segundos). Recientementetambién se ha utilizado el láser de CO2, argón oNd:YAG. Los resultados hormonales tras elprocedimiento laparoscópico son similares alapreciado con la antigua resección. Entre 24-48horas ya es perceptible un descenso en las
concentraciones de LH y de los andrógenoscirculantes. La revisión más amplia del resultadode esta técnica (947 casos) arroja unas tasas deovulación del 82%, de gestación del 60 al 70% yuna reducción en el porcentaje de abortos. Otrobeneficio importante es que tras el acto quirúrgicolos resultados tanto de la inducción de laovulación como de la FIV mejoran a los obtenidospreviamente. La complicación más frecuente, aligual que para la resección cuneiforme, es laformación de adherencias postquirúrgicas quepueden reducirse mediante la instilación en
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 351
cavidad peritoneal de una solución salina (aproximadamente 500 ml) o Ringerlactato. Existe una gran variabilidad entre los resultados de los diferentesestudios y el porcentaje de casos en que se presentan va desde un 16 a un 80%.
En cualquier caso la frecuencia es inferior a la que presentaba el métodolaparotómico. No se ha demostrado que la multipunción aumente la incidenciade fallo ovárico prematuro aunque estudios en animales muestran que el númerode folículos destruidos es superior con láser que con electrocirugía. Los casosdescritos suelen corresponder a aquellos en que la coagulación afecta al hilioovárico o excede las 20 punciones.
Recomendaciones prácticas para el tratamiento
Es importante recalcar que para la mayoría de estados hiperandrogénicos el
tratamiento siempre será sintomático y no etiológico y por lo tanto las opcionesterapéuticas se deberán ajustar a las necesidades de cada paciente. Otraconsideración interesante es que la mayoría de estos cuadros son crónicos porlo que la norma una vez que se decida suspender la terapia es que en un espaciode tiempo más o menos dilatado la sintomatología reaparezca. Por lo tanto,cuando una terapia se ha demostrado efectiva no debería interrumpirse a no serque cambie la situación personal de la paciente.
En las pacientes que no desean una gestación el tratamiento de elección es un
AHO combinado microdosificado. No existe un AHO de elección ya que no seha demostrado que los preparados con gestágenos antiandrogénicos seansuperiores a los gestágenos de tercera generación. Es importante informar a lapaciente de que los resultados estéticos sólo serán evidentes a largo plazo y nose puede dar un tratamiento por fracasado hasta que no pasen al menos 12 mesesdesde el inicio de la terapia y de poco sin cambiar de un antiandrógeno a otro enel caso de baja respuesta. Asimismo se debe recomendar a la paciente que utilicealgún método complementario de depilación. No existen ventajas entre losdiferentes métodos y no es cierto que se favorezca a corto plazo unempeoramiento del cuadro. Si el hirsutismo es grave se puede asociar unantiandrógeno al AHO. En las pacientes en las que predominan las alteracionesmenstruales, sobre todo si son muy jóvenes y no tienen relaciones sexuales, laadministración de gestágenos cíclicos constituye una opción de primera línea.
En cambio, cuando se mantiene la ciclicidad menstrual y el motivo de consultason los signos de hiperandrogenismo los antiandrógenos constituyen unabuena alternativa. En cualquier caso la mejoría sólo será evidente en un 50-70%de las pacientes sin que existan diferencias significativas entre los diferentespreparados. Debería ponerse a la paciente sobre aviso de que estos preparadospueden inducir feminización de los fetos masculinos y que por lo tanto si tienenrelaciones sexuales deben realizar algún método de contracepción.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 352
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
En las pacientes anovuladoras con deseos de gestación las opciones pasan por
la administración de fármacos inductores de la ovulación. Es recomendable
esperar un período prudencial (alrededor de 12 meses) ya que hasta un 50% de
estas pacientes quedarán gestantes de forma espontánea. No se debe comenzar
ninguna modalidad de tratamiento sin que se hayan descartado otros factores de
esterilidad, aunque no será necesario un estudio exhaustivo. El bajo coste, la
comodidad y la sencillez son razones más que convincentes para que el
tratamiento de elección sea el Citrato de Clomifeno. La segunda opción consiste
en la administración de gonadotrofinas. En la actualidad se consideran de buena
práctica clínica la aplicación pautas lentas bajo monitorización ecográfica del
crecimiento folicular. Cuando no exista respuesta una opción válida consiste en
la multipunción ovárica por vía laparoscópica o vía transvaginal. También
deberán considerarse la administración concomitante de análogos de la GnRH o
la inclusión en un programa de fertilización in vitro. En ningún de los casos
estará indicado realizar una resección cuneiforme de los ovarios por vía
Para finalizar, en pacientes obesas de ambos grupos debería estimularse la
reducción de peso. Se ha demostrado, aunque no se consiga un peso ideal, que
la reducción de un 5-10% del IMC comporta en algunos casos la remisión del
cuadro y en otros una mejor respuesta al tratamiento elegido. Una opción en
estudio es que junto a una dieta hipocalórica se administren fármacos que
aumenten la sensibilidad periférica a la insulina como la Metformina o la
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 353
Acbay O., Gundogdu S. Can metformin reduce insulin resistance in polycystic ovary syndrome ?Fertil Steril, 65: 946-9, 1996.
Accili D., Frapier C., Mosthaf L. y cols. A mutation in the insulin receptor gene that impairs transportof the receptor to the plasme membrane and causes insulin-resistant diabetes. EMBO J, 8: 2509, 1989.
Andersen P., Seljeflot I., Abdelnoor M., Arnensen H., Dale P.O. y cols. Increased insulin sensivity andfibrinolytic capacity after dietary intenention in obese women with polycystic ovary syndrome.
Metabolism, 44: 611-6, 1995.
Bachmann GA. Polyeystic ovary syndrome: metabolic chllenges and new treatment options. Am JObstet Gynecol, S87-8, 1998.
Balen A. Hipersecreción de LH en mujeres con ovarios poliquísticos: efectos y mecanismos. CuadMed Reprod, 4: 75-100, 1998.
Balen A. Pathogenesis of polyeystic ovary syndrome -the enigma unravels?. Lancet, 354: 966-7, 1999.
Barnes R., Rosenfield RL. The polyeystic ovary syndrome: Pathogenesis and treatment. Ann Int Med,110: 386-399, 1989.
Barnes RB., Rosenfield RL., Burstein S., Ehermann DA. Pituitary-ovarian responses togonadotropinreleasing hormone agonist testing in polycystic ovary syndrome. N Engl J Med, 320:559-65, 1989.
Bergman RN., Finegood DT., Ader M. Assesment of insulin sensivity in vivo. Endocr Rev, 6: 45,1985.
Bergman RN., Ider YZ., Bowden CR., Cobelli C. Quantitative stimation of insulin sensivity. Am JPhysiol, 236: E667, 1979.
Björntorp P. Hyperandrogenicity and insulin resistance as predictors for non-insulin-dependentdiabetes mellitus in women. In: Alberti KGMM, Mazze R, eds. Frontiers of diabetes research: currenttrends in non-insulin-dependent diabetes menitus. Elsevier Science Publishers BV, 4: 61-70, 1989.
Björntorp P. The android woman- a risky condition. J Int Med, 239: 105-10, 1996.
Buckett WM., Tan SL. Use of luteinizing hormone releasing hormone agonists in polycystic ovarysyndrome. Bainieres Clin Endocrinol Metab, 12: 593-606, 1998.
Burghen GA., Givens RJ., Kibatchi AE. Correlation of hyperandrogenism with hyperinsulinism withhyperinsulinism in polycystic ovarian disease. J Clin Endocrinol Metab, 50: 113-6, 1980.
Buttram V., Vazquez C. Post ovarian wedge resection and adhesive disease. Fertil Steril, 26: 874-6,1975.
Calaf J., Rodríguez-Espinosa J., Cabero A., Lenti Q., Mora J., Esteban-Altirriba J. Effects ofcyproteronecontaining oral contraceptive on hormonal levels in polycystic ovarian disease. ObstetGynecol, 69: 255-8, 1987.
Cannina E., Lobo RA. Polyeystic ovary syndrome: arguably the most common endocrinopathy isassociated with significant morbidity in women. J Clin Endocrinol Metab, 84: 1897-9, 1999.
Carey AH., Chan KL., Shon F., White DM., Wiliamson R., Franks S. Evidence for a single gene deflectcausing polycystic ovaries and male pattern baldlless. Clin Endocrinol (Oxf), 38: 653-8, 1993.
Carey AH., Waterworth D., Patel K. y cols. Polyeystic ovaries and premature male pattern balness areassociated with one allele of the steroid metabolism gene cyp17. Hum Mol Gent, 3: 1873-6, 1994.
Chang RJ., Katz SE. Diagnosis of polycystic ovary syndrome. Endocrinol Metab Clin North Am, 28:397-408, 1999.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 354
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Ciotta L., Cianci A., Calogero AE. y cols. Clinical auld endocrine effects Or finasteride, a 5alphareductase inhibitor, in women with idiopathic hirsutism. Fertil Steril, 64: 299-306, 1995.
Ciotta L., Cianci A., Marletta E. y cols. Treatment of hirsutism with flutamide and a low-dosage oralcontraceptive in polyeystic ovarian disease pacients. Fertil Steril, 62: 1129-35, 1994.
Clifford K., Ray R., Watson H. y cols. Does supressing luteinizing hormone secretion reduce themiscarriage rate? Results of a randomised controlled trial. Br Med J, 312: 1508-11, 1996.
Coelingh Bennink HJT., Fauser B., Out HJ. Recombinant follicle-stimulating hormone (FSH,Puregon) is more efficient than urinary FSH (Metrodin) in women with clomiphene citrate-resistant,normogonadotropic, chronic ano ulation: a prospective, multicenter, assesor-blind, randomized,clinical trial. Fertil Steril, 69: 19-25, 1998.
Colacurci N., Zullo F., De Franciscis P. y cols. In vitro fertilization following laparoscopic ovariandiathermy in patients with polycystic ovary syndrome. Acta Obstet Gynecol Scand, 76: 555-8, 1997.
Colston A., Herbert III CM., Hill A. y cols. Diagnosis and treatment of hirsutism. In: Collins N, ed.
Gynecologic Endocrinology and Infertility. Williams & Wilkins, Baltimore, USA, 68-83, 1988.
Coulam CB., Annegers JF., Kranz JS. Chronic anovulation syndrome and associated neoplasia. ObstetGynecol, 61: 403-7, 1983.
Crave JC., Fimbel S., Lejeune H., Cugnardey N., Dechaud H., Pugeat M. Effects of diet and metforminadministration on sex hormone-binding globulin, androgens, and insulin in hirsute and obesewomen. J Clin Endocrino Metab, 80: 2057-62, 1995.
Cusan L., Dupont A., Gómez JL., Tramblay RR., Labrie F. Comparison of flutamide and spironolactonein the treatment of hirsutism: a randomized controned trial. Fertil Steril, 61: 281-7, 1994.
Dahlgren E., Janson PO., Johansson L. y cols. Polycystic ovary syndrome and risk for myocardialinfarction. Acta Obstet Gyn Scand, 71: 599-604, 1992.
Dahlgren E., Johansson S., Lindstedt G. y cols. Women with polycystic ovary syndrome wedgeresected in 1956 to 1965: a long term follow-up focusing on natural history and circulating hormones.
Fertil Steril, 57: 505-13, 1992.
Davison RM. New approaches to insulin resistance in polycystic ovarian syndrome. Curr Opin ObstetGynecol, 10: 193-8, 1998.
De Fronzo RA., Tobin JD., Andres R. Glucose clamp thecnique: a method for quantifying insulinsecretion andresistance. Am J Physiol, 237: E214, 1979.
Deroubaix-Allard D., Cortet-Rudelli C., Duhamel A. y cols. Abdominal adipose tisue is the mainanthropromctric detemlhlant of women's gonadal function. Proceedings of the 10th IntenutionalCongress of Endocrinology. San Francisco. USA. June 12th-15th. 1: P2-621.
Dewailly D. Definition and significance of polyeystic ovaries. Baillieres Clin Obstet Gynceol, 11: 349-68, 1997.
Diamallti-Kandarakis E., Dunaif A. New perspectives in polycystic ovary syndrome. TrendsEndocrinol Metab, 7: 267-71, 1996.
Dunaif A., Givens JR., Haseltine FP., Merriam GR. Current issues in endocrinology and metabolism:polycystic ovariy syndrome. Boston: Blacwell Scientific, 1992.
Dunaif A., Scott D., Finegood D., Ouintana B., Whitcomb R. The insulin-sensitizing agenttroglitazone improves metabolic and reproductive abnormalhies in the polycystic ovary syndrome.
J Clin Endocrinol Metab, 81: 3299-306, 1996.
Dunaif A., Xia J., Book CB., Schenker E., Tang Z. Excesive insulin receptor serine phosphorylationin cultured fibroblasts and in skeletal muscle. J Clin Invest, 96: 801-810, 1995.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 355
Dunaif A. Insulin action in the polycystic ovary syndrome. Endocrinol Metab Clin North Am, 28:341-59, 1999.
Ehrmann DA., Barnes RB., Rosenfield RL., Cavaghan MK., Imperial J. Prevalence of impaired glucosetolerance and diabetes in women with polycystic ovary syndrome. Diabetes Care, 22: 141-6, 1999.
Ehrmann DA., Barnes RB., Rosenfield RL. Polyeystic ovary syndrome as a form of ovarianhyperandrogenism due to dysregulation of androgen secretion. End Rev, 16: 322-53, 1995.
Ehrmann DA., Rosenfield RL., Barnes RB., Brigell DF., Sheikh Z. Detection of functional ovarianhyperandrogenism in women with androgen excess. N Engl Med, 327: 157-62, 1992.
Ehrmann DA., Schneider DJ., Sobel BE. y cols. Troglitazone improves defeets in insulin action,insulin secretion, ovarian steroidogenesis, and fibrinolysis in women with polycystic o arysyndrome. J Clin Endocrinol Metab, 82: 2108-16, 1997.
Ehrmann DA. Insulin-lowering therapeutic modalities for polycystic ovary syndrome. EndocrinolMetab Clin North Am, 28: 423-38, 1999.
Erenus M., Gurbuz O., Durmusoglu F. y cols. Comparison of efficacy of spironolactona versusflutamide in the treatment of hirsutism. Fertil Seril, 61: 613-6, 1994.
Espinos JJ., Calaf J. Hiperandrogenismo, hiperinsulinismo e insulinoresistencia en el síndrome deovarios poliquísticos. Cuad Med Reprod, 2: 29 18, 1996.
Espinós JJ., Calaf J. Hiperandrogenismo, hiperinsulinismo e insulinoresistencia en el síndrome deovarios poliquísticos. En: Pellicer A, Simón C (eds). Cuadernos de medicina reproductiva. Madrid:Editorial Médica Panamericana, 29-48, 1995.
Espinós JJ., Rodríguez-Espinosa J., Casamitjana R., Corcoy R., Webb S., Calaf J. Respuestaandrogénica al hiperinsulinismo agudo inducido por glucosa en pacientes con síndrome de ovariopoliquístico. Clin Invest Gin Obst, 25: 305-12, 1998.
Espinós JJ., Rodríguez-Espinosa J., Webb S., Calaf J. Concentraciones de insulina y andrógenos enpacientes con síndrome de ovario poliquístico. Clin Invest Gin Obst , 25: 166-72, 1998.
Espinós JJ. Aspectos metabólicos del síndrome de ovarios poliquísticos. Endocrinología, 42: 226-30,1995.
Farhi J., Soules S., Jacobs HS. Effect of laparoscopic ovarian electrocautery on ovarian response andoutcome of treatment with gonadotropins in clomipllene citrate-resistant patients with polycysticovary syndrome. Fertil Steril, 64: 930-5, 1995.
Ferrirnan D., Gallwey JD. Clinical assesment of body hair grov th in women. J Clin Endocrinol Metab,21: 1440-47, 1961.
Fherman AI., Brown S. The precursors of endometrial carcinoma. Am J Obstet Gynecol, 135: 947-956,1979.
Fisher PM., Sutherland HW., Bewsher PD. The insulin response to glucosa infusion in gestationaldiabetes. Diabetologia, 19: 10, 1980.
Flier JS., Eastman RC., Minaker KL., Maneson D., Rowe JW. Acanthosis nigrican in obese womenwhith hyperandrogenism. Characterization of an insulin-resistant state distinct from type A and Bsyndromes. Diabetes, 34: 101-7, 1985.
Flier JS., Kahn CR., Roth J. Receptors, antireceptors antibodies and mechanisms of insulinresistance. N Engl J Med, 300: 413, 1979.
Fluker MR. Síndrome de los poliquísticos: la inducción de la ovulación con citrato de clomifeno.
Cuad MedReprod, 4: 2151-62, 1998.
Franks S., Gharani N., Gilling-Smith C. Polycystic ovary syndrome: evidence for a primarydisorder of ovarian steroidogenesis. J Steroid Biochem Mol Biol, 69: 269-72, 1999.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 356
MANUAL DE SALUD REPRODUCTIVA EN LA ADOLESCENCIA
Franks S., White D., Gilling-Smitll C., Carey A., Waterworth D., Williamson R. Hypersecretion ofandrogens by polycystic ovaries: the role of genetic factors in the regmation of cytochrome P450c17alpha. Baillieres Clin Endocrinol Metab , 10: 193-203, 1996.
Franks S. Factores genéticos en la etiología del sindrome de los ovarios poliquísticos. Cuad MedReprod, 4: 45-58, 1998.
Franks S. Polycystic ovary syndrome. N Engl J Med, 333: 853-61, 1995.
Franks S. Polycysticovary syndrome: achangingperspective. Clin Endocrinol, 31: 82-120, 1989.
Fruzzetti F., De Lorenzo D., Parini D., Ricci C. Effects of finasteride, a 5αreductase inhibitor, oncirculating androgens and gonadotropin secretrion in hirsute women. J Clin Endocrinol metab, 79:831-5, 1994.
Frutzzetti F., De Lorenzo D., Ricci C., Fiorett P. Clinical and endocrine effects of flutamide inhyperandrogenic women. Fertil Steril, 60: 806-13, 1993.
Fulghesu AM., Lanzone A., Andreani CL., Pierro E., Caruso E., Mancuso S. Effectiveness of asomatostatin analogue in lowering luteinizing hormone and insulin-stimulated secrelion inhyperinsulinemic women with polycystic ovary disease. Fertil Steril, 64: 703-8, 1995.
Gadir AA., Khatim M., Mowarfi RS., Alnaser HMI., Alzaid HG., Shaw RW. Polycystic ovaries: dorepresent a specific endocrinopathy? Br J Obstet Gynaecol, 98: 300-5, 1991.
Gaitán P., Navarro J., Remohi J., Simón C., Pellicer A. La fecundación in vitro en pacientes conovarios poliquísticos. Cuad Med Reprod, 4: 204-28, 1998.
Gharani N., Waterworth DM., Williamson R., Franks S. 5' polymorfism of the cyp 17 gene is notassociated with serum testosterone levels in women with polycystic ovaries. J Clin Endocrinol Metab,81: 4174, 1996.
Gilling-Smith C., Willis DS., Beard RW., Franks S. Hypersecretion of androstenodione by isolatedtheca cells from polycystic ovaries. J Clin Endocrinol Metab, 79: 1158-65, 1994.
Gómez JL., Dupont A., Cusan L. y cols. Incidence of liver toxicity associated with the use of flutamidein prostate cancer patients. Am J Med, 92: 465-70, 1992.
Grainger DA. Hyperandrogenism and hyperinsulinsm: cause and effect, or unrelated association. SemReprodEndocrinol, 12: 124-35, 1994.
Greenblatt EM., Casper RF. Endocrine changes after laparoscopic ovarian cautery in polycysticovarian syndrome. Am J Obstet Gynecol, 156: 279-85, 1987.
Gurgan T., Hisnisci H., Yarali H., Develiogen O., Zeynelogen H., Aksu T. Evaluation of adhessionformation after laparoscopic treatment of polycystic ovarian disease. Ferlil Steril, 56: 1176-8, 1991.
Guzick D. Polycystic ovary syndrome: symptomatology, pathophysiology, and epidemiology. Am JObstet Gynecol, S89-S93, 1998.
Hague WM., Admns J., Reeders ST., Peto TE., Jacobs HS. Familial polyeystic ovaries: a genetic di-sease? Clin Endocrinol, 29: 593-605, 1988.
Hamilton-Farley D., Fhnks S. Common problems in induction of ovulation. Baillieres Clin ObstetGynecol, 4: 609-25, 1990.
Hammerstein J., Meckies J., Leo-Rossberg y cols. Use of cyproterone acetate (CPA) in the treatmentof acne, hirsutism and virilism. J Steroid Biochem, 6: 827, 1975.
Harlass FE., Plymate SR., Fariss BL., Belts RP. Weight loss is associated with correction ongonadotropin and sex steroid abnormalities in the obese anovulatory female. Fertil Steril, 42: 649-52, 1984.
Herbert Wiebe. Androgenology in women. In: Speroff L, ed. Sem Reprod Endocrinol. Thieme Inc,New York, 2: 77-221, 1986.
Salud reproductiva.qxd 9/10/2002 12:47 PM Page 357
Holte J., Bergh T. Berne C., Wide L., Lithell H. Restored insulin sensivity but persistently early insulinsecretion after weight loss in obese women whith polyeyslic ovary syndrome. J Clin EndocrinolMetab, 80: 2586-93, 1995.
Holte J. Disturbances in insulin secretion and sensivity in women with the polycystic ovarysyndrome. Baillieres ClinEndocrinol Metab, 10: 221-47, 1996.
Homburg R. Polycystic ovary syndrome –from gynaecological curiosity to multisystemendocrinopathy. Hum Reprod, 11: 29-39, 1996.
Homburg R. Síndrome de los ovarios poliquísticos: consenso y controversia. Cuad Med Reprod, 4:13-21, 1998.
Ibáñez L., Potau N., Virdis R. y cols. Postpubertal outcome in girls diagnosed of premature pubarcheduring chilhood: increased frequency of functional ovarian hyperandrogenism. J Clin EndocrinolMetab, 76: 1599-603, 1993.
Insler V., Lunenfeld B. Pathophysiology of polyeystic ovarian disease: new insights. Hum Reprod ,8: 1025-9, 1991.
Jacobs HS. Tratamiento quirúrgico del síndrome de ovarios poliquísticos. Cuad Med Reprod, 4: 229-37, 1998.
Kadowaki T., Kadowaki H., Rechler MM. y cols. Five mutant alleles of the insulin receptor gene inpatients with genetic forms of insulin resistance. J Clin Invest, 86: 254, 1990.
Kiddy DS., Hamilton-Fairley D., Bush A., Short F., Anyaoku V. y cols. Improvement in endocrine andovarian function during dietary treatment of obese women witll polycystic ovary syndrome. ClinEndocrinol, 36: 105-111, 1992.
Kusari J., Takata Y., Hatada E. y cols. Insulin resistance and diabetes due to different mutations inthe tyrosine kinase domain of both insuline receptor alleles. J Biol Chem, 266: 5260, 1991.
Legro RS. Polycystic ovary syndrome: current anf future treatment paradigms. Am J ObstetGynecol, S8101-S108, 1998.
Legro RS. Polycystic ovary syndrome: phenotipe to genotype. Endocrinol Metab Clin North Am, 28:379-96, 1999.
Legro RS. The genetics of polyeystic ovary syndrome. Am J Hum Genet, 58: 1347-63, 1996.
Loy R., Seibel M.M. Evaluation and therapy of polycystic ovarian syndrome. Endocrinol Metab ClinN Am, 17: 785-813, 1988.
Lubin V., Charbonnel B., Bouchard P. The use of gonadotropin-releasing hormone antagonist inpolycystic ovarian disease. Baillieres Clin Endocrinol Metab, 12: 607-16, 1998.
Lucky AW., Rosenfield RL., McGuire J., Rudy S., Helke J. Adrenal androgen hyperresponsiveness toACTH in women vvith acne and/or hirsutism: adrenal enzyme defects and exaggerated adrenarche.
J Clin Endocrinol Metab, 62: 840-48, 1986.
Lunde O., Magnus P., Sandik L., Hoglo S. Familial clustering in the polycystic ovarian syndrome:Gynecol Pbstet Invest, 28: 23-30, 1989.
Matias Guiu X., Prat J. Anatomía patológica de los estados hiperandrogénicos. Cuad Med Reprod, 2:61-75, 1996.
McComb OP. Infertility surgery: operative endoscopy, new instruments and techniques. Clin ObstetGynecol, 32: 564-75, 1989.
Mckelgue P. Are women witll polyeystic ovary syndrome at special risk for coronary heatt disease?Clin Endocrinol, 37: 117-118, 1992.
Misbin AM., Moffa AM., Kappy M. Insulin binding to monocytes in obese patients treated withcarbohydrate restriction and changes in physical activity. J Clin Endocrinol Metab, 56: 273-7, 1983.
Source: http://ccp.ucr.ac.cr/bvp/pdf/manual/saludreproductiva/10%20Salud%20reproductiva%20e.pdf
Des soins de qualité pour tous personnes âgées 16 études Edition 2002 Directeur de la publication : Daniel LENOIR Caisse Nationale de l'Assurance Maladie des Travailleurs Salariés 66, Avenue du Maine 75684 Paris Cedex 14 La qualité au service de tous Conformément à sa mission de concourir à l'amélioration de la qualité
September Calendar of events Would you like to promote events or new publications of your organisation in health highlights? Please send us your contributions! 6 October 2010: Alcolock seminar in the European parliament (Brussels, 6-9 October 2010: 13th European Health Forum (Gastein, Austria)



