Levitra enthält Vardenafil, das eine kürzere Wirkdauer als Tadalafil hat, dafür aber schnell einsetzt. Männer, die diskret bestellen möchten, suchen häufig nach levitra kaufen ohne rezept. Dabei spielt die rechtliche Lage in der Schweiz eine wichtige Rolle.
Ridaa.unicen.edu.ar2

Facultad de Ciencias Veterinarias
-UNCPBA-
Actualización sobre las bases terapéuticas para
la Peritonitis Infecciosa Felina (PIF) y
presentación de tres casos clínicos de PIF
tratados con Talidomida.
Alarcón, Gabriela Verónica; Paludi, Alejandro Esteban; Nejamkin, Pablo.
Mayo, 2016
Realizar una revisión actual de las distintas terapéuticas,
haciendo hincapié en la efectividad de las mismas y presentar
los resultados de tres casos clínicos distintos de PIF tratados
con una alternativa farmacológica inmunomoduladora, la
Talidomida.
Tesina de la Orientación Sanidad en Pequeños Animales, presentada como parte de los requisitos para optar al grado de Veterinario del estudiante: Alarcón, Gabriela Verónica.
Tutor: Médico Veterinario, Paludi, Alejandro Esteban.
Director: Médico Veterinario, Nejamkin, Pablo.
Evaluador: Médico Veterinario, Sanchez Bruni, Sergio
La Peritonitis Infecciosa Felina es una enfermedad causada por el Coronavirus Felino, que se caracteriza por ser altamente letal, inmunomediada, de distribución mundial con una prevalencia menor al 5%. Su etiopatogenia es compleja, el diagnóstico es presuntivo debido a la falta de análisis confirmatorios hasta el post-mortem. Hasta el momento ninguna vacuna ha resultado ser efectiva, y ningún tratamiento ha probado ser eficiente en la clínica. En la siguiente revisión se destacaran las terapéuticas actuales utilizadas en la clínica y su efectividad; conjuntamente al análisis de tres casos clínicos tratados con una alternativa terapéutica, la Talidomida, una droga inmunomoduladora. Observándose diferentes resultados en los pacientes tratados, que pueden deberse a las distintas presentaciones de la enfermedad, estado inmune del paciente, agresividad del patógeno, período de administración del fármaco, entre otros factores. Debemos contar con futuras investigaciones y recolección de datos para confirmar o descartar la efectividad de esta alternativa terapéutica.
Palabras clave: Peritonitis Infecciosa, gato, tratamiento, Talidomida.
1.6 Vacunas y control………………………………………………….pág.6
1.7.2 Drogas anti-inflamatorias e inmunosupresoras….…….pág.8
1.7.3 Drogas anti-inflamatorias e inmunomoduladoras…….pág.9
1.7.4 Drogas inmunoestimulantes no específicas……….pág.10
1.7.5 Fármacos de Apoyo…………………………….…….pág.10
1.7.6 Tratamientos de Sostén……………………….….….pág.11
2. Descripción del caso………………………………………………….pág.11
2.1 Caso Clínico 1………………………………………………………pág.11
2.1.1 Reseña del animal………………………………………….pág.11
2.2 Caso Clínico 2 …………………………………………………….pág.19
2.2.1 Reseña del animal………………………………………….pág.19
2.3 Caso Clínico 3.…………………………………………………….pág.23
2.3.1 Reseña del animal………………………………………….pág.23
1. INTRODUCCIÓN
La Peritonitis Infecciosa Felina (PIF) es una patología de origen viral
ampliamente descripta desde la década de 1960, cuya etiopatogenia es
compleja, su diagnóstico difícil y de muy mal pronóstico (Paludi Alejandro E. y
col.2004, Diane D. Addie y col.2008). La PIF es una enfermedad causada por
el Coronavirus Felino (CoVFe) que se caracteriza por ser altamente letal, con
un comportamiento bimodal, que afecta a gatos adultos jóvenes (6 meses - 2
años) y mayores de los 10 años de edad, presentando una mayor prevalencia
en la primer curva. Posee una distribución mundial, con una prevalencia menor
al 5%, siendo así una de las enfermedades infecciosas más importantes de la
Medicina Felina.
No se ha demostrado una predisposición racial en la presentación de PIF, pero
sí existe una mayor incidencia en determinadas líneas genéticas y sus cruzas
(Sagrado de Birmania, Siamés, Persa, Bengalí, Bosque de Noruega, Scottish
fold, Maine Coon, Ragdoll y British Shorthairs) asociado a una mayor
susceptibilidad debido al bajo polimorfismo genético de los genes del Factor de
Necrosis Tumoral –α (FNT-α), Interferon-γ y moléculas de adhesión (Paludi
Alejandro E. y col. 2004; T. Soma y col. 2013; Ying-Ting Wang y col. 2014; Li-
En Hsieh y col. 2014).
La PIF tiene como característica desarrollarse tras la mutación del Coronavirus
en individuos con predisposición a padecer esta enfermedad. Debido al
comportamiento viral, las vacunas no son eficaces, y no existen aún métodos
confiables para el diagnóstico definitivo in vivo, por lo tanto, debemos
interpretarlos parámetros clínicos y sanguíneos, considerando al porcentaje
susceptible de la población para inferir que estamos ante la presencia de esta
enfermedad. Si bien esta infección tiene muchos espectros de presentación,
en muchos casos los signos son típicos y con una cronología bastante
Los tratamientos convencionales incluyen antiinflamatorios corticoides como la
prednisolona, en conjunto con o sin agentes inmunosupresores como la
ciclofosfamida, y/o drogas antivirales. Además se debe incluir la terapia de
apoyo que incluye: complejos vitamínicos, inmunoestimulantes no específicos,
antibióticos para prevenir y/o tratar infecciones bacterianas secundarias,
antiinflamatorios AINE´S, internación, drenaje intermitente de cavidades en los
casos de colectas, fluidoterapia, etc. Hasta la fecha no se ha reportado ninguna
cura efectiva para la enfermedad, en el mejor de los casos se logra la remisión
temporal de la sintomatología y prolongar la supervivencia del animal, como así
también mejorar su calidad de vida.
1.1. VIROLOGÍA
El Coronavirus felino (CoVFe) pertenece al orden Nidovirales y a la familia
Coronaviridae, son grandes virus ARN envueltos, de cadena simple positiva,
con un amplio espectro de virulencia, aunque antigénicamente similares. El
Coronavirus felino varía de cepas apatógenas hasta cepas que causan una
enteritis (CoVE) y algunas de ellas que mutan en el gato y causan peritonitis
pleuritis infecciosa felina (CoPPIF). Muchos factores ayudan a que éste virus
entérico mute, entre ellos: número de gatos en la vivienda, estrés, edad,
compromiso inmunológico, factores genéticos, inmunidad a los coronavirus,
etc. (Diane D. Addie y col. 2008; Paludi Alejandro E. y col. 2004).
1. 2 TRANSMISIÓN
La transmisión es principalmente indirecta, al tener contacto con las heces y
fómites contaminados, mediante la ingestión y posiblemente inhalación del
virus, aunque está documentada la transmisión transplacentaria es
extremadamente poco común. El 13% de los gatos infectados en forma natural
se convierten en portadores de por vida, liberando continuamente la misma
cepa de virus por la materia fecal, aunque rara vez desarrollan PIF. El estrés
provoca un incremento en la liberación del virus (Couto C. Guillermo y col.
2000; Diane D. Addie y col. 2008; Paludi Alejandro E. y col. 2004).
1. 3 PATOGENIA
Después de la ingestión del virus, éste llega al intestino delgado y se adhiere al
borde de cepillo intestinal. Se introduce en el enterocito, se multiplica en el
citoplasma provocando la muerte celular, liberando más partículas virales, las
cuales infectan a enterocitos vecinos continuando el ciclo hasta que se monta
una respuesta inmune, generalmente local, dando signología clínica de
enteritis. El virus se libera en la materia fecal desde el segundo día post
infección, en infección temprana es posible que el virus se replique en las
amígdalas y orofaringe, y se libere en la saliva durante apenas algunas horas o
días (Couto C. Guillermo y col. 2000; Diane D. Addie y col. 2008; Paludi
Alejandro E. y col. 2004).
Las células blanco para el CoVE son los enterocitos y la patología se limita sólo
al intestino, en cambio, para el CoPPIF las células blanco son los macrófagos,
convirtiéndose así en una enfermedad sistémica. Se sabe que es una
enfermedad inmunomediada que involucra al virus o antígenos virales,
anticuerpos antivirales y complemento, debido a que se encontró la presencia
de complejos inmunológicos circulantes en gatos con PIF, los gatos que no
tienen anticuerpos anti-CoVFe no desarrollan PIF (cuadro 1). Generalmente se
asume que una respuesta exitosa de la respuesta inmune mediada por células
(RIMC) resulta protectora contra el PIF, en cambio una respuesta humoral es
dañina, esto se debe al refuerzo de la infectividad viral dependiente de
anticuerpo, en la cual los macrófagos son infectados con mayor eficiencia por
el virus en complejos con el anticuerpo que con el virus solitario (Couto C.
Guillermo y col.2000; Paludi Alejandro E. y col.2004; Diane D. Addie y
col.2008).
Reacción inflamatoria local
Genes 3c, 7b y proteína S
Macrófagos locales (MUTACIÓN)
Monocitos (virus madura y se multiplica)
Interleuquina 1, TNF-α y
Adhesinas (CD11a, CD18)
Adhesión del monocito, diapédesis
y disrupción de los vasos
Linfocitos auxiliares
Antígeno + Anticuerpo
(Hipersensibilidad tipo III)
Macrófagos activados
(multiplicación viral)
Células B y Anticuerpos
Interleuquina 6 y +CD40
Células B y Anticuerpos
Macrófagos, Linfocitos y Neutrófilos
Cuadro 1 – Patogénesis de PIF
1. 4 SIGNOS CLÍNICOS
Los gatos con PIF con frecuencia presentan en forma inicial signos no
específicos ni localizables, como fiebre, anorexia, inactividad, pérdida de peso,
vómitos, diarrea, deshidratación y palidez (anemia). La fiebre crónica fluctuante
que no responde a los antibióticos es el signo temprano más frecuente de PIF.
(Robert G. Sherding 1996)
Los signos clínicos y patológicos que ocurren en la PIF son consecuencias
directas de la vasculitis y lesión de los órganos por el daño de los vasos
sanguíneos que los irrigan. En la PIF efusiva, muchos vasos sanguíneos se
ven afectados, por lo que surgen la exudación de proteínas plasmáticas y fluido
a las cavidades corporales; caracterizada por derrame de líquido proteico
dentro de la cavidad peritoneal, espacio pleural, y también en espacios
virtuales como pericardio, escroto y cavidad subcapsular de los riñones. En la
forma no efusiva, la presentación clínica depende de que órgano se encuentren
dañados por los piogranulomas. Las lesiones piogranulomatosas o
granulomatosas se desarrollan en múltiples tejidos, sobre todo en ojos,
encéfalo, riñones e hígado (Robert G. Sherding 1996; Couto C. Guillermo y col.
2000; Paludi Alejandro E. y col.2004; Diane D. Addie y col. 2008).
1. 5 DIAGNÓSTICO
Es una enfermedad de difícil diagnostico por no existir un examen específico
para ello, deben tomarse en cuenta los signos clínicos que manifiesta el animal,
una anamnesis completa y análisis complementarios para poder orientarnos al
correcto diagnóstico (Paludi Alejandro E. y col.2004).
En el caso de PIF húmeda la abdominocentesis y/o toracocentesis es de gran
utilidad, el líquido suele ser característico de color claro amarillento, gelatinoso,
viscoso, con un alto contenido proteico (>3,5 mg/dl), alta densidad (1,017-
1,047) y variable contenido celular (1.600-25.000/μl), aunque suele ser bajo,
predominando los neutrófilos y macrófagos (Robert G. Sherding 1996; Couto C.
Guillermo y col.2000; Paludi Alejandro E. y col.2004; Diane D. Addie y
col.2008).
Los análisis complementarios que deben considerarse son:
Hemograma: leucocitosis por neutrofilia con linfocitos normales o
disminuidos, también se puede encontrar leucopenia y linfopenia
(características de la fase terminal de la enfermedad),anemia
normocítica normocrómica moderada y bajo recuento plaquetario;
Proteínas plasmáticas: superiores al 7,8 g/dl, la hiperglobulinemia suele
ser indicativo de PIF, aunque no patognomónico. La relación
Albumina/Globulina (A/G) estará disminuida, será menor a 0,4%;
Análisis del líquido cerebroespinal: elevada concentración proteínica (56-
348 mg/dl, siendo normal 25 mg/dl) y aumento de leucocitos con
predominio de neutrófilos;
Perfil bioquímico (dependiente de los órganos afectados): elevación de
ALT, FAS, hiperbilirrubinemia, azotemia;
Análisis de orina: proteinuria en el caso de afección renal;
Pruebas serológicas: pruebas de ELISA y seroneutralización, sólo
indican que el animal estuvo en contacto con algún coronavirus, no es
indicativo de PIF;
PCR: indica el contacto del animal con algún coronavirus;
Inmunohistológico: la muestra se puede obtener ante mortem por biopsia
o post mortem en la necropsia, la lesión esencial de PIF es el
Para diagnosticar PIF definitivamente, debe demostrarse vasculitis. Para
demostrar la presencia del virus en las lesiones, la inmunohistoquímica es el
estandarte de oro absoluto (Robert G. Sherding 1996; Couto C. Guillermo y
col.2000; Paludi Alejandro E. y col.2004; Diane D. Addie y col.2008).
1. 6 VACUNAS Y CONTROL
El realce o mejoramiento dependiente de anticuerpo (MDA) es un fenómeno
que frustro muchos intentos de encontrar una vacuna exitosa para PIF, ya que
según este mecanismo, el anticuerpo facilitaría la captación de CoVFe por los
macrófagos. Está disponible una cepa coronaviral mutante de administración
intranasal –indicada para gatos seronegativos con riesgo a exposición- que
induce una respuesta inmune de mucosa, pero no una respuesta sistémica,
con lo cual no parece tener efecto sobre el MDA (Robert G. Sherding 1996;
Couto C. Guillermo y col.2000; Dianne D. Addie y col.2008).
Se han realizado varios estudios para tomar medidas preventivas tanto en
criaderos, como así también en refugios, en donde se observa la mayor
cantidad de pacientes con esta enfermedad. Las medidas incluyen el
aislamiento de la madre y los gatitos del resto de la población, evitar el estrés
del hacinamiento, limitar el movimiento dentro y fuera del criadero/refugio,
aislar a los gatos que ingresan o retornan a la colonia, uso de desinfectantes,
control de otras enfermedades (VIF/VILEF), programas genéticos. Respecto a
éste último punto, gracias a los ensayos genéticos de los últimos años, se han
logrado determinar varios genes que interfieren tanto en la predisposición a
padecer la enfermedad, como así también a resistirla, mayores investigaciones
nos posibilitarían poder realizar mejoras en los programas genéticos de los
criaderos que resulten en gatos más resistentes a padecer PIF.
1. 7.TRATAMIENTO
Varios enfoques han sido usados para tratar gatos con PIF, uno de los métodos
es usar drogas que específicamente inhiban la replicación viral, un segundo
enfoque es inhibir aspectos claves de la respuesta inflamatoria con sustancias
como el Interferon (INF), y un tercer enfoque es estimular el sistema inmune
no-especifico con la esperanza de que sea capaz de superar la infección. El
segundo enfoque rara vez funciona independientemente, pero ha sido exitoso
cuando se combina con drogas anti-virales específicas. El tratamiento óptimo
de la PIF combinaría la eliminación del virus con supresión de la función del
linfocito B y estimulación de la función del linfocito T (Couto C. Guillermo y
col.2000; Niels C. Pedersen 2014).
1. 7. 1. DROGAS ANTIVIRALES
Recientemente, varios agentes antivirales contra Coronavirus fueron
identificados, incluyendo agentes de unión a carbohidratos, inhibidores de la
proteasa del HIV, fármacos antisépticos, compuestos de antraquinona, análogo
de nucleósido, óxido nítrico, inhibidores de catepsina, siRNA y un subtipo de
Interferon, que pueden ser utilizados en la terapéutica contra PIF. (Li-En Hsieha
y col.2010)
El Ribavirin, ha demostrado inhibir el crecimiento de FeCoV in vitro, aun así los
efectos secundarios han dificultado su aplicación clínica, se han utilizado
diversas dosis y en combinación con Interferon-α2b, pero ninguna tuvo efectos
eficaces in vivo. La Cloroquina, Mefloquina y Amilorida hexametileno
demostraron un marcado efecto inhibitorio sobre la replicación in vitro de
FeCoV. La Cloroquina ha sido testeada en infecciones de PIF experimentales
en donde los pacientes tratados mostraron mejorías comparados con los que
recibieron placebos, sin embargo, no hubo ninguna diferencia estadística
significativa en el tiempo de supervivencia entre ambos grupos de animales
(Couto C Guillermo y col. 2000; Katrin Hartmann y col. 2008; Els Keyaerts y
col.2009; Li-En Hsieha y col. 2010; Darryl Falzarano y col. 2013; Niels C.
Pedersen 2014; Philip McDonagh y col.2014).
1. 7. 2. DROGAS ANTIINFLAMATORIAS E INMUNOSUPRESORAS
Como una parte importante de la enfermedad es el resultado de reacciones
inmunomediadas contra el virus, la modulación de la respuesta inflamatoria es
una forma de terapia importante. Generalmente se incluyen glucocorticoides
con o sin otros agentes inmunosupresores como ciclofosfamida, debido a que
es la reacción inmune la que conlleva a las consecuencias fatales y no el virus
en sí mismo (Couto C. Guillermo y col.2000; T. Ishida y col.2003; Y. Fisher y
col.2011; Yoshikasu Tanaka y col.2012; Yoshikasu Tanaka y col.2013; Niels C.
La Prednisolona es el inmunosupresor principal utilizado en el tratamiento de
PIF, es segura, incrementa el apetito, suprime la respuesta humoral y la
respuesta inmune mediada por células, disminuye la vasculitis diseminada
producida por los complejos antígeno-anticuerpo y la acumulación de
leucocitos. En general se administra por vía oral, 50-100 mg/m2 por día o 2-4
mg/kg/día, reduciendo gradualmente la cantidad administrada cada 10-14 días
hasta determinar la dosis óptima. Deben administrarse conjuntamente
antibióticos de amplio espectro para prevenir las infecciones secundarias, en
caso de prevenir el resurgimiento de un herpes virus latente también se puede
sumar L-lisina. Se han utilizado drogas alquilantes conjuntamente a
Prednisolona, para reducir los signos clínicos debido al efecto lítico que poseen
contra las células B, dentro de este grupo se recomiendan: Ciclofosfamida,
Melfalan y Clorambucilo (Couto C. Guillermo y col.2000; Paludi Alejandro E. y
col. 2004; Nélida V. Gómez y col.2005; Diane D. Addie y col. 2008; Katrin
Hartmann y col.2008; Niels C. Pedersen 2014).
Los antagonistas de Factores de Necrosis Tumoral (TNF), como la Pentoxifilina
(PTX) fue usada para controlar la vasculitis mediante la inhibición de la síntesis
de TNF-α por monocitos activados, se pueden encontrar reportes de casos
clínicos en donde se tuvieron efectos positivos, principalmente en el tiempo de
supervivencia de los pacientes con PIF. El Clorhidrato de ozagrel (inhibidor de
Tromboxano (Tx) sintetasa) fue administrado a dos gatos diagnosticados con
PIF, se observaron mejoras en ambos pacientes, tanto en sus parámetros
clínicos como en su estado general (Toshihiro Watari y col.1998; Addie D.D.
2008; Katrin Hartmann y col.2008; Li-En Hsieha y col. 2010; Y. Fischer y col.
2011; Niels C. Pedersen 2014).
1. 7. 3. DROGAS ANTIINFLAMATORIAS E INMUNOMODULADORAS
Debido a que PIF es una enfermedad inmunomediada, deben adicionarse al
tratamiento fármacos que generen, ya sea, una inhibición de la respuesta
inmune, antagonismo de citoquinas y/o incrementos de Interferon (IFN) (T.
Ishida y col. 2003).
El Interferon- alpha (IFN-α) humano ha sido utilizado y recomendado para el
tratamiento de gatos con PIF. Se observó un incremento en el tiempo de
supervivencia de los animales tratados versus los tratados con placebos,
causando una remisión temporal en los gatos con la forma efusiva, pero no
hubo cambios en cuanto a la tasa de mortalidad de los dos grupos. El
Interferon Recombinante Felino (rFeIFN) en un estudio utilizado en la
terapéutica de PIF tuvo resultados eficaces con respuestas completas
(remisión de ≥ 2 años) y parciales (remisión de 2-5 meses), debe tomarse en
cuenta que se utilizó conjuntamente a glucocorticoides (inmunosupresor) que
no parece interferir con la respuesta mediada por el IFN a pesar de disminuir la
respuesta Th1 y Th2 necesaria para combatir enfermedades virales (Couto C.
Guillermo y col.2000; Ishida y col.2003; Susanne Ritz y col.2007; Katrin
Hartmann y col.2008; Yoshikasu Tanaka y col.2012; Yoshikasu Tanaka y
col.2013).
La Talidomida es un quimioterápico de acción específica para el tratamiento de
enfermedades humanas que se piensa que tienen una base autoinmune o
inflamatoria. La razón para utilizar esta droga en el tratamiento de PIF es
reducir la inflamación y la respuesta inmune humoral contra el Coronavirus, y al
mismo tiempo mantener intacta la respuesta inmune mediada por células. Se
ha demostrado in vitro que la Talidomida reduce significativamente la
fagocitosis de monocitos sin aparente citotoxicidad; in vivo disminuye la
circulación de células helper-T (TH) e incrementa aparentemente las células
supresoras T. Además, inhibe selectivamente el TNF-α y el INF-ɣ,
infrarregulación de la expresión de moléculas de adhesión, y disminución de los
niveles de IgM. La Talidomida se ha utilizado en el tratamiento de gatos con
PIF a dosis de 50-100 mg debiendo administrarse por la noche, teniendo
resultados parciales, remisión por 3 meses en un solo caso clínico. Para que
resulte eficaz debe administrarse en la etapa temprana de la enfermedad,
antes de que se dañen demasiados vasos sanguíneos, evitando su uso en
gatas preñadas debido a su efecto teratogénico (S. Tseng y col.1996; Nelida V.
Gomez y col.2000; Diane D. Addie 2006; Addie D.D. 2008; Diane D. Addie y
col.2008).
1. 7. 4. DROGAS INMUNOESTIMULANTES NO ESPECÍFICAS
Los inmunoestimulantes no específicos son usados en medicina veterinaria,
dentro estos compuestos se incluyen inmunoestimulantes como Proteína A
estafilocócica,
(Propionobacterium
(inmunomodulador estimulante de linfocitos T) e Imulan (inmunomodulador de
células linfocitos T). La combinación de Interferon-α y Propionobacterium acnés
prolongó la sobrevida en algunos gatos con infección experimental pero no se
logró la protección contra la enfermedad fatal. El Inmunoestimulante Poliprenil
(promueve la respuesta inmune Th-1) en casos de PIF seco incrementó
relativamente en el tiempo de supervivencia de los animales tratados, en
cambio en los casos de PIF efusivo no se observó beneficio alguno (Couto C.
Guillermo y col. 2000; Katrin Hartmann y col.2008; Albert M Legendre y col.
2008; Albert M Legendre 2013; Niels C. Pederson 2014).
1. 7. 5. FARMACOS DE APOYO
Estos fármacos pueden ser utilizados conforme se considere necesario en
cada caso clínico: Aspirina (10 mg/kg cada 48-72 hs. P.O.) por su actividad
antiinflamatoria y analgésica; Ampicilina (50 mg 3 veces al día P.O.) los
antibióticos pueden ser indicados para tratamiento de infecciones bacterianas
secundarias; Nandrolona (2-5 mg/kg una vez a la semana) o Estenazolol (1 mg
cada 12 horas P.O.), los esteroides anabólicos son utilizados para incrementar
el apetito y por su acción anticatabólica; Eritropoyetina recombinante humana
(50-100 UI/ml SC 3 veces por semana) en casos de anemia normocítica
normocrómica no regenerativa a causa de la falla renal producida por PIF seco
renal; y/o vitaminas y antioxidantes (Couto C. Guillermo y col.2000;Nelida V.
Gómez y col.2005; Diane D. Addie 2006; Diane D. Addie y col.2008; Lina Sanz
y col.2012).
1. 7. 6. TRATAMIENTOS DE SOSTÉN
Estas medidas son utilizadas para mejorar la calidad de vida de los pacientes y
posiblemente aumentar el tiempo de supervivencia de los mismos. En el caso
de pacientes con efusión, el drenaje intermitente de las cavidades corporales
afectadas debe realizarse conforme se considere necesario, especialmente la
toracocentesis para aliviar la disnea; la hidroterapia parenteral para mantener la
hidratación, transfusiones sanguíneas en casos de anemia no regenerativa
intensa; y terapéutica nutricional por alimentación con tubo nasogástrico,
gastrotomía o faringostomía son medidas terapéuticas que deben ser
consideradas (Robert G. Sherding 1996;Couto C. Guillermo y col.2000; Addie
2. DESCRIPCIÓN DE CASOS CLÍNICOS
2.1 CASO CLÍNICO 1
2.1.1 Reseña del animal
Especie: Felino Raza: Exótico Sexo: Macho Edad: 6 (seis) meses Peso vivo: 1,870 Kg. (kilogramos) Color del manto: Colorado Nombre: "UGLEMUC"
2.1.2 Anamnesis
El dueño lo describió decaído desde hace unos días (no come, ni juega). Se lo
observó comiendo piedras sanitarias y completamente ausente a los estímulos
del medio ambiente. También comentó episodios de diarrea y vómitos en los
últimos 15 días, sumados a un descenso del peso del animal. No convive con
otros animales, fue adquirido en un criadero semanas previas a la consulta
médica. Vacunación al día.
2.1.3 Cuadro clínico
DÍA 17/10/14: es el día de la primera consulta, a la inspección el paciente
presentó un aspecto deteriorado, desalineado y el sensorio deprimido. Se
encontraron las mucosas pálidas y signos coincidentes con deshidratación,
además de la presencia de pulgas. A la maniobra de palpación manifestó
signos compatibles con dolor abdominal, y se encontró la presencia de una
masa en abdomen ubicada en zona epigástrica.
El animal tenía una temperatura de 39,7ºC y una glucemia de 138 mg/dl
(realizada en el momento de la consulta con glucómetro ACCU-CHEK active
del laboratorio Roche). Se tomó una muestra sanguínea para remitir al
laboratorio y se realizó un análisis de orina rápido.
Análisis de orina rápido (17/10/14)
Método Heller: Proteínas = (-), Pigmentos Biliares = (+), Rangos: (-) (+/++/+++/++++).
Tiras reactivas: Leucocitos: (-), Nitritos: (-), Urobilinógeno: (-), Ph: 5,5, Sangre: (-), Cetonas: (-), Bilirrubina: (+), Glucosa: (-).
Densidad: +1,080 (refractometría).
Ante el antecedente de consumo de piedras sanitarias, la palpación de una
masa en abdomen en la zona epigástrica, dolor a la maniobra y pigmentos
biliares en el análisis de orina rápido, se llegó a la conclusión de una posible
obstrucción intestinal. Se decidió administrar un tratamiento paliativo a la
espera de los resultados de los análisis complementarios recomendados
(análisis de sangre y ecografía abdominal):
Dexametasona (Dexametasona Kualcos, laboratorio Kualcos®) 0,1 ml
(0,2 mg/kg) vía SC,
Meloxicam (Meloxivet®, Laboratorio John Martin) 0,01 ml(0,2 mg/kg) vía
SC, ante la manifestación de dolor abdominal,
Amoxicilina (Clamoxyl L.A®., Laboratorio ZOETIS) 0,2 ml (15 mg/kg) vía
Reposición de fluidos con250 ml de solución salina (ClNa 0,9%) vía SC,
debido a los signos coincidentes con deshidratación.
DÍA 18/10/14: Se realizó la inspección general del animal, el cual se encontró
decaído, ausente a los estímulos del medio, continuaba con las mucosas
pálidas, leve deshidratación, dolor a la palpación abdominal, además de la
presencia de la masa en zona epigástrica. También se efectuó el control de
temperatura del paciente, la cual se encontró en 37,8 ºC.
Análisis de Sangre (muestra tomada el día 17/10/14, resultado recibido el
día 18/10/14):
Valor del paciente
Valores de referencia
Hematíes (x 10 -6 / mm3)
Hemoglobina (g/dl)
Leucocitos (/mm3)
BIOQUIMICA Y ENZIMAS
Creatinina (mg/dl)
Bilirrubina total (mg/dl)
Bilirrubina directa (mg/dl)
Bilirrubina indirecta (mg/dl)
Proteína total (g/dl)
Fosfatemia (mg/dl)
Amilasemia (UI/l)
Hasta 3000 (1300 – 2500 rango inespecífico)
GOT – AST (UI/l)
GPT – ALT (UI/l)
Adulto: hasta 100 / Cachorro :hasta 200
Al observar los resultados de los análisis sanguíneos (valores elevados de
proteínas totales 8,6 gr/dl, descenso de la albumina 2,4 g/dl, relacionándolo con
hiperglobulinemia), sumados a la anamnesis (raza, edad, historia clínica de
signos inespecíficos y signos nerviosos), e inspección del paciente se llegó al
diagnóstico presuntivo de Peritonitis Infecciosa Felina.
En el día de la fecha se inició la administración de Oxitetraciclina
(Terramicina®, laboratorio Pfizer) 0,4 ml (10 mg/kg) vía SC cada 48 horas y la
terapia con talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR), vía Oral a
dosis de 50 mg/gato cada 24 hs/noche.
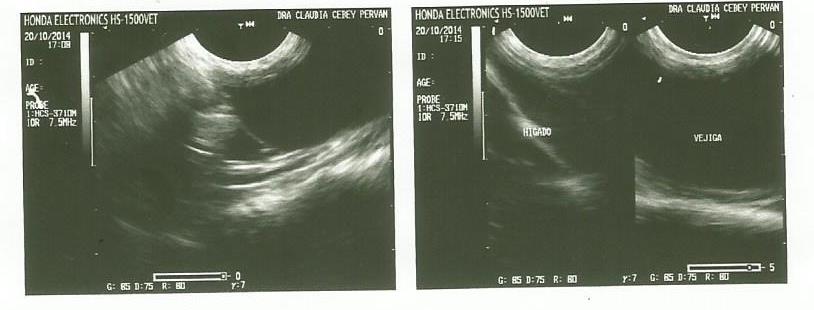
DÍA 20/10/14: Se realizó la ecografía abdominal (Foto 1) previamente
recomendada con el siguiente informe:
Linfoadenopatía mesentérica (aproximadamente 2,70 por 1,18 cm).
Incipiente colecta abdominal (en puntos de declive).
Resto sin particularidades.
Foto 1: Ecografía Abdominal realizada el 20/10/14
Se tomó la temperatura del animal, que se encontraba en 37,6ºC y se procedió
a la administración de:
Oxitetraciclina (Terramicina®, laboratorio Pfizer) 0,4 ml (10 mg/kg) vía
Dexametasona (Dexametasona Kualcos, laboratorio Kualcos®)0,1 ml
(0,2mg/kg) vía SC,
Tramadol (Algen 20, laboratorio RICHMOND)2 mg/kg (0,2 ml) vía IM ,
debido a la manifestación de dolor abdominal y,
Furosemida: (Salix®, laboratorio MSD Salud Animal) 0,15ml (4 mg/kg)
Ante el informe ecográfico, se llega a la conclusión de que estamos ante un
caso de Peritonitis Infecciosa Felina, con un cuadro clínico caracterizado por
forma no efusiva abdominal/nerviosa de la enfermedad la cual está
evolucionando hacia la fase efusiva, con inicio de colectas en abdomen.
Decidimos mantener el tratamiento previamente establecido:
Dexametasona (Dexametasona Kualcos, laboratorio Kualcos®) 0,1 ml
(0,2mg/kg) vía SC cada 48 horas,
Oxitetraciclina (Terramicina®, laboratorio Pfizer) 0,4 ml (10 mg/kg) vía
Talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR) 50 mg/gato vía
P.O. cada 24 horas en horario nocturno, y
Meloxicam (Meloxivet®, laboratorio John Martin) 0,01 ml (0,2 mg/kg) por
vía SC, (ésta última cuando se la consideraba necesaria ante la
presencia de signos coincidentes con dolor).
Sumados a controles periódicos en el domicilio en horario nocturno, en donde
se realizaron la administración de los diferentes medicamentos y controles de
temperatura (gráfico1, tabla 1).
Controles de temperatura (tabla 1):
Temperatura

Temperatura (c◦)
Curva de Temperatura (gráfico 1)
Curva de Temperatura
DÍA 29/10/14: El paciente fue llevado a la consulta para su control, en la
inspección se lo encontró decaído, con las mucosas pálidas, leve
deshidratación, y una temperatura de 40,6 C◦. El dueño describió el inicio de un
comportamiento extraño por parte del animal, éste comenzó a esconderse
detrás de la heladera durante varias horas al día y lo notó decaído. Continuó
con el tratamiento previamente establecido, el propietario comentó que además
del tratamiento se le administró complejos vitamínicos.
DÍA 30/10/14: El animal fue llevado al consultorio con respiración abdominal y
taquipnea. Se procedió a realizar punción torácica y abdominal, ambas con
colecta de líquidos. Las muestras fueron sometidas a una prueba de Heller
dando como resultado positivos a la presencia de proteínas (Foto 2). Se tomó
la temperatura del paciente 41,4ºC, y se concluye que el mejor manejo del
mismo seria mediante la internación.
Foto 2: Prueba de Heller a liquido de colecta torácica en el día 30/10/14
(Proteína: +++)
En este punto se discontinúa la administración de talidomida. El paciente recibe
una dosis de Metamizol (Vetalgina®, Laboratorio INTERVET) 0,1 ml (30 mg/kg)
vía IM y de Dexametasona (Dexa 20, Laboratorio RICHMOND) 0,18 ml (2
mg/kg) vía SC. Una vez concluidas las medidas terapéuticas e iniciada la
internación del animal, el patrón respiratorio cambio a costo-abdominal y se
produjo la disminución de la frecuencia respiratoria, volviendo a parámetros
DÍA 31/10/14: El paciente demostró apetito, comió y tomo agua, además se lo
notó mejor de ánimo durante el día de la fecha. Por la tarde volvió a presentar
taquipnea, por lo tanto se repite la maniobra de punción torácica, en esta
oportunidad no se colecta líquido. Su temperatura era de 41,3ºC.
DÍA 01/11/14: El animal se denotó decaído, y con respiración abdominal, su
temperatura era de 41,5ºC. Se le administró Triamcinolona (Atriben,
Laboratorio HOLLYDAY SCOTT) 0,06 ml (0,2 mg/kg) vía SC administrada con
jeringa para insulina.
DÍA 03/11/14: El estado del paciente siguió desmejorando, no solo estuvo
decaído, ya no manifestó apetito y solo tomó agua esporádicamente. Se le
observó con el abdomen distendido, a la maniobra de palpación y sucusión se
advirtió la presencia de colecta liquida. Mantuvo el patrón respiratorio
abdominal y taquipnea. Su temperatura fue de 41,6ºC.
DÍA 04/11/14: Se procedió a la eutanasia del paciente mediante la aplicación
de Acepromacina (Acedan, Laboratorio HOLLYDAY SCOTT) 0,1 ml (0,5 mg/kg)
vía IM y Ketamina (Ketamina 50, Laboratorio HOLLYDAY SCOTT) 0,5 ml (15
mg/Kg) vía IM, una vez anestesiado se realizó a la aplicación intracardiaca de
Pentobarbital sódico/ Difenilhidantoina sódica (Euthanyle, Laboratorio:
BROUWER) 0,4 ml (0,2 ml/kg).
Necropsia
A la necropsia realizada en el día de la fecha (04/11/14) se observaron:
Hepatomegalia, lesiones en placas blanquecinas y rugosas en Hígado,
Diafragma, Pulmón, Bazo (Foto 4), y Ganglios Mesentéricos. Los ganglios
mesentéricos aumentados de tamaño y con adherencias (Foto 5). Colecta de
líquido en tórax y pericardio (Foto 3 y 6), además de líquido sanguinolento en
abdomen. Sin otra particularidad.
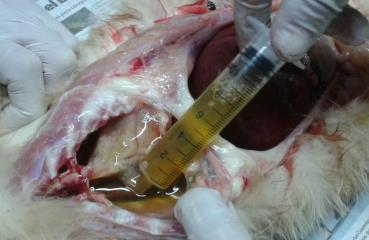
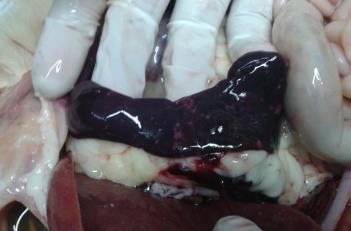
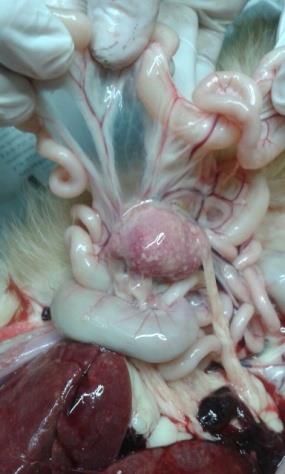
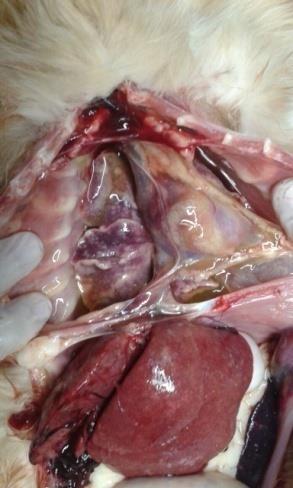
Foto 3: Colecta liquida en tórax.
Foto 5: Ganglios mesentéricos, Foto 6: Hepatomegalia y lesiones
aumento de su tamaño, adherencias hepáticas. Colecta de líquido en
y lesiones. Lesiones en Hígado.
tórax y pericardio.
Se procedió a enviar las muestras de líquido y de las lesiones en los distintos
órganos para su análisis en los correspondientes laboratorios.
Colectas: La muestra posee una densidad de 1.035, de color ámbar/dorado,
viscoso. Posee características de una efusión exudativa aséptico, proteínas 4
g/dl, contenido celular bajo con predominio de macrófagos.
Histopatología: La histopatología revelo la presencia de hiperplasia folicular
reactiva en el ganglio mesentérico, amplios focos de infiltración mononuclear
en el bazo, en el hígado se observaron infiltrados inflamatorios mononucleares
amplios en los espacios porta, y focos de infiltración mononuclear en el
corazón. Los infiltrados tenían predominio celular de macrófagos, linfocitos y
células plasmáticas. Dando el diagnóstico de miositis granulomatosa, hepatitis
piogranulomatosa multifocal, esplenitis piogranulomatosa y linfoadenopatía
mesentérica a predominio linfohistiocítica, la apariencia microscópica de estas
lesiones es sugestiva de Peritonitis Infecciosa Felina.
2.2 CASO CLÍNICO 2
2.2.1 Reseña del animal
Especie: Felino Raza: Británico Sexo: Macho Edad: 1 (uno) año Peso vivo: 2,560 Kg. (kilogramos) Color del manto: Azul Nombre: "GARDEL"
2.2.2 Anamnesis
Al paciente lo llevaron al consultorio para su vacunación, colocación de chip y
realizar la documentación necesaria para su venta y transporte al extranjero.
En el transcurso de la consulta los dueños describieron episodios esporádicos
de diarrea y vómitos, disminución de peso y decaimiento por parte del animal.
2.2.3 Cuadro clínico
DÍA 25/10/14: A la inspección se le observaron las mucosas ictéricas y
temperatura de 39,5ºC. A la palpación se denotó una masa en abdomen y dolor
a la maniobra, por ello se recomendó realizar una ecografía abdominal como
análisis complementario. Se procedió a la toma de una muestra sanguínea
para su envió al laboratorio y una muestra de orina para someterla a un análisis
de orina rápido.
Análisis de orina (25/10/14):
Método Heller: Proteínas = (-), Pigmentos Biliares = (++), rangos: (-)
(+/++/+++/++++).
Tiras reactivas: Leucocitos: (-), Nitritos: (-), Urobilinógeno: (-), Ph: 6, Sangre: (-),
Cetonas: (-), Bilirrubina: (+), Glucosa: (-).
Densidad: 1,050 (refractometría).
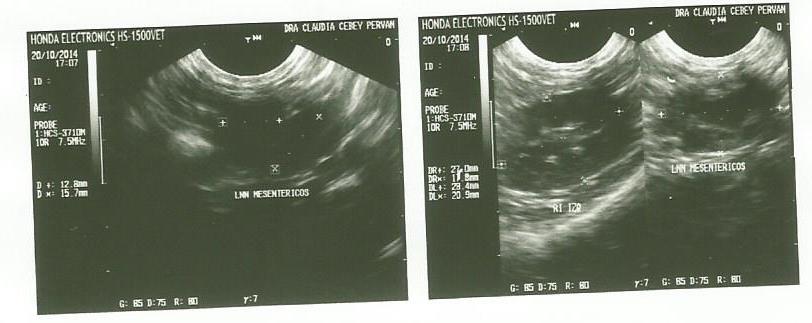
DÍA 26/10/14: Se realizó la ecografía (Foto 7) del paciente con el siguiente
informe ecográfico:
Ecografía (26/10/14):
Hígado: ligera hepatomegalia con ecoestructura homogénea conservada.
Vesícula Biliar: distendida, sin otra particularidad. Vías biliares y vasculatura sin
particularidades.
Bazo: ligera esplenomegalia con ecoestructura discretamente heterogénea
sugerente de órgano reactivo.
Riñones: ambos conservan tamaño y ecoestructura. Cortezas renales
ecogénicas (podría sugerir proceso inflamatorio: glomerulonefritis). Se sugiere
prueba de funcionalidad con análisis de sangre.
Tracto Gastrointestinal: Estómago sin particularidades. Intestino se observa en
mesogastrio al menos cuatro (4) imágenes hipoecoicas homogéneas de
aproximadamente 2,12 por 1,60 cm /2,05 por 1,16 cm/ 1,72 por 2,77 cm/ 1,87
por 1,99 cm, sugerentes de linfoadenopatía mesentérica reactiva.
Estratificación mural conservada.
Área Pancreática: sin alteraciones ecográficas evidentes en el presente estudio.
Vejiga, paredes y contenido: sin particularidades.
FOTO 7: Ecografía realizada el 26/10/14
Análisis de sangre (toma de muestra el día 25/10/14, resultado recibido el día
26/10/14):
Valor del paciente
Valores de referencia
Hematíes (x 10 -6 / mm3)
Hemoglobina (g/dl)
Leucocitos (/mm3)
FÓRMULA
RELATIVA (%)
ABSOLUTA (/mm3)
VALOR NORMAL
Neutrófilos segmentados
2500 - 12500
Neutrófilos en banda 5
0 – 300
1500 - 7000
0 – 1500
Formas juveniles
---------
BIOQUIMICA Y ENZIMAS
Creatinina (mg/dl)
Proteína total (g/dl)
Relación Alb/Glob
GOT – AST (UI/l)
GPT – ALT (UI/l)
OBSERVACIONES: Leucocitosis con neutrofilila y desvío a la izquierda regenerativo.
OBSERVACIONES: Suero ictérico.
Debido a las imágenes observadas en la ecografía, sumados a los resultados
del análisis de sangre (valores elevados de proteínas totales (9,7 gr/dl) y a la
disminución en la relación Albumina/Globulina 0,29), se llega a la conclusión de
que es un posible caso de Peritonitis Infecciosa Felina, con lo cual se empezó
el tratamiento con talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR) 50
mg/gato, vía P.O. cada 24 horas en horario nocturno.
En ese momento el propietario comentó tener antecedentes de PIF en varios
animales pertenecientes al criadero. Éstos gatos generalmente manifestaban
signos oculares (anisocoria), signos nerviosos (cambios de comportamiento,
pica, convulsiones) y colectas en abdomen y/o tórax. Por lo tanto se tomó la
decisión de no proceder a la venta del paciente, comenzar con el tratamiento y
realizar controles periódicos.
DÍA 03/11/14: Consulta telefónica: El dueño describió que el animal disminuyó
de peso, estuvo decaído, aunque aún conservaba el apetito y tomaba agua; no
caminaba hasta las piedritas sanitarias y en más de una ocasión orinó fuera de
las mismas. Desde hace unos días el propietario comenzó con la
administración de complejos vitamínicos cada 12 horas y mantuvo el
tratamiento basado en talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR)
50 mg/gato, vía P.O. cada 24 horas en horario nocturno.
DÍA 05/11/14: El animal fue traído a la consulta por encontrarse sumamente
decaído, el dueño comentó que aún conservaba el apetito y tomaba agua. A la
inspección se observaron las mucosas ictéricas; su peso fue de 1,950 kg
denotando una marcada disminución de peso y la temperatura fue de 40,5ºC.
Se le realizó una punción abdominal al observar el abdomen aumentado de
tamaño, a la misma no se recuperó colecta. Recibió tratamiento con
Dexametasona (Dexametasona Kualcos, laboratorio Kualcos®) 0,1 ml
(0,2mg/kg) vía SC, y Oxitetraciclina (Terramicina®, laboratorio Pfizer) 0,4 ml
(10 mg/kg) vía SC.
DÍA 07/11/14: Consulta telefónica: El propietario comentó haber observado al
paciente sumamente decaído, aunque continuaba comiendo y tomando agua;
en ocasiones comió objetos extraños o fuera de lo común (algodón, papel,
etc.), manifestando claramente el signo de pica; además percibió debilidad por
parte del animal, en varias oportunidades orinó y defeco fuera de la batea, no
advirtió un descenso de peso del gato en estos días.
Continuó con el tratamiento de talidomida (TALIDOMIDA LAZAR®, laboratorio
LAZAR) 50 mg/gato, vía P.O. cada 24 horas en horario nocturno, complejo
vitamínico y cuando lo observó en mal estado Dexametasona (Dexametasona
Kualcos, laboratorio Kualcos®) 0,1 ml (0,2mg/kg) vía SC.
DÍA 14/11/14: Recibimos el llamado del propietario avisándonos que el animal
falleció, se pide poder realizar la necropsia para tener el diagnóstico definitivo,
el dueño aceptó traer al paciente al consultorio para realizar el procedimiento.
Necropsia
A la necropsia realizada en el día de la fecha (14/11/14) se observó: colecta de
líquido en tórax y abdomen (efusión pleural y ascitis, siendo probablemente las
causas de muerte al dificultar la respiración, llevando al colapso y muerte del
animal), lesiones en forma de placas blanquecinas en Hígado (Foto 8), Bazo,
Intestino, Mesenterio y Pulmones y Ganglios Mesentéricos aumentados de
tamaño. Sin otra particularidad.
FOTO 8: Lesiones en placa en hígado.
2.3. CASO CLÍNICO 3
2.3.1 Reseña del animal
Especie: Felino Raza: Común Europeo Sexo: Hembra Edad: 6 (seis) meses
Peso vivo: 2,150 Kg. (kilogramos) Color del manto: Blanco Nombre: "PIPA"
2.3.2 Anamnesis
Los dueños comentaron que encontraron al paciente decaído desde hace unos
días, lo observaron comiendo piedras sanitarias y lamiendo las cerámicas del
piso. También se describieron episodios de diarrea y vómitos, sumados a un
descenso de peso y "palidez" (nariz despigmentada).
2.3.3 Cuadro clínico
DÍA 20/09/14: A la inspección el animal se presentó decaído y con el sensorio
deprimido. Tenía las mucosas pálidas, y una temperatura de 40ºC, se le realizó
un análisis de orina rápido y se tomó una muestra de sangre para su envío al
laboratorio correspondiente.
Análisis de orina (20/09/14)
Método Heller: Proteínas = (-), Pigmentos Biliares = (-), rangos: (-) (+/++/+++/++++).
Tiras reactivas: Leucocitos: (-), Nitritos: (-), Urobilinógeno: (-), Ph: 6, Sangre: (-), Cetonas: (-), Bilirrubina: (-), Glucosa: (-).
Densidad: 1,060 (refractometría).
Se le administró Triamcinolona (Atriben, Laboratorio HOLLYDAY SCOTT) 0,08
ml (0,2 mg/kg) vía SC con jeringa de insulina y Oxitetraciclina (Terramicina®,
laboratorio Pfizer) 0,4 ml (10 mg/kg) vía SC.
Análisis de sangre (toma de muestra del día 20/09/14, resultado recibido el
día 22/09/14)
Valor del paciente
Valores de referencia
Hematíes (x 10 -6 / mm3)
Hemoglobina (g/dl)
Leucocitos (/mm3)
BIOQUIMICA Y ENZIMAS
Creatinina (mg/dl)
Bilirrubina total (mg/dl)
Bilirrubina directa (mg/dl)
Bilirrubina indirecta (mg/dl)
Proteína total (g/dl)
GOT – AST (UI/l)
GPT – ALT (UI/l)
Adulto: hasta 100 / Cachorro: hasta 200
DÍA 22/09/14: Los resultados de los análisis de sangre en ese momento no
mostraron ninguna particularidad, salvo por una marcada anemia (Hematocrito
del 10%). Continuó con el tratamiento de Oxitetraciclina (Terramicina®,
laboratorio Pfizer) 0,4 ml (10 mg/kg) vía SC cada 48 hs y se le administró
también eritropoyetina (EPOGEN, laboratorio Pablo Cassará S.R.L.) 0,4 ml
(200 UI/kg) vía SC. Presentaba una temperatura de 40,2ºC al momento de la
DÍA 30/09/14: Se tomó nuevamente una muestra de sangre para remitir al
laboratorio y se midió la temperatura, que en el momento de la consulta era de
39,7ºC. El paciente continúo con el tratamiento de Oxitetraciclina
(Terramicina®, laboratorio Pfizer) 0,4 ml (10 mg/kg), vía SC cada 48 hs.
Ante la falta de respuesta del tratamiento establecido, la fiebre recurrente que
no remite, la edad y los signos nerviosos se presume un caso clínico de
Peritonitis Infecciosa Felina. Dado esto, se recomendó comenzar con el
tratamiento de talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR) 50
mg/gato, vía P.O. cada 24 horas en horario nocturno.
Análisis de sangre (toma de muestra realizada el día 30/09/14, resultado
recibido el día 01/10/14)
Valor del paciente
Valores de referencia
Hematíes (x 10 -6 / mm3)
Hemoglobina (g/dl)
Leucocitos (/mm3)
FÓRMULA
RELATIVA (%)
ABSOLUTA (/mm3)
VALOR NORMAL
Neutrófilos segmentados
2500 - 12500
Neutrófilos en banda 7
0 – 300
1500 - 7000
0 – 1500
Formas juveniles
---------
BIOQUIMICA Y ENZIMAS
Creatinina (mg/dl)
Proteína total (g/dl)
Relación Alb/Glob
GOT – AST (UI/l)
GPT – ALT (UI/l)
OBSERVACIONES: Suero ictérico.
DÍA 01/10/14: Se recibieron los resultados del laboratorio, denotando todavía
anemia con un hematocrito del 12%, y a su vez se puede observar el aumento
de las proteínas totales en un valor de 8,4 g/dl reconfirmando las sospechas de
un posible caso de PIF. Por lo tanto, se decidió continuar con el tratamiento
previamente establecido.
DÍA 07/10/14: El animal es llevado a la consulta para realizar un control, hasta
la fecha siguió con el tratamiento de talidomida (TALIDOMIDA LAZAR®,
laboratorio LAZAR) 50 mg/gato, vía P.O. cada 24 horas en horario nocturno. Se
recomendó comenzar con la administración de Interferon α/β (Interferon Oral,
desarrollado por el CIV (Centro De Inmunoterapia Veterinaria)) 0,5 ml P.O.
UVD (UVD: una vez al día).
En el día de la fecha presentaba una temperatura de 39,2ºC y un peso de
2,295 kg, denotando un leve incremento de peso. Los dueños comentaron que
se encontraba mejor de ánimo (manteniendo el apetito y jugando), además el
comportamiento extraño comenzó a ceder, aunque continuaba teniendo
episodios en donde comía piedras sanitarias.
DÍA 20/10/14: El paciente es traído nuevamente a consulta para realizar un
control, su temperatura era de 39,0 ºC y su peso de 2,305 kg. Continúa con el
tratamiento previamente establecido.
DÍA 30/10/14: Los dueños comentaron que se encuentra mejor de ánimo,
incluso "recupero el color", tiene buen apetito, aunque pierde algo de pelo y
cesó por completo el comportamiento extraño.
Se realizó una inspección general, la temperatura era de 38,5ºC y en ese
momento tenía un peso de 2,380 kg. Sin ninguna otra particularidad.
Continua con el tratamiento de talidomida (TALIDOMIDA LAZAR®, laboratorio
LAZAR) 50 mg/gato, vía P.O. cada 24 horas en horario nocturno, Interferon α/β
(Interferon Oral, desarrollado por el CIV (Centro De Inmunoterapia Veterinaria))
0,5 ml P.O. UVD (UVD: una vez al día) y en ocasiones le realizan sesiones de
DÍA 06/11/14: Consulta telefónica: Los dueños comentaron que a pesar de
encontrarse en buen estado y con apetito, comenzó a lamer su propia orina en
ocasiones. Se recomendó traer a control al paciente, ante la manifestación de
nuevos signos nerviosos.
DÍA 11/11/14: Traen al animal al consultorio debido a que lo notan "sin color"
nuevamente y decaído. Se toma una muestra de sangre para realizar control
de los valores hemáticos. Su temperatura en el momento de la consulta era de
38,7ºC, a la inspección se observaron las mucosas pálidas, llevando a la
sospecha de encontrarse con anemia nuevamente.
DÍA 12/11/14: Resultados de los análisis de sangre:
Análisis de sangre (toma de muestra realizada el día 11/11/14, resultado
recibido el día 12/11/14)
Valor del paciente
Valores de referencia
Hematíes (x 10 -6 / mm3)
Hemoglobina (g/dl)
Arreg< 2.0 Reg ³ 2.0
Leucocitos (/mm3)
FÓRMULA
RELATIVA (%)
ABSOLUTA (/mm3)
VALOR NORMAL
Neutrófilos segmentados
2500 - 12500
Neutrófilos en banda
0 – 300
1500 - 7000
0 – 1500
Formas juveniles
---------
BIOQUIMICA Y ENZIMAS
Creatinina (mg/dl)
Proteína total (g/dl)
Relación Alb/Glob
GOT – AST (UI/l)
GPT – ALT (UI/l)
Bilirrubina directa (mg/dl)
0,10 Hasta 0.3
Bilirrubina indirecta (mg/dl)
0,19 Hasta 0.3
Bilirrubina total (mg/dl)
0,29 Hasta 0.6
OBSERVACIONES: Anemia Normocítica normocrómica arregenerativa.
Los resultados de los análisis de sangre mostraron que el animal presentaba
anemia con lo cual se inició el tratamiento con eritropoyetina (EPOGEN,
laboratorio Pablo Cassará S.R.L.) 0,5 ml (200 UI/kg) por vía SC., a su vez se
puede observar como los valores de proteínas totales y la relación
Albumina/Globulina se encontraban dentro de los valores normales.
El paciente hasta el día de la fecha (05/12/14) se encuentra en tratamiento con
talidomida (TALIDOMIDA LAZAR®, laboratorio LAZAR) 50 mg/gato, vía P.O.
cada 24 horas en horario nocturno, Interferon α/β (Interferon Oral, desarrollado
por el CIV (Centro De Inmunoterapia Veterinaria)) 0,5 ml P.O. UVD (UVD: una
vez al día) y con controles periódicos.
3. DISCUSIÓN
En el primer caso clínico se llega la diagnóstico de PIF gracias a la procedencia
del animal, anamnesis completa, edad, raza, signos clínicos, análisis
complementarios (parámetros sanguíneos y ecografía), posibilitando la
administración de Corticoides conjuntamente a Antibióticos de amplio espectro,
terapéutica ampliamente descripta en la bibliografía; como así también se
llevaron a cabo maniobras complementarias necesarias para el bienestar del
paciente (punciones, administración de fluidoterapia y analgesia). Algo a tener
en cuenta además, es que se le administraron Corticoides conjuntamente a
AINE s sin ningún protector gástrico, lo cual pudo traer graves complicaciones
al cuadro clínico y estado del animal.
Se le administró Talidomida, un inmunomodulador, sin observarse cambio
alguno en el paciente, tanto en sus parámetros clínicos, como así también en el
desarrollo de la enfermedad. Esto puede deberse a múltiples factores, dentro
de los mismos caben mencionar: diagnóstico tardío de la enfermedad
(dilatación del propietario en traer el paciente al consultorio), breve periodo de
administración (12 días) pudiendo no ser suficiente para que haga efecto el
fármaco, agresividad del cuadro clínico y/o a la conjunta administración del
inmunomodulador con inmunosupresores (corticoides) quizás alterando su
En el segundo caso debido a los signos clínicos, procedencia del animal
(antecedentes del criadero), anamnesis, edad, raza, análisis complementarios
(parámetros sanguíneos y ecografía) se llega a la conclusión de que nos
encontramos ante un posible caso clínico de PIF. El diagnóstico es presuntivo
debido a la falta de análisis confirmatorios hasta el post-mortem, siendo
importante el correcto análisis de los datos clínicos y sanguíneos, la anamnesis
completa, análisis complementarios y los datos del paciente para inferir que
estamos ante la presencia de esta enfermedad. Se inicia el tratamiento con
Talidomida durante un periodo de 20 días consecutivos, en los cuales se
observaron leves mejoras al inicio de la terapéutica, pero lamentablemente se
concluye con la muerte del paciente. Además de talidomida se le administran
antibióticos de amplio espectro sumados a corticoides. Desafortunadamente en
este caso no se contó con un seguimiento estricto del paciente debido a las
reiteradas faltas a los controles por parte del propietario y debido a la negativa
del mismo no se remitieron las muestras de la necropsia para confirmar el
diagnóstico de PIF.
En el tercer caso clínico la edad, anamnesis, procedencia, signos clínicos y
análisis complementarios (análisis sanguíneos) nos permite arribar al
diagnóstico presuntivo de PIF. En este paciente se administraron antibióticos
de amplio espectro, conjuntamente a corticoides, talidomida e INF-α/β. En
diferentes referencias bibliográficas el INF ha sido efectivo en prolongar la
supervivencia de los pacientes con PIF seco, este mismo fármaco fue utilizado
en el único caso clínico de PIF en donde se observó un incremento en el
tiempo de supervivencia del paciente y una mejora en su estado general, como
así también en los análisis clínicos. Debido a que tanto la talidomida, como el
INF son inmunomoduladores, no podemos determinar cuál de las dos drogas o
sí la combinación de ambas, fue la que logro la mejora en el animal.
En estudios a futuro debería recolectarse mayor cantidad de datos sobre la
asociación de Talidomida e Interferon en casos clínicos de animales con el
diagnóstico confirmado de PIF, para así poder determinar su eficacia en la
práctica clínica.
Hasta el momento no contamos con vacunas efectivas para prevenir la
enfermedad. Varios de los intentos han sido infructuosos, llevando incluso al
síndrome de muerte temprana de los animales antes de la infección
experimental con el virus de PIF. Algunos autores postulan la efectividad de la
SERONEGATIVOS con riesgo a exposición, es decir aquellos que no tuvieron
contacto con el virus. La mayoría de los gatos que padecen de la enfermedad
entran en contacto con el virus en la lactancia, siendo la madre quien
transporta el virus y lo pone en contacto con las crías, la vacuna nasal debe ser
administrada meses después de que el paciente ya fue infectado con el virus,
siendo de esta manera ineficiente en la clínica.
4. CONCLUSIÓN
Existen en la bibliografía un sin número de alternativas de tratamientos muy
difíciles de evaluar y con pocos resultados confiables, sobre todo por la poca
posibilidad que existe de realizar, en ambientes controlados la reproducción de
la enfermedad y de tener una población susceptible para determinar la
efectividad de este tipo de tratamientos. Dentro de las pruebas preliminares se
deben incluir ensayos clínicos con controles de placebos, asignaciones al azar,
doble cegamiento y suficiente número de casos clínicos confirmados de la
enfermedad para su valides estadística. Para poder realizar una evaluación
clínica basada en los hallazgos científicos de estos fármacos, se debería contar
con la suficiente cantidad de casos clínicos para que la información sea
potencialmente aplicada a la clínica práctica.
Por el momento no se puede llegar a una conclusión, mediante el análisis de
estos casos clínicos, respecto al efecto de la talidomida en la PIF. Esto es
debido a la falta de un protocolo medicamentoso, casos clínicos de control,
escaso número de pacientes y la falta de confirmación final de PIF en 2 de
estos pacientes. Se necesitan ensayos clínicos para determinar si realmente es
beneficiosa la utilización de este fármaco, solo o en conjunto con otros, para el
tratamiento de esta enfermedad.
Al enfocar la terapéutica en drogas que modulan el sistema inmune, una mejor
comprensión de la inmunopatogénesis de la enfermedad se hace necesaria
para ofrecer un mejor tratamiento y en última instancia una posible cura.
REFERENCIAS BIBLIOGRÁFICAS
1. Addie D.D. (2008). Feline Infectious Peritonitis. Veterinary Interferon
Handbook, 2nd edition. Ed. K. de Mari. Virbac S.A. BP 27.06510
CARROS. France. Pp.132-146
2. Alfred M. Legendre, Joseph W. Bartges (2008). Effect of Polyprenyl
Immunostimulant on the survival times of three cats with the dry form of
feline infectious peritonitis. En: Journal of Feline Medicine and Surgery
(2009), vol. 11, Pp 624-626.
3. Alfred M. Legendre (2013). FIP treatments: What might work, what
doesn't work. En: Summary of Presentation at AAHA Meeting, Phoenix,
4. Couto C. Guillermo, Nelson Richard W. (2000) Enfermedades virales
polisistémicas. En: Medicina Interna de Animales Pequeños (Couto G.),
Segunda edición, Editorial Inter-Médica, Buenos Aires, Argentina. Pp:
5. Diane D. Addie (2006). Feline Infectious Peritonitis (FIP) Treatment.
En: 31 de Marzo del
6. Diane D. Addie y Oswald Jarrett (2008), Capitulo 11: Infecciones por
coronavirus felino. En: Enfermedades Infecciosas del Perro y el Gato
(Greene Craig E.), Editorial Inter-Médica, Buenos Aires, Argentina,
tercera edición, vol. 1, Pp: 97-113.
7. Darryl Falzarano, Emmie de Wit, Cynthia Martellaro, Julie Callison,
Vincent J. Munster, Heinz Feldman (2013). Inhibition of novel β
coronavirus replication by a combination of interferon-α2b and ribavirin.
DOI: 10.1038/srep01686. Source:
and(2009). Antiviral Activity of
Chloroquine against Human Coronavirus OC43 Infection in Newborn
Mice. En: Antimicrob. Agents Chemother, vol. 53, no. 83416-342.
9. Katrin Hartmann and Susanne Ritz (2008).Treatment of cats with feline
infectious peritonitis. En: Veterinary Immunology and Immunopathology,
vol. 123, Pp. 172–175.
10. Li-En Hsieha, Chao-Nan Lina, Bi-Ling Sub, Tong-Rong Jana, Chi-Min
Chenc, Ching-Ho Wanga, Dah-Sheng Lina, Chung-Tien Linb, Ling-Ling
Chueha(2010). Synergistic antiviral effect of Galanthus nivalis agglutinin
and nelfinavir against feline coronavirus. En: Antiviral Research, vol. 88,
Li-En Hsieh and Ling-Ling Chueh (2014). Identification and genotyping of
feline infectious peritonitis-associated single nucleotide polymorphisms in
the feline interferon-γ gene. (31 de Marzo del 2016). En:
11. Lina Sanz, Jocelyn Salazar (2012). Caso Clínico: Uso de eritropoyetina
recombinante humana en 3 gatos con anemia por fallo renal crónico. En:
Hospitales veterinarios, Vol. 4, Nº 4.
12. Nélida V. Gómez, Paola Pisano, Marcelo Duarte (2005) Coronavirus
Felino. En: Clínica Médica de Animales Pequeños (Nélida Virginia
Gómez, Silvia Feijoo), Royal Canin Argentina S.A., vol. 1, Pp. 190-195.
13. Niels C. Pedersen (2014). An update on feline infectious peritonitis:
Diagnostics and therapeutics. En: The Veterinary Journal, vol. 201, Issue
2, Special Issue: Feline Infectious Diseases, Pp 133-141.
14. Paludi Alejandro E., Minovich Fabián G. (2004). Peritonitis pleuritis
infecciosa felina (PPIF). En: Libro de Medicina Felina Práctica II. Editorial
Royal Canin Argentina SA, Buenos Aires, Argentina. Pp. 92-100.
(2014). Identification and characterisation of small molecule inhibitors of
feline coronavirus replication. En: Veterinary Microbiology, vol.174, Pp.
16. Robert G. Sherding (1996). Peritonitis infecciosa felina. En: Manual
Clínico de pequeñas especies (Stephen J. Birchard and Robert G.
Sherding). Ed. McGRAW-HILL*INTERAMERICANA. vol. 1, Pp: 109-116.
17. S. Tseng, G. Pak, K. Washenik, M. Keltz Pomeranz, and J. L. Shupack
(1996). Rediscovering thalidomide: A review of its mechanism of action,
side effects, and potential uses. En: The Ronald O. Perelman
Department of Dermatology, Dermatopharmacology section, New York
University Medical Center. New York, New York, USA. vol. 35, Issue 6,
18. Susanne Ritz, Herman Egberink, and Katrin Hartmann (2007). Effect of
Feline Interferon-Omega on the Survival Time and Quality of Life of Cats
with Feline Infectious Peritonitis. J. Vet. Intern. Med. 2007: vol. 27, Pp.
19. T. Ishida, A. Shibanai, S. Tanaka, K. Uchida, M. Mochizuki (2003). Use
of recombinant feline interferon and glucocorticoid in the treatment of
feline infectious peritonitis. En: Journal of Medicine and Surgery (2004)
vol. 6, Pp. 107-109.
20. T. Soma, M. Wada, S. Taharaguchi y T. Tajima (2013). Detection of
Ascitis Feline Coronavirus RNA from Cats with Clinically Suspected
Feline Infectious Peritonitis. En: Journal Vet. Sci., vol. 75 (10), Pp. 1389-
21. Toshihiro Watari, Takashi Kaneshima, Hashime Tsujimoto, Kenichiro
Ono and Atsuhiko Hasegawa (1998). Effect of Thromboxane Synthetase
Inhibitor on Feline Infectious Peritonitis in Cats. En: Journal of Veterinary
Medical Science Pp. 657-659.
22. Y. Fischer, S. Ritz, K. Weber, C. Sauter-Louis, and K. Hartmann.
Randomized, Placebo Controlled Study of the Effect of Propentofylline
on Survival Time and Quality of Life of Cats with Feline Infectious
Article first published online: 12 OCT 2011)
23. Ying-Ting Wang, Li-En Hsieh, Yu-Rou Dai and Ling-Ling Chueh (2014).
Polymorphisms in the feline TNFA and CD209 genes are associated with
(31 de marzo del 2016)
Source: http://www.ridaa.unicen.edu.ar/xmlui/bitstream/handle/123456789/607/Tesis%20Alarcon,%20Gabriela%20Ver%C3%B3nica.pdf?sequence=1&isAllowed=y
JOURNAL OF CHILD AND ADOLESCENT PSYCHOPHARMACOLOGY Volume xx, Number x, 20xxª Mary Ann Liebert, Inc.Pp. 1–9DOI: 10.1089/cap.2014.0063 Disordered Eating and Food Restrictions in Children with PANDAS/PANS Megan D. Toufexis, DO,1 Rebecca Hommer, MD,2 Diana M. Gerardi, MA,1 Paul Grant, MD,2 Leah Rothschild, BA,2 Precilla D'Souza, NP,2 Kyle Williams, MD,3,4 James Leckman, MD, PhD,5 Susan E. Swedo, MD,2 and Tanya K. Murphy, MD, MS1,6
Voralberger AIDS-Gespräche 2012 hiv und depression ursachen, diagnose, behandlung Steffen Taubert – Was weiß oder vermutet die Wissenschaft? – Depression oder nur schlecht drauf? – Was können Betroffene, Angehörige und Professionelle Zahlen über Zahlen: Prävalenz in der Allgemeinbevölkerung Frauen leiden doppelt so häufig an Depressionen, wie Männer (14,2 & vs. 7,6 %) (Quelle: Bundesgesundheitssurvey 1998/99)








