Aus dem physiologischen institut
Aus dem Physiologischen Institut
(Geschäftsführender Vorstand: Prof. Dr. med. Bleich)
der Christian-Albrechts-Universität zu Kiel
DIE WIRKUNG VON CARBAMAZEPIN AUF NEURONALE
UND EPITHELIALE KCNQ-KANÄLE
Inauguraldissertation
Erlangung der Doktorwürde
der Medizinischen Fakultät
der Christian-Albrechts-Universität zu Kiel
Olga Haferkamp
Referent: Prof. Dr. Bleich, Physiologisches Institut
Korreferent: Prof. Dr. Stephani, Klinik für Neuropädiartie
Tag der mündlichen Prüfung: 13.02.2012
Zum Druck genehmigt, Kiel, 13.02.2012
1 Einleitung
1.1 Aufbau und Funktion von Zellmembranen
Jegliche Arten von Zellen sind von einer Membran umgeben, die ihnen Schutz gegenüber
ihrer Umgebung bietet. Sie legt die Ausmaße der Zelle fest und ermöglicht lebenswichtige
Austauschvorgänge. Alle biologischen Membranen bestehen aus einer zusammenhängenden
Doppelschicht aus Phospholipiden, in die verschiedene Membranproteine eingelagert sind.
Dabei orientieren sich die hydrophoben Kohlenwasserstoffe der Phospholipide nach innen,
während die polaren Kopfgruppen dem wässrigen Medium zugewandt sind. Diese Anordnung
verleiht der Zellmembran die abgrenzende Funktion. Die integrierten Membranproteine sind
ebenfalls amphiphil und interagieren mit ihren hydrophoben Transmembrandomänen mit dem
hydrophoben Inneren der Membran und ihren hydrophilen mit dem wässrigen Milieu sowohl
innerhalb als auch außerhalb der Zelle. Das hydrophobe Innere der Lipidmatrix fungiert als
eine Permeabilitätsbarriere für die meisten polaren Moleküle. Erst Membranproteine wie
Rezeptoren, Ionenkanäle und Transporter erlauben einen kontrollierten Ionenfluss und den
Transport von polaren Molekülen (Alberts
et al., 2003). Damit tragen Membranproteine zur
Aufrechterhaltung der intra- und extrazellulären Ionenkonzentrationen bei, regulieren somit
die elektrische Erregbarkeit und die osmotische Bilanz. Außerdem steuern sie die Aufnahme
von Nährstoffen und den Austritt von Abbauprodukten.
1.2 Ionentransport und Membranpotenzial
Die unterschiedlichen Konzentrationen der verschiedenen Ionen im Intra- und
Extrazellulärraum (Tab.1.1) sind Voraussetzungen für die Funktionsfähigkeit der Zellen und
werden durch eine Vielzahl von primär (ATP-abhängigen) oder sekundär aktiven
Transportprozessen (Ionenaustauscher) aufrechterhalten.
Hydrophobe Moleküle, Sauerstoff und Kohlendioxid können die meisten Membranen frei
passieren. Für kleine, ungeladene polare Moleküle wie Glyzerol, Wasser und Harnstoff ist die
Biomembran in begrenztem Umfang durchlässig. Für Ionen und große ungeladene Moleküle
hingegen sind die reinen Lipiddoppelschichten nicht permeabel. Für einen gerichteten
Stofftransport über die Membran sind grundsätzlich zwei verschiedene Prozesse zu
unterscheiden. Der aktive Transport, der häufig an die Hydrolyse von ATP gekoppelt ist und
Substanzen gegen den Konzentrationsgradienten über die Membran pumpen kann und ein
passiver Transport, der entlang vorhandener Konzentrationsgradienten transportiert. Dieser
passive Transport befördert auch Ionen und geladene Moleküle, wobei dieser Prozess nicht
nur vom chemischen Konzentrationsgradienten, sondern auch vom elektrischen Feld abhängt,
das sich durch die Potenzialdifferenz über der Membran aufbaut. Zusammengefasst ergibt
sich hieraus ein elektrochemischer Gradient als Triebkraft des Substratflusses.
Durch das Zusammenspiel von aktiven und passiven Transportprozessen entstehen große
Unterschiede in der Zusammensetzung der intrazellulären und extrazellulären Flüssigkeit.
Ion Extrazellulär (mM) Intrazellulär (mM) Gleichgewichtspotenzial (mV)
Natrium 135 - 145 12 +66
Kalium 3,5 - 5 140 -93
Calcium 2,25 - 2,52 10-4 +123
Chlorid 115 2,5 – 50 -101 − -20
Tabelle 1.1: Ionenkonzentrationen innerhalb und außerhalb der Zelle und ihr Gleichgewichtspotenzial
(nach Ashcroft, 2000)
. Die extrazelluläre Konzentration bezieht sich auf das Serum, während die intrazellulären
Angaben die zytosolischen Konzentrationen von Säugetierzellen repräsentieren. Das Gleichgewichtspotenzial
wurde für 37°C berechnet.
Tabelle 1.1 zeigt die intra- und extrazellulären Konzentrationen für die wichtigsten Ionen.
Auffällig ist eine sehr hohe Konzentration von intrazellulärem Kalium gegenüber dem
Extrazellulärraum. Die Natriumkonzentration hingegen ist um ein Vielfaches höher außerhalb
der Zelle. Durch diese asymmetrische Verteilung der Ionen ergibt sich eine Potenzialdifferenz
über der Membran, wenn diese über eine spezifische Permeabilität für ein solches Ion verfügt.
Für jede Ionensorte X kann eine Spannung EX berechnet werden, bei der sich die Kräfte für
den Einstrom und Ausstrom der Ionen ausgleichen, so dass kein Netto-Ionenfluss über der
Membran zu registrieren ist. Dieses Potenzial nennt man auch Gleichgewichtspotenzial oder
elektrochemisches Potenzial einer Ionensorte. Nach der Nernst Gleichung (Abb. 1.1) lässt
sich dieses Potenzial berechnen.
[
X ]
außen
[
X ]
innen
Abbildung 1.1 : Nernst Gleichung. Dabei ist
R die allgemeine Gaskonstante (8,314 J K-1 mol-1),
T die absolute
Temperatur (310 K bei 37°C),
z die Ladung des Ions und
F die Faraday-Konstante (96485 C mol-1).
[X]außen und
[X]innen stehen für intra- und extrazellulären Aktivitäten (Konzentration mal Aktivitätskoeffizient) eines Ions X.
Berücksichtigt man allerdings, dass die Zellmembran nicht nur für eine Ionensorte permeabel
ist und die Permeabilität für verschiedene Ionen auch unterschiedlich sein kann, so erlaubt die
Goldman-Gleichung (Abb. 1.2) die Berechnung des Membranpotenzials. Diese Gleichung
berücksichtigt für Anionen
A und Kationen
K unterschiedliche Permeabilitäten
P und beruht
auf der Annahme, dass Gleichgewichtsbedingungen herrschen. Da Kalium bei Zellen in Ruhe
die höchste Permeabilität aufweist, liegt das Ruhemembranpotenzial der meisten Zellen in der
Nähe des Kaliumgleichgewichtspotenzials, etwa bei -70mV.
∑
A[ ]
außen
Abbildung 1.2 : Goldman-Gleichung. Dabei ist
R die allgemeine Gaskonstante (8,314 J K-1 mol-1),
T die
absolute Temperatur (310 K bei 37°C),
z die Ladung des Ions und
F die Faraday-Konstante (96485 C mol-1).
P
steht für die Permeabilität der Membran für die entsprechenden Ionen.
[X]außen und
[X]innen stehen für intra- und
extrazellulären Aktivitäten (Konzentration mal Aktivitätskoeffizient) eines Ions X.
Die Permeabilität
P führt bei gegebenen Ionenkonzentrationen zu einem elektrischen Leitwert
G der Membran. Ist die Membran für mehrere Ionenarten permeabel, so ist für die
Gleichgewichtseinstellung entscheidend, welchen Anteil die Einzelleitwerte GK, GNa, und GCl
am Gesamtleitwert der Membran (Gm) ausmachen. Entsprechend kann für ein Ion X ein
fraktioneller Leitwert fx angegeben werden.
Die vereinfachte Variante der Goldman-Gleichung lautet dann:
Wobei X für die jeweiligen Ionen steht. Diese Formel ermöglicht die Berechnung der
Änderung des fraktionellen Leitwertes für Kalium (∆fK) in Abhängigkeit von der Änderung
des Membranpotenzials einer Zelle, z.B. einer Oozyte (∆Em).
E −
E
Dabei steht EK für das Gleichgewichtspotenzial von Kaliumionen (ca.-90mV) und Ex für das
stellvertretende Gleichgewichtspotenzial aller anderen Ionen. Demnach repräsentiert E
x in
diesem Beispiel das Membranpotenzial einer mit Wasser injizierten Oozyte (ca.-40mV), die
keine Kaliumpermeabilität hat.
1.3 Ionenkanäle
Ionenkanäle sind porenbildende Membranproteine, die das Passieren der Biomembran für
geladene Teilchen ermöglichen. Sie kommen in allen Zellen vor und sind z.B. in
Nervenzellen für die Generierung von Aktionspotenzialen verantwortlich (Hille, 2001).
Verschiedene Öffnungs- und Schließmechanismen, die zu einem charakteristischen
Schaltverhalten führen, die Empfindlichkeit gegenüber pharmakologischen Hemmstoffen und
die unterschiedliche Ionenselektivität verleihen den Ionenkanälen ihren speziellen Charakter.
Anhand dieser Eigenschaften können Ionenkanäle beschrieben und eingeteilt werden.
Die direkte Steuerung von Ionenkanälen kann über intrazelluläre Botenstoffe (z.B. Ca2+,
cGMP), durch thermische und physikalische Reize, durch Ionen (z.B. Na+, Ca2+, H+), durch
Lipide (z.B. Arachidonsäure, PIP2) oder durch Veränderung der Proteinstruktur (z.B.
Phosphorylierung, Proteolyse) erfolgen. Darüber hinaus werden bestimmte Ionenkanäle über
Liganden gesteuert. Dabei ist der Kanal entweder selbst der Rezeptor oder der Kanal wird
über einen G-Protein gekoppelten Rezeptor kontrolliert. Ein Beispiel hierfür ist der
muscarinerge M2-Acetylcholinrezeptor. Über M2-Rezeptoren wird am Herzen die
Acetylcholinwirkung vermittelt. Bei Aktivierung öffnen sich Kalium-Kanäle und führen zu
einer Verlangsamung der diastolischen Depolarisation und somit einer Abnahme der
das Membranpotenzial gesteuert. Diese
spannungsgesteuerten Ionenkanäle verfügen über einen Sensor, der auf die
Spannungsänderung an der Membran mit einer Konformationsänderung reagiert, die zur
Öffnung der Pore führt. Diese Proteine haben einen zentralen Stellenwert für die Physiologie
von Nervenzellen und werden in den folgenden Kapiteln näher erklärt.
1.4 Kaliumkanäle und das Aktionspotenzial
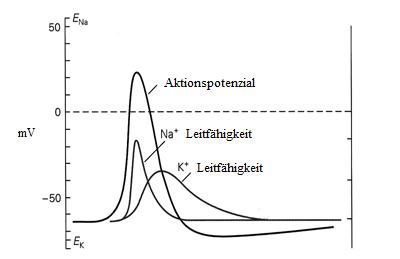
nicht erregbaren Zellen und sind somit an einer Vielzahl unterschiedlicher Prozesse beteiligt.
Durch den Kaliumstrom wird das Membranpotenzial gesteuert und die Repolarisation nach
einem Aktionspotenzial reguliert. Des Weiteren sind Kaliumkanäle an der Freisetzung von
Hormonen und Neurotransmittern, der Rhythmik des Herzschlages und der elektrischen
Erregbarkeit von Neuronen beteiligt. Außerdem spielt der Kaliumtransport eine wichtige
Rolle für die osmotische Bilanz der Zelle. Die Aktivierung dieser Kanäle kann durch die
Änderung des Membranpotenzials, durch den Zellmetabolismus oder durch Transmitter und
Hormone reguliert werden (Hille 2001). Durch die Änderung des Membranpotenzials werden
auch die meisten im Rahmen dieser Arbeit untersuchten Kaliumkanäle aktiviert. In der
Membran von Nervenzellen sind auch spannungsabhängige Natriumkanäle integriert. Wenn
sich das Potenzial über der Zellmembran infolge einer Reizeinwirkung in positiver Richtung
verändert, so sind Natriumkanäle die ersten sich öffnenden Kanalporen. Ist die
Reizeinwirkung so stark, dass ein Potenzial von ca. -50mV erreicht wird, so spricht man von
einem Schwellenpotenzial,
da nun eine lawinenartige Öffnung von weiteren
spannungsabhängigen
und eine schnelle
Membranpotenzials (Abb. 1.3) erfolgt.
Abbildung 1.3 : Aktionspotenzial (von Kandel / Schwartz / Jessel)
Diese Verschiebung des Potenzials in Richtung des Natriumgleichgewichtspotenzials wird als
Depolarisation bezeichnet und beruht also auf einer sich selbst verstärkenden Öffnung von
weiteren Natriumkanälen. Es kommt zu einem Anstieg des fraktionellen Na+- Leitwertes in
der Zellmembran, die auf diese Weise bis zu Werten um +30mV depolarisiert. Während die
spannungsaktivierten Natriumkanäle bereits nach einer Millisekunde inaktivieren und der
Na+-Leitwert wieder auf den Ausgangswert absinkt, steigt etwas verzögert der K+-Leitwert an
und beschleunigt die Repolarisation. Wegen der noch anhaltenden Erhöhung des K+-
Leitwertes kann es zu einer vorübergehenden Absenkung des Membranpotenzials unter den
Ausgangswert kommen, was als Hyperpolarisation bezeichnet wird. Für eine Nervenzelle
bedeutet eine derartige Hyperpolarisation, dass sie in dieser Phase nur schwer erregbar ist.
Dies begrenzt die Frequenz der Aktionspotenziale, gewährleistet eine vollständige
Regeneration der Aktivierbarkeit der spannungsabhänigen Na+ Kanäle und verkürzt die
relative Refraktärphase.
1.5 Familie der KCNQ-Kanäle
Eine besondere Klasse der spannungsabhängigen Kaliumkanäle stellen die KCNQ-Kanäle dar.
Sie umfassen zum heutigen Zeitpunkt fünf Mitglieder (KCNQ1-5) und sind ebenfalls auch
unter der Bezeichnung Kv7.1-5 bekannt. Alle Familienmitglieder dieser Gruppe haben
strukturelle Ähnlichkeiten zu anderen spannungsabhängigen Kaliumkanälen mit sechs
Transmembrandomänen (S1-S6). Dabei steht dem S4-Transmembransegment eine besondere
Aufgabe zu. Diese hochkonservierte Struktur, die in regelmäßigen Abständen innerhalb der α-
Helix positiv geladene Aminosäuren enthält, fungiert als Spannungssensor und induziert die
Kanalöffnung bei Depolarisation der Membran über einen für den Kanal typischen Wert
(Padilla et al. 2009; Panaghie et al. 2007). Desweiteren haben die KCNQ-Kanäle eine
einzelne Porenschleife und zytoplasmatische N- und C-Termini. Dabei ist der sehr lange C-
Terminus, der eine große Variation zeigt (Jentsch 2000), für eine geringere Homologie der
einzelnen Mitglieder innerhalb der Genfamilie verantwortlich. Im Vergleich zu anderen
befindet sich im C-Terminus
Interaktionsdomäne, die für die Zusammenlagerung der vier α-Untereinheiten essentiell ist
(Schwake et al. 2003). Erst durch die Zusammenlagerung von vier α-Untereinheiten, die als
Tetramer eine membranintegrierte Pore bilden, entsteht ein funktionstüchtiger Kanal. Lagern
sich vier identische Untereinheiten zusammen, so bezeichnet man sie als homomer. Diese
Homomere können von allen fünf KCNQ-Mitgliedern gebildet werden. Darüber hinaus sind
auch Heteromere in bestimmten Konstellationen möglich. Während KCNQ3 sowohl mit
KCNQ2, KCNQ4 und KCNQ5 assoziieren kann, ist KCNQ1 nicht in der Lage mit anderen α-
Untereinheiten heteromere Kanäle zu bilden.
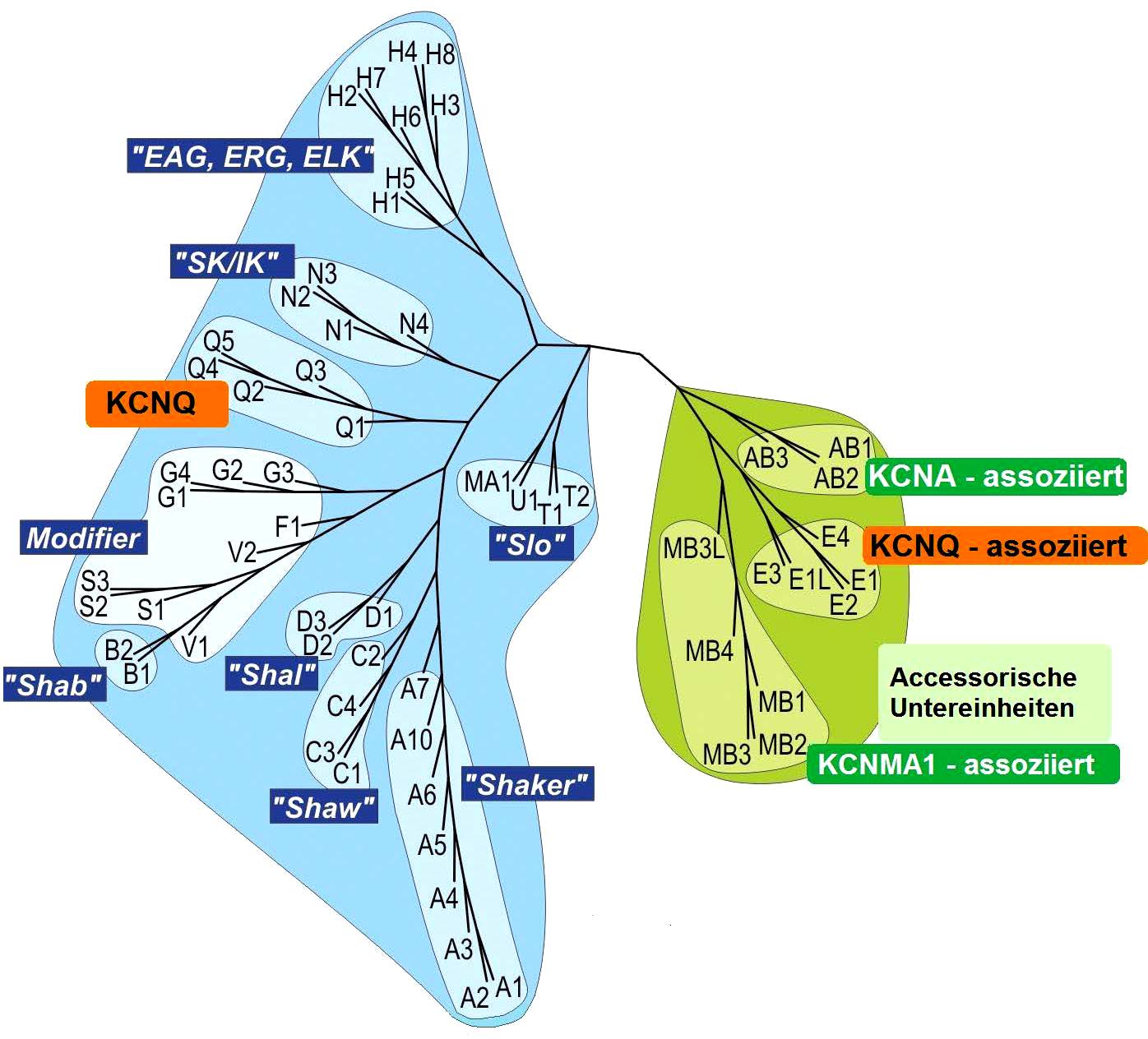
Abbildung 1.4: Zentraler Ausschnitt eines
phylogenetischen Baums der „KCN" K+-
Kanalfamilie. Zur Vereinfachung wurde die
allgemein für K+-Kanäle (KCN) verwendete
Nomenklatur weggelassen. (für KCNE3 steht
z.B. E3). (Modifiziert nach Heitzmann&Warth,
2008).
Zusätzlich können die Kanaleigenschaften durch akzessorische ß-Untereinheiten wie KCNE1
und KCNE3 modifiziert werden. Zu dieser KCNE-Familie gehören fünf Mitglieder (KCNE1-
KCNE5), die alle mit KCNQ1 oder KCNQ4 zu Heteromeren assoziieren können. Weitere
bekannte Interaktionen sind KCNE1 oder KCNE2 mit KCNQ2 und KCNQ3. Dabei sind alle
KCNE-Untereinheiten sehr klein und besitzen nur eine Transmembrandomäne, die einen
extrazellulären N- und einen zytosolischen C-Terminus aufweist. Sie haben alleine keine
Kanalfunktion. Werden sie aber mit KCNQ-Untereinheiten koexprimiert, kann ein
wesentlicher Einfluss auf die biophysikalischen Eigenschaften der Kanäle beobachtet werden
(Lundquist et al. 2006). Ungeklärt ist bislang in welchem stöchiometrischen Verhältnis die
Assoziation erfolgt. Vorstellbar ist, dass jeweils zwei KCNE-Untereinheiten in ein KCNQ-
Tetramer integriert sein könnten, wobei ebenfalls noch ungeklärt ist, ob sie an der
Porenbildung beteiligt sind (Melman et al. 2002; Melman et al. 2004; Tapper et al. 2001).
Neuere Studien geben den Hinweis, dass die Wechselwirkung der C-Termini zwischen der α-
Untereinheit KCNQ1 und der ß-Untereinheit KCNE1 für einen stabilen Komplex
verantwortlich sein könnten (Chen et al. 2009).
Interessant ist diese KCNQ-Kanalfamilie aber auch auf Grund einer anderen Tatsache. Wenn
man bedenkt, dass derzeit über siebzig porenbildende α- und akzessorische ß-Untereinheiten
von Kaliumkanälen kloniert und beschrieben sind (Gutman et al. 2005) und dass bisher nur 10
dieser Kaliumkanäle im Zusammenhang mit erblichen Erkrankungen identifiziert worden
sind, so stellen diese KCNQ-Kanäle mit bekannten Mutationen in vier Genen dieser Familie
(KCNQ1-KCNQ4) eine wirkliche Besonderheit dar (Jentsch et al. 2000).
1.5.1 Physiologische Bedeutung von KCNQ1 und akzessorischen KCNE-Untereinheiten
Die physiologische Bedeutung der KCNQ-Kanäle ist so vielseitig wie ihre funktionelle
Vielfalt, da sie in verschiedenen Geweben mit unterschiedlichen Aufgaben exprimiert
werden. 1996 wurde als erster der KCNQ1 durch positionelle Klonierung identifiziert (Wang
et al. 1996), alle weiteren Familienmitglieder wurden über ihre Homologie zu KCNQ1
kloniert (Biervert et al. 1998; Charlier et al. 1998; Kubisch et al. 1999; Schroeder et al. 2000a;
Singh et al. 1998). Zusammen mit der ß-Untereinheit KCNE1 bilden KCNQ1 ein
Kanalprotein, das sehr stark im Herzmuskel exprimiert wird und dort für den langsam
aktivierbaren Iks-Strom verantwortlich ist. Außerdem ist dieser KCNQ1/KCNE1
Kanalkomplex im Innenohr, in der Niere, Lunge, Bauchspeicheldrüse und in der Plazenta
nachzuweisen (Gutman et al. 2005).
Eine besondere Aufgabe wird dem Iks-Strom in den Herzmuskelzellen zugeschrieben. Dieser
charakteristisch zeitlich verzögerte, langsam aktivierende Strom beschleunigt die
Repolarisation der Kardiomyozyten nach einem Aktionspotenzial. Daher ist es auch
verständlich, dass Mutationen in einer der beiden Untereinheiten zu angeborenen
Herzrhythmusstörungen führen können, die klinisch durch ein verlängertes QT-Intervall im
EKG auffällig werden. Diesem verlängerten QT-Intervall liegt eine verzögerte Repolarisation
zugrunde, weshalb dieses Phänomen auch als Long-QT-Syndrom bezeichnet wird. Diese
Abnormalität in der Repolarisationsphase äußert sich bei den Betroffenen durch Arrhythmien,
die sogar zum plötzlichen Bewusstseinsverlust und Herzstillstand führen können. Zu
unterscheiden sind dabei zwei Syndrome. Das autosomal-dominant vererbte Romano-Ward-
Syndrom und das autosomal-rezessiv vererbte Jervell-Lange-Nielsen-Syndrom (JLNS). Dabei
leiden die JLNS-Betroffenen neben der Neigung zu Herzrhythmusstörungen auch an
angeborener bilateraler Taubheit, was durch die gestörte Funktion der KCNQ1/KCNE1-
Kanäle bei der Endolymphproduktion im Innenohr erklärt werden kann (Rivas et al. 2005;
Warth et al. 2002).
Die biophysikalischen Eigenschaften des KCNQ1-Kanals werden durch eine Verbindung mit
einer anderen ß-Untereinheit, KCNE3, drastisch verändert. Diese Konstellation führt zu
einem konstitutiv offenen Kanal, der einen Strom mit linearer Spannungsabhängigkeit
vermittelt, einen zeitunabhängigen Verlauf aufweist und durch cAMP aktivierbar ist
(Schroeder et al. 2000b). Zu finden ist diese KCNQ1/KCNE3 Koexpression in Kolonkrypten,
wo ein großer Zusammenhang zwischen der Aktivität dieser Kanälen und der cAMP-
aktivierenden Cl-Sekretion zu belegen ist (Bleich et al. 1997; Greger et al. 1997b;
Kunzelmann et al. 2001a; Schroeder et al. 2000b). Einen Überblick liefert das Zellmodell
einer Cl- sezernierenden Enterozyte (Abb. 1.5).
Zunächst zeigt sich eine sehr unterschiedliche Zusammensetzung der Membrantransporter auf
der luminalen gegenüber der basolateralen Seite einer Enterozyte. Für die Aufrechterhaltung
der Ionengradienten sorgt die basolateral sitzende Na-K-ATPase. Der nach innen gerichtete
Na+-Gradient ist die Triebkraft für den ebenfalls basolateral lokalisierten Na/2Cl/K-
Kotransporter (KNCC1), der für die Sekretion notwendige Cl- Ionen in die Zelle aufnimmt.
Abbildung 1.5: Zellmodell der elektrogenen Cl- -Sekretion.
FSK/IBMX erhöht die cAMP-Konzentration, Carbachol (CCh) wirkt hier als Ca2+-Agonist. Beide Signalwege
münden in der Aktivierung der basolateral (bl) sitzenden Kaliumkanäle. Der auswärts gerichtete Kaliumstrom
verstärkt die Hyperpolarisation der Membran und liefert damit die nötige Triebkraft für die luminale (lu) Cl- -
Sekretion durch den CFTR-Kanal. Für die Aufrechterhaltung der Ionengradienten sorgt die Na-K-ATPase.
Die Cl- sezernierenden Enterozyten besitzt in der basolateralen Membran zwei K+-Kanaltypen
mit unterschiedlicher Leitfähigkeit. Der eine wird durch Ca2+ aktiviert (Bleich et al. 1996) und
der andere (KCNQ1/KCNE3) über die Erhöhung der cAMP-Konzentration (Greger, Bleich,
Warth 1997b; Warth et al. 1996). Gut unterscheiden lassen sich die beiden Kaliumkanäle
durch die spezifische Hemmung des KCNQ1/KCNE3 Kanals durch das Chromanol 293 B
(Bleich et al. 1997; Greger et al. 1997a). Werden Kaliumkanäle aktiviert, führt die Erhöhung
des Leitwertes von K+ zu einer Hyperpolarisation der Membran. Erst durch diese
Hyperpolarisation entsteht die notwendige Triebkraft für die luminale Cl-- Sekretion durch
den CFTR-Kanal (Greger et al. 1996). Das ist deshalb wichtig, da die intrazelluläre Cl--
Konzentration (30 mmol/l) kleiner ist als die extrazelluläre (98-106 mmol/l) und der Cl--
Ausstrom nicht durch den chemischen Gradienten getrieben werden kann.
Demnach ist dieser basolateral lokalisierte KCNQ1/KCNE3 Kaliumkanal mitverantwortlich
für die Triebkraft, die für den luminalen Chloridausstrom notwendig ist. Seine Inhibition
würde zu einem fast vollständigen Ausfall elektrogener Sekretion führen (Bleich et al. 1997;
Heitzmann et al. 2008). Dieser KCNQ1/KCNE3 Kanal beschränkt sich nicht nur auf die
Kolonkrypten, sondern ist ebenfalls im Dünndarm, in der Trachea und anderen NaCl-
sezernierenden Epithelien nachzuweisen (Kunzelmann et al. 2001b).
Die Koexpression von KCNQ1 und der ß-Untereinheit KCNE2 wurde in den Parietalzellen
der Magenschleimhaut lokalisiert. Hier scheint dieser Kanal an der Säuresekretion beteiligt zu
sein (Dedek et al. 2001b; Grahammer et al. 2001; Heitzmann et al. 2004).
1.5.2 Physiologische Bedeutung von neuronalen KCNQ-Kanälen
Die übrigen vier KCNQ-Kanäle (KCNQ2-KCNQ5) sind hauptsächlich im neuronalen
Gewebe nachzuweisen, wobei der KCNQ4 Kanal vermehrt in den äußeren Haarsinneszellen
des Innenohrs zu finden ist und den K+-Ausstrom über die basale Membran reguliert
(Kharkovets et al. 2006; Kubisch et al. 1999). In Neuronen übernehmen diese KCNQ-Kanäle
eine wichtige Funktion und werden in Zusammenhang mit dem M-Strom gebracht. Der M-
Strom spielt eine Schlüsselrolle bei der Regulierung neuronaler Erregbarkeit. Er basiert auf
Kalium-Strömen, die bei der Depolarisation langsam aktivieren. Auf diese Weise tragen sie
zur Repolarisation bei und verhindern wiederholtes Feuern von Aktionspotenzialen.
Zuerst wurde der M-Strom von Brown und Adams in sympathischen Neuronen des
Ochsenfrosches beschrieben und später auch im ZNS nachgewiesen (Brown et al. 1980). Im
Laufe der weiteren Jahre wurde der M-Strom auch in peripheren Neuronen identifiziert
(Marrion 1997a). KCNQ2 und KCNQ3 Kanäle zeigen funktionelle und pharmakologische
Charakteristika des neuronalen M-Stroms (Cooper et al. 2000; Wang et al. 1998) und besitzen
gleiche Eigenschaften im Schaltverhalten und in der Sensitivität zu den typischen M-Strom
Blockern Linopirdin und XE991. Außerdem lassen sich diese Kanäle durch Muscarin
inhibieren, wenn der M1-Rezeptor mit koexprimiert wird (Selyanko et al. 2000; Shapiro et al.
2000). Die verwandten KCNQ1, KCNQ4 und KCNQ5 Kanäle werden ebenfalls durch die
Stimulation des muskarinergen M1-Rezeptors inhibiert, was eine Beteiligung weiterer Kanäle
an der Konstituierung des M-Stroms wahrscheinlich macht, da auch KCNQ4 und KCNQ5
typische kinetische und pharmakologische Eigenschaften dieses Stroms aufzeigen (Lerche et
Interessant sind auch die Interaktionsmöglichkeiten dieser KCNQ-Kanäle. Während der
KCNQ2-Kanal Homotetramere und auch Heterotetramere mit KCNQ3 bilden kann, zeigt
KCNQ3 eine größere Interaktionbreite, in dem diese α-Untereinheiten zusätzlich auch mit
KCNQ4 und KCNQ5 assemblieren können (Jentsch 2000; Wickenden et al. 2001). Dabei
kann bei einer Koexpression von KCNQ2/KCNQ3, gegenüber der alleinigen Expression von
KCNQ2, ein bis zu 10facher Anstieg der Stromamplitude beobachtet werden, was
interessanter Weise auf eine erhöhte Anzahl funktioneller Kanäle in der Membran
zurückzuführen ist und nicht auf einen Anstieg der Einzelkanalleitfähigkeit oder der
Offenwahrscheinlichkeit (Schwake et al. 2000).
Die KCNQ2 und KCNQ3 Kanäle werden im ZNS hauptsächlich in Bereichen des Kortex, in
den Basalganglien, einschließlich Substantia nigra, im Hippocampus (Biervert et al. 1998;
Hansen et al. 2008; Schroeder et al. 1998), sowie in sympathischen Ganglienzellen des
Ganglion cervicale superior (Wang et al. 1998) und ebenfalls in peripheren Nerven
exprimiert. KCNQ5-Kanäle werden ebenfalls im ZNS exprimiert, wobei sie auch in anderen
erregbaren Geweben nachzuweisen sind, darunter viszerale glatte Muskelzellen (Jensen et al.
2005; Jepps et al. 2009) und Skelettmuskelzellen (Lerche et al. 2000). Neuere Studien zeigen
erstmals eine Expression von KCNQ5 in glatten Muskellzellen der Gefäßwand (Brueggemann
et al. 2007), was auch andere Studien durch eine quantitative Bewertung des mRNA-Spiegels
in glatten Muskelzellen verschiedener Gefäßtypen der Maus bestätigen (Yeung et al. 2007).
Dabei konnte in der Arteria carotis, femoralis, den mesenterialen Arterien und der Aorta das
Vorkommen von KCNQ4 und KCNQ5 am reichhaltigsten nachgewiesen werden. Seitdem
wird eine neue wichtige Rolle der KCNQ (Kv7) Kanäle im kardiovaskulären System
diskutiert (Mackie et al. 2008).
Mittlerweile reichlich belegt ist die Rolle der KCNQ-Kanäle im ZNS. Dabei zeigen
Veränderungen des M-Stroms einen hochgradigen Effekt auf die neuronale Erregbarkeit, weil
sie als einzige Ströme an der Schwelle von Aktionspotenzialen aktiv sind und ihre langsame
Aktivierung und Deaktivierung entscheidend für die Regulation von repetitiven
Aktionspotenzialen sind (Rogawski 2000). Eine Inhibition des M-Stroms führt daher zu einer
erhöhten neuronalen Erregbarkeit (Jentsch 2000). Dies erklärt, warum Mutationen in
neuronalen KCNQ-Kanälen, mit Ausnahme von KCNQ5, zu unkontrollierter neuronaler
Aktivität führen können.
1.6 Epilepsie und andere Ionenkanalkrankheiten
KCNQ-Kanäle spielen eine wichtige Rolle bei der Regulation des Membranpotenzials vieler
erregbarer Gewebezellen (Delmas et al. 2005; Robbins 2001). So führen Mutationen in den α-
Untereinheiten KCNQ2 und KCNQ3 zur Reduktion des M-Stroms. Bereits eine Verringerung
um rund 25% führt zu dem Krankheitsbild der Neonatalen Epilepsie, das die englische
Bezeichnung benign familial neonatal convulsions (BFNC) trägt (Biervert et al. 1998;
Charlier et al. 1998; Singh et al. 1998). Kurze tonische oder tonisch-klonische Krämpfe, die
stereotypisch am 2. oder 3. Lebenstag einsetzen und nach mehreren Wochen spontan
remittieren, sind charakteristisch für das BFNC-Syndrom. Etwa 15% der Patienten haben
weitere epileptische Anfälle im fortgeschrittenen Alter. Vor einigen Jahren wurde ein weiteres
Syndrom beschrieben, bei dem BFNC von später auftretender Myokymie gefolgt wird (Dedek
et al. 2001a). Myokymie ist eine Muskelerkrankung, die durch spontane, unwillkürliche
Kontraktion von Muskelfasergruppen charakterisiert wird. Im Rahmen dieser Forschung
wurde erstmals gezeigt, dass KCNQ2 und KCNQ3 auch im Vorderhorn des Rückenmarks
exprimiert werden.
1Barhanin et al. 1996; 2Sanguinetti et al. 1996; 3Neyroud et al. 1997 ; 4Wollnik et al. 1997 ; 5Schroeder et al.
2000b ; 6Dedek & Waldegger, 2001 ; 7Grahammer et al. 2001 ; 8Heitzmann et al. 2004 ; 9Wang et al. 1998 ;
10Singh et al. 1998 ; 11Biervert et al. 1998 ; 14Dedek et al. 2001 ; 15Charlier et al. 1998 ; 16Kubisch et al. 1999 ;
17Kharkovets, 2006 ; 19Lerche et al. 2001 ; 20Schroeder et al. 2000a ; 21Brueggemann et al. 2007 ; 22Yeung et
Tabelle 1.2 Expressionsmuster der KCNQ-Gene im Überblick mit den Gen-assoziierten Erkrankungen.
Bisher ist noch keine Erbkrankheit mit KCNQ5 Mutationen in Zusammenhang zu bringen. (1-22 s. Anhang)
Epilepsie gehört mit einer Prävalenz von etwa 0,5 % in Deutschland zu den häufigsten
Erkrankungen des Zentralnervensystems. Man rechnet jährlich mit 20-25 Neuerkrankungen
pro 100 000 Einwohnern und vermutlich 5 % aller Menschen erleiden einmal im Leben einen
epileptischen Gelegenheitsanfall (Poeck 2001). Epileptische Anfälle entstehen durch abnorme
elektrische Entladungen zentraler Neurone im Großhirn und dauern, abgesehen vom Status
epilepticus, nur einige Sekunden bis Minuten. Dabei kann das Bewusstsein erhalten oder
Von den Epilepsien mit genetischer Ursache unterscheidet man die symptomatische
Epilepsie, die aufgrund einer Hirnschädigung, so zum Beispiel durch Hirntumore, zerebrale
Gefäßmissbildungen oder durch traumatische Hirnverletzung entstehen kann. Unter den
idiopathischen Epilepsien finden sich alle Formen, die weder durch Anamnese noch Befund
eine organische oder metabolische Hirnkrankheit erkennen lassen.
Eine erst kürzlich publizierte Studie (Helbig et al. 2009) bringt das Fehlen kleiner
Chromosomenstücke, Mikrodeletion genannt, in Verbindung mit Epilepsie. Diese Studie
zeigt, dass bei den untersuchten Epilepsieerkrankten ein Teil des Chromosoms 15 in der
Region 15q13.3 fehlt. Nicht nur das Fehlen von Erbinformation kann die Körperfunktionen
schwerwiegend beeinflussen, auch die Veränderungen der Erbinformationen können Verlust
oder auch Zugewinn von Funktionen bedeuten. Ein rezessiver Erbgang ist häufig mit
Mutationen verbunden, die zum Funktionsverlust und einer ausgeprägteren Symptomatik
führen. Einige Mutationen führen aber auch zu einem dominant-negativen Effekt, der bei
heterozygoten Individuen zu einer Reduktion der Funktion von über 50% der Ausgangswerte
führt (Hubner et al. 2002).
Das erste ausführliche Beschreiben des Long-QT-Syndroms erfolgte 1957 und geht auf
Jervell und Lange-Nielsen zurück. Sie beschrieben eine achtköpfige norwegische Familie, in
der vier Kinder taubstumm waren. Auffallend in dieser Familie waren die wiederholten
Schwindelanfälle und Bewusstlosigkeiten, zusammen mit einem verlängerten QT-Intervall
im EKG. Drei dieser Kinder verstarben an einem plötzlichen Herztod. Erst später wurde ein
autosomal-rezessiv vererbtes Syndrom mit Innenohrschwerhörigkeit und QT-Verlängerung
als Ursache identifiziert, welches heute unter dem Namen Jervell und Lange-Nielsen-
Syndrom bekannt ist (Neyroud et al. 1997; Wollnik et al. 1997).
Bei etwa 70% der kongenitalen Long-QT-Syndrome liegt eine der autosomal-dominanten
Varianten ohne Hörstörung vor, die auf eine dominant-negative Mutation sowohl in KCNQ1
als auch KCNE1 zurückzuführen ist und als Romano-Ward-Syndrom bezeichnet wird
(Barhanin et al. 1996; Sanguinetti et al. 1996). Auch hier zeigt sich der Einfluss des
Erbganges auf das Ausmaß der Erkrankung, da bei Mutationen mit dominantem Erbgang
noch eine Kanalrestfunktion vorliegt (Hubner, Jentsch 2002).
Eine weitere Kardiomyopathie ist das Brugada-Syndrom. Als eigenständige Erkrankung
wurde es erst in den 90er Jahren des 20. Jahrhunderts identifiziert und den
Ionenkanalkrankheiten zugeordnet. Es handelt sich um eine recht seltene, meist autosomal-
dominant vererbte Erkrankung des Herzens, die im Jugend- und frühen Erwachsenenalter zum
plötzlichen Tod führen kann, obwohl die Patienten scheinbar völlig herzgesund sind. Die dem
Syndrom zu Grunde liegende Repolarisationsstörung der Herzmuskelzellen ist nicht spürbar,
lediglich im EKG können typische Veränderungen auftreten, die aber auch wechselnd
ausgeprägt, oder nur zeitweise vorhanden sein können. Daher kann auch die genaue
Identifikation der betroffenen Mutationen von großer Bedeutung sein, um diese Erkrankung
rechtzeitig zu erkennen und behandeln zu können. Bisher konnte nur bei einem kleinen Teil
der Patienten (15-25%) eine Mutation des Gens SCN5A, das auf dem dritten Chromosom
kodiert ist, identifiziert werden.
Dieses Gen trägt Informationen für einen
spannungsabhängigen Natrium Kanal, das im Falle einer Mutation zu Herzrhythmusstörungen
mehrerer Syndrome führen kann (Moric et al. 2003). Eine neuere Studie (Delpon et al. 2008)
bringt eine Mutation in der ß-Untereinheit KCNE3 in Zusammenhang mit dem Brugada-
Syndrom und zeigt durch Koimmunpräzipitationsstudien, dass KCNE3 in Koexpression mit
einem kardialen Kaliumkanal Kv4.3 im linken Vorhof des menschlichen Herzens
nachzuweisen ist.
1.7 Das Antiepileptikum Carbamazepin
Die Behandlung von Epilepsie ist auf Grund ihrer vielseitigen Ätiologie sehr komplex. Die
Therapieziele werden in erster Linie durch eine geeignete Pharmakotherapie erreicht, wobei
der Wirkstoff Carbamazepin und das strukturähnliche Oxcarbazepin immer noch eine
Hauptrolle unter den therapeutischen Möglichkeiten spielen.
Seit den 50er Jahren des letzten Jahrhunderts findet der Wirkstoff Carbamazepin als
Antikonvulsivum Anwendung und wird speziell zur Behandlung fokaler und sekundär
generalisierter Anfälle eingesetzt (Engel, Jr. et al. 1982; Gado-Escueta et al. 1983).
Carbamazepin wird außerdem auch zur Behandlung von Trigeminus-Neuralgien (Taylor et al.
1981), akuten Manien (Ballenger et al. 1980), Verhaltensstörungen (Lenzi et al. 1986), oder
zur Prophylaxe bipolarer affektiver Störungen (Placidi et al. 1986) eingesetzt. Darüber hinaus
findet es Anwendung als Präventionsschutz vor Krampfanfällen im Benzodiazepin- und
Alkoholentzug, weil die Einnahme von Carbamazepin die Krampfschwelle des ZNS
anzuheben scheint (Barrons et al. 2010).
Der Wirkungsmechanismus von Carbamazepin beruht hauptsächlich auf einer reversiblen
Bindung an spannungsgesteuerte Na+-Kanäle, wobei repetitive neuronale Entladungen
gehemmt werden (McLean et al. 1986; Willow et al. 1984). Diese Hemmung scheint
spannungsselektiv und dosisabhängig zu sein (Courtney et al. 1983; Willow, Kuenzel,
Catterall 1984). Bei der Behandlung von Neuralgien beruht die schmerzlindernde Eigenschaft
vermutlich auf der Hemmung der Reizweiterleitung der betroffenen Nerven im Rückenmark,
beziehungsweise in den Kopfganglien.
Des Weiteren hat Carbamazepin einen antidiuretischen Effekt (Braunhofer et al. 1966), der
bei Diabetes insipidus centralis zu einer Verminderung der Harnmenge und des Durstgefühls
Carbamazepin gehört in die Klasse der trizyklischen Aromaten, wie die Abbildung 1.6 zeigt.
Carbamazepin Carbamazepin-10, 11-Epoxid
Abbildung 1.6: Struktur von Carbamazepin und seines aktiven Metaboliten Carbamazepin-10,11-Epoxid.
Die Resorption von Carbamazepin ist relativ langsam (2-8 Stunden), die Halbwertszeit im
Plasma beträgt ca. 36h nach einer Einzelgabe, wobei man bei medikamentös eingestellten
Patienten eine deutliche Abnahme der Halbwertszeit feststellt. Das liegt wahrscheinlich daran,
dass das Carbamazepin als ein Induktor wirkt und in der Leber die Enzymaktivität seines
abbauenden Enzyms selbst steigern kann (Cascorbi 2003). Es wird über das Cytochrom-P450-
Enzymsystem verarbeitet und eins seiner Folgeprodukte ist das Carbamazepin-10,11-Epoxid
(EPX), das ebenfalls antiepileptische Eigenschaften besitzt. Die Therapie mit Carbamazepin
sollte einschleichend, mit einer niedrigen Initialdosis begonnen werden. Die Festlegung der
therapeutischen Dosis erfolgt über den Plasmaspiegel und in Abhängigkeit von der
Wirksamkeit, wobei der allgemeine Tagesdosisbereich zwischen 400mg und 1200mg liegt
und der Plasmaspiegel 4-12µg/ml (17-50µmol/l) betragen sollte. Eine Überschreitung des
Plasmaspiegels über 20µg/ml hat eine Verschlechterung der Krankheitsbilder zur Folge. Die
Plasmaproteinbindung beträgt 70-80% und unterliegt kaum Schwankungen, da der Anteil der
ungebundenen Anteile bis zu einer Konzentration von 50µg/ml konstant bleibt. Der Metabolit
EPX ist dagegen zu 48-53% an Plasmaproteine gebunden. Die Liquorkonzentration beträgt
33% der jeweiligen Plasmakonzentration.
Zahlreiche Nebenwirkungen sind im Zusammenhang mit der Einnahme von CBZ bekannt
(Möller, 2005). Gerade bei der Einleitung der Therapie oder einer Überdosierung werden
Beeinträchtigungen des ZNS, wie Schwindel, Ataxie oder Erbrechen beobachtet. Häufig
werden auch verminderte Plasmaosmolarität, Hyponatriämie und Ödeme beschrieben.
1.8 Fragestellung
Die Fragestellung der vorliegenden Arbeit beruht auf Befunden, die in ex-vivo Versuchen an
Epithelien gemacht wurden. Auf der Suche nach einer möglichen Erklärung der
Entstehungsursache einer Carbamazepin induzierten Hyponatriämie wurden Ussing-Kammer
Untersuchungen an isolierten Kolonkrypten durchgeführt. Dabei konnte beobachtet werden,
dass Carbamazepin (CBZ) auch direkt auf Epithelien wirkte. Es führte zu einer
dosisabhängigen Inhibition der luminalen, cAMP-abhängigen Chloridsekretion, deren
halbmaximale Wirkkonzentration IC50 sich im therapeutisch wirksamen Bereich befand
(Sievers, 2008). Für die Triebkraft, die für den Chloridausstrom nötig ist, wird der
KCNQ1/KCNE3 Kaliumkanal mitverantwortlich gemacht (Bleich et al. 1996; Greger et
al.1997a; Warth et al. 1996). Hieraus entstand die Hypothese, dass KCNQ1/KCNE3 durch
CBZ gehemmt werden könnte. In diesem Falle wäre es dann wiederum naheliegend, eine
Wirkung auf weitere Vertreter der KCNQ Familie zu überprüfen, da das Antikonvulsivum
CBZ seine Hauptwirkung auf spannungsgesteuerte Natriumkanäle entfaltet (Willow et al.
1984), die in Neuronen, besonders am Axonhügel mit einer großen Dichte
spannungsgesteuerter KCNQ-Kanäle kolokalisiert sind (Maljevic et al. 2008).
Zentrale Fragestellungen dieser Arbeit sind:
1) Welche Wirkung zeigt CBZ auf epitheliale KCNQ1/KCNE3 Kanäle und möglicherweise
auch auf KCNQ1/KCNE1 Kanäle?
2) Sind neuronale KCNQ Kanäle in die antikonvulsive Wirkung von CBZ involviert?
3) Welchen Einfluss zeigt der pharmakologisch aktive Metabolit Carbamazepin-10,11-Epoxid
(EPX) auf KCNQ-Kanäle?
2 Materialien und Methoden
2.1 Chemikalien und Enzyme
Es wurden, soweit nicht anders angegeben, Standardchemikalien der Firma Carl Roth
(Karlsruhe, D) verwendet, die ausschließlich in den Qualitätsstufen reinst oder p.a. zur
Anwendung kamen. Die Restriktionsendonukleasen und andere DNA-modifizierende Enzyme
stammten von Fermentas GmbH (St. Leon-Rot, D). Die zur Entfernung der follikulären
Zellen verwendete Kollagenase A und das Narkotikum Tricain stammen von der Firma
SIGMA. Das Carbamazepin (Tegretal®) und sein Metabolit Carbamazepin-10,11- Epoxid
wurden von der Firma Novartis zur Verfügung gestellt.
2.2 Puffer, Lösungen und Bakteriennährmedien
Collagenase-Lösung 100mM NaCl, 2mM KCl, 1mM MgCl2, 5mM
HEPES, 2mg/ml Kollagenase A, pH 7,4;
anschließend steril filtrieren
DEPC-H2O 0,1 % DEPC, 12h bei 37 °C inkubiert,
anschließend autoklaviert
DNA-Auftragspuffer 30% (v/v) Glycerin; 50mM EDTA; 0,001 %(w/v)
Xylencyanol; 0,001 % (w/v) Bromphenolblau ND96-Lösung 96mM NaCl, 2mM KCl, 1,8mM CaCl2, 1mM MgCl2, 5mM HEPES, pH 7,4, autoklaviert 20x TAE-Puffer 0,8M Tris, 0,2M NaAcetat, 20mM NaEDTA, pH 7,8
Luria-Bertani-Medium (LB) 10g Bactotrypton, 5g Hefeextrakt, 10g NaCl
Ad 1000ml dH2O, pH 7,0
LB+Amp-Medium LB-Medium + 50mg/l Ampicillin
LB+Amp/Agar LB+Amp-Medium + 15g/l Bacto-Agar
LB/ Agar LB-Medium + 18 g/l Bacto-Agar
LB+Tetrazyklin-Medium 50ml LB-Medium + 20mg/l Tetrazyklin
2.3 Plasmid
Zur Herstellung der cRNA für die Mikroinjektion in Xenopus laevis Oozyten wurde der
pTLN Vektor verwendet. Hierbei handelt es sich um eine Modifikation des pSP64T Vektors,
der zur Expressionssteigerung die 5 - und 3 - untranslatierten Regionen des Xenopus ß-
Globulins enthält. Um die Linearisierung des Vektors zu erleichtern wurden für die
Abwandlung mehrere zusätzliche Restriktionsstellen hinter die kodierten Bereiche eingefügt
(Lorenz et al. 1996). Für die Transkription der Gene besitzt dieser Vektor unter anderem
einen SP6-RNA-Promotor.
Zur Vermehrung der Plasmidvektoren in Escherichia Coli -Bakterien wurde der Stamm XL-
1-blue verwendet.
2.4 Mikrobiologische Methoden
2.4.1 Herstellung elektrokompetenter Zellen
Zur Kultivierung der bei -80 °C gelagerten Glycerin-Dauerkultur von XL-1-Blue Bakterien
wurde ein Teil sequentiell auf eine LB-Agarplatte (+Tetracyclin) ausgestrichen und über
Nacht bei 37°C gelagert. Eine der Einzelkolonien wurde zum Animpfen einer 50ml
LB+Tetracyclin-Vorkultur (20mg/l Tetracyclin) verwendet und anschließend bei 37 °C über
Nacht inkubiert. Von dieser Vorkultur wurden 20ml für eine weitere Anzucht von einer 1 l-
LB-Medium-Kultur verwendet und bis zum Erreichen der exponentiellen Wachstumsphase
mit einer optischen Dichte von 0,5-0,6 bei 37°C kultiviert. Nach dem Sedimentieren (15min.,
5000Upm, 4 °C, Beckman J2-HS Zentrifuge) wurde der Überstand verworfen und das
Bakterienpellet in 100ml autoklaviertem und auf 4 °C vorgekühltem dH2O resuspendiert, um
anschließend wieder zentrifugiert zu werden. Diese Waschung erfolgte ein zweites Mal. Um
die bevorstehende DNA-Aufnahme der Zellen zu begünstigen wurde das Pellet in 40ml
zehnprozentiger Glycerinlösung aufgenommen und in 50ml Röhrchen überführt. Nach einem
erneuten 20minütigen Zentrifugieren bei 3200Upm und 4 °C wurde der Überstand verworfen
und das Pellet in 4ml zehnprozentigen Glycerinlösung gelöst, anschließend wurde es in 50µl
Aliquots auf Trockeneis schockgefroren. Bis zur weiteren Verwendung erfolgt die Lagerung
2.4.2 Transformation von Bakterien durch Elektroporation
Als Transformation wird die Aufnahme von DNA-Molekülen in kompetente Bakterienzellen
bezeichnet. Die gerichtete Aufnahme ausgewählter Plasmid-DNA durch verwendete E.coli
Stämme XL-1Blue erfolgte durch Elektroporation mit einem Genepulser (BioRad,
Deutschland). Dazu wurden 1µl eines Ligationsansatzes mit 50µl frisch aufgetauten
Bakteriensuspension in einer vorgekühlten Elektroporationsküvette (PeqLab, Erlangen, D)
vereinigt und anschließend mit einem Spannungsimpuls von 2,5kV geschockt. Zur Erholung
wurden die transformierten Zellen in 1ml LB-Medium aufgenommen und für 30-60Minuten
bei 37°C inkubiert. Daraufhin erfolgte ein Zentrifugationsschritt bei 6.000Upm für zwei
Minuten. Der Überstand wurde bis auf 100µl verworfen und das Pellet im verbliebenen
Medium resuspendiert, bevor es mit Hilfe eines Drigalski-Spatels auf LB-Amp/ Agar-Platten
(50mg/l Ampicillin) ausplattiert wurde. Nach 14-20 stündiger Inkubation bei 37°C wurde die
DNA mittels Mini- oder Midipräparation aus den Bakterien isoliert.
2.4.3 Präparation von Plasmid- DNA
Mittels alkalischer Lyse wurde die Plasmid DNA aus den Bakterienzellen isoliert. Kleinere
Mengen DNA konnten aus 3ml-Kulturen durch eine Minipräparation gewonnen werden.
Dazu wurde das E.Z.N.A. Plasmid Miniprep Kit 1 (PeqLab, Erlangen, D) gamäß der
Gebrauchsanleitung verwendet. Um größere Mengen an DNA isolieren zu können, wurden
100ml Bakteriensuspensionen strikt nach dem Protokoll des Jetstar Plasmid Purification MIDI
Kits (Genomed, Löhne, D) behandelt.
Anschließend wurde die präparierte Plasmid-DNA in 50-100µl dH2O aufgenommen und mit
einem DNA-Photometer quantifiziert.
2.4.4 Konzentrationsbestimmung durch Extinktionsmessung
Zur Bestimmung der DNA-Konzentration wurde das Gene Qaunt Pro Photometer
(Cambridge, GB) verwendet. Das Kalibrieren des Photometers erfolgte durch Bestimmung
des Nullwertes für das verwendete Lösungsmittel (dH2O). Die einzelnen Proben wurden dann
in 100µl Quarzküvetten bei Wellenlängen von 230nm, 260nm und 280nm gemessen. DNA-
Moleküle haben ein Absorptionsmaximum bei 260nm, daher ergab sich bei dieser
Wellenlänge für eine optische Dichte von 1 die Konzentration von 50µg/ml an
doppelsträngiger DNA. Die relativen Werte der anderen beiden Wellenlängen zeigen den
Grad der Verunreinigung zum Beispiel durch Salze und wurden vom relativen Wert für die
DNA-Moleküle subtrahiert.
2.5 Molekularbiologische Methoden
Um eine ausreichende Menge an gewünschter DNA zur Verfügung zu haben, musste diese
vermehrt werden. Hierfür werden DNA-Vektoren eingesetzt, die am häufigsten als Plasmide
verwendet werden. Plasmide (Kap.2.3) sind kleine ringförmige DNA-Moleküle, die mit
anderen DNA-Fragmenten kombiniert werden können, um anschließend in Bakterien
vervielfältigt zu werden, ohne sich in das bakterielle Genom zu integrieren. Zunächst wird die
vorhandene DNA mit einem Restriktionsenzym geschnitten, genau wie das Plasmid
(Kap.2.5.1). Beide Fragmente werden ligiert (Kap.2.5.2), in Bakterien eingebracht (Kap.2.4.1
und 2.4.2) und anschließend kultiviert. Nachdem das Plasmid in den Bakterien repliziert
wurde, erfolgt eine Isolierung, Aufreinigung (Kap.2.4.3) und Konzentrationsbestimmung
(Kap.2.4.4). Damit der gewünschte Informationsträger in Form von cRNA in die Oozyte
injiziert werden kann, muss die DNA zuvor in cRNA transkribiert werden (Kap.2.5.3)
2.5.1 Restriktionsverdau
Dieser Vorgang beschreibt die Behandlung der DNA mit Restriktionsenzymen, die in der
Lage sind spezifische Sequenzen zu erkennen und an benötigten Stellen die
Phosphodiesterbrücken zu spalten.
Mit Hilfe von geeigneten Puffersystemen und einer Restriktionsendonuklease der Firma
Fermentas (St. Leon-Rot, D) wurden insgesamt 2µg Plasmid DNA zum Restriktionsverdau
angesetzt und bei 37°C für mindestens zwei Stunden inkubiert. Dabei wurde je nach
Verwendung und Verträglichkeit der Restriktionsenzyme ein Doppelverdau angesetzt oder
die Ansätze wurden nacheinander verdaut. Um eine Selbstligation der gerade linearisierten
Plasmid DNA Moleküle zu verhindern, wurde den Reaktionsansätzen 1 Unit/µl alkalische
Phosphatase (CIAP; Fermentas GmbH, St. Lorenz-Rot; D) hinzugefügt und für eine weitere
Stunde bei 37°C inkubiert. Damit wurde das 5 -Ende der Plasmid DNA dephosphoryliert.
Anschließend wurde die Probe elektrophoretisch aufgetrennt, um zu erkennen, ob die DNA
vollständig geschnitten wurde.
2.5.2 Ligation von DNA Fragmenten
Als Ligation wird die Vereinigung zweier DNA-Moleküle bezeichnet. Die dabei benötigte
DNA-Ligase katalysiert die Bildung neuer Phosphodiesterbrücken. Auf diese Weise können
die komplementären einzelsträngigen Enden eine Basenpaaarung eingehen.
Dazu wurden die geschnittenen linearisierten DNA-Fragmente mit dem dephosphorylierten
Vektor im Verhältnis 7:1 gemischt und mit dem T4-Ligase-Puffer sowie 1U der T4-DNA-
Ligase (Fermentas GmbH, St. Leon-Rot, D) versetzt. Er folgte eine über Nacht Inkubation bei
17°C, mit dem Ziel der Synthese von doppelsträngiger, ringförmig geschlossener Plasmid
DNA, die das gewünschte Insert beinhaltet. Um die T4-DNA-Ligase zu inaktivieren wurde
der Reaktionsansatz kurzzeitig mit Hitze behandelt (10 min; 65 °C) und konnte anschließend
für die Transformation verwendet werden.
Als Kontrolle diente der gleiche Reaktionsansatz mit Ausnahme von linearisierten DNA-
Fragmenten, da der dephosphorylierte Vektor selbst in Anwesenheit einer DNA-Ligase nicht
wieder religieren kann und als Kontrolle nach der Transformation keine Klone aufweist.
2.5.3 In-vitro-Transkription von DNA in cRNA
Um die Injektion von Xenopus leavis Oozyten durchführen zu können, mußte die
plasmidkodierte cDNA in komplementäre cRNA umgeschrieben werden.
Zunächst wurden 4µg Plasmid-DNA mit der Restriktionsendonuklease HpaI linearisiert, in
dem sich die Schnittstelle in 3 -Richtung hinter der Polyadenylierungssequenz im
Plasmidvektor pTLN befand. Es folgte eine Aufreinigung des linearisierten Plasmids mit
High Pure PCR Product Purifikation Kit (Roche, Mannheim), mit anschließender Aufnahme
in 50µl DEPC-H2O. Um die emfindliche RNA nicht zu zerstören, wurde unter RNase-freien
Bedingungen gearbeitet.
Die cRNA-Synthese erfolgte mit dem mMessage mMachine Kit (Ambion, Austin, Texas)
unter Verwendung der SP6-Polymerase gemäß der Anleitung. Dazu wurden 3µl linearisierte
DNA, 5µl NTP-Mischung, 1µl 10x Reaktionspuffer und 1µl SP6-Enzym Mix vermischt und
bei 37°C für 2 Stunden inkubiert. Anschließend wurde die RNA mit 12,5µl LiCl und 15µl
DEPC-H2O für mindestens 30 min bei -20°C gefällt und durch Zentrifugation (20min,
14000U/min, Kühlzentrifuge, 4°C) pelletiert. Es folgte eine Waschung mit 250µl 70%
Ethanol. Danach wurde erneut für 10min pelletiert und anschließend im Schüttler bei 37°C
luftgetrocknet, damit das Ethanol entweichen konnte.
Gleich im Anschluß daran wurde die RNA im 13µl RNase- freien DEPC-H2O resuspendiert.
Zur Konzentrationsbestimmung mit dem Photometer und zur elektophoretischen Auftrennung
wurden jeweils 1µl dieser Resuspension verwendet.
Nach einer erfolgreichen Synthese und Qualitätskontrolle wurde die cRNA bei -20°C
eingefroren oder gleich in Xenopus laevis Oozyten injiziert.
2.5.4 Agarosegelelektrophorese
Die Nukleinsäuren haben aufgrund der negativen Nettoladung der Phosphatgruppen die
Fähigkeit im elektrischen Feld zur Anode zu wandern, wobei die
Wanderungsgeschwindigkeit von der Größe der Moleküle abhängig ist.
Zur Analyse von DNA-Fragmenten durch elektophoretische Auftrennung wurden
Agarosegele (1% bis 1,5% Agarose in TAE) verwendet. Zur Anfärbung der DNA wurde den
Gelen Ethidiumbromid zugesetzt. Vor dem Auftragen der Proben wurde die DNA mit 1/10
Volumen DNA-Auftragspuffer versetzt. Die anschließende Auftrennung erfolgte in TEA-
Puffer für 30min bei einer Spannung von 140 V (Spannungsguelle PowerPac 300, Biorad,
Hercules, USA). Die Größe der Fragmente wurde mit einem Größenstandard, dem 1 kb -
Marker von Invitrogen (Karlsruhe, D) verglichen. Nach dem Auftrennen wurden die Proben
auf einem UV-Transilluminator (Reprostar, Camag, Mattenz, CH) analysiert und
gegebenenfalls mit einem Skalpell aus den Gelen herausgeschnitten. Mit Hilfe des High Pure
PCR Product Purification Kits (Roche, Mannheim, D) konnten die DNA- Fragmente aus der
Gelmatrix isoliert und aufgereinigt werden.
Um eine Degradation der cRNA ausschließen zu können, wurde die Gelelekrophorese zur
Integritätskontrolle verwendet. Dazu wurde 1µl cRNA mit dem Auftragspuffer aus dem SP6
mMessage mMachine Kit (Ambion, Austin, TX, USA) versetzt und anschließend auf ein
nicht-denaturierendes Agarosegel aufgetragen. Die Auftrennung erfolgte bei 140V und zur
Visualisierung wurde auch hier Ethidiumbromid verwendet.
2.6 Elektrophysiologische Methoden
Die elektrophysiologischen Untersuchungen dieser Arbeit wurden an Oozyten des
afrikanischen Krallenfrosches Xenopus laevis (Abb. 2.1) durchgeführt. Aufgrund der
niedrigen Dichte endogener Kaliumkanäle und der einfachen Handhabung, bedingt durch die
Größe der Zellen, wurden die Xenopus Oozyten als Expressionssystem ausgewählt. Es stellt
ein etabliertes System dar, das die Messung von Ionenkanälen erlaubt (Stuhmer 1992). Zu
diesem Zweck wurde die cRNA von ausgewählten Kaliumkanälen in Oozyten injiziert und
die Wirkung der inkubierten Substanzen mit der Zwei-Elektroden-Spannungsklemme
2.6.1 Oozytenpräparation
Für die Entnahme der Oozyten eignen sich ausgewachsene weibliche Xenopus laevis
Frösche, die in einer 0,25% Tricain-Lösung narkotisiert wurden. Das Froschweibchen wurde
direkt aus dem Hälterungsbecken in eine Plastikwanne gesetzt, die mit der auf 4 °C gekühlten
Narkoselösung gefüllt war. Das Herausspringen des Frosches verhinderte ein Wannendeckel.
Nach etwa 10 bis 15 Minuten wurde die gewünschte Narkosetiefe erreicht. Als Kontolle
diente die reaktionslose Rückenlage des Frosches. Das über die Haut aufgenommene
Narkotikum wurde nach der Oozytenpräparation wieder auf dem gleichen Wege mit
Leitungswasser ausgewaschen.
Um den Stoffwechsel des Versuchstieres auf ein Minimum zu reduzieren und somit die
Narkosetiefe möglichst konstant zu halten wurde der Frosch auf eine eisgekühlte
Operationsunterlage gelegt. Um das Austrocknen der übrigen Körperteile zu verhindern
wurde das Operationsfeld mit feuchten Zellstofftüchern eingegrenzt.
Die erste Schnittführung erfolgte am Unterbauch, in Verlängerung zum Oberschenkel, mit
einer Schnittlänge von 10-15mm und durchtrennte die Bauchhaut. Mit einem zweiten Schnitt
in gleicher Richtung wurde die Muskelfaszie und die Muskelschicht durchgetrennt sowie das
Peritoneum eröffnet. Der geschaffene Zugang zum Bauchraum gewährte Einblick auf das
Mesovar. Nach der Begutachtung des Ovarialsäckchens erfolgte die Entnahme durch einen
feinen Scherenschnitt, der die gewünschte Oozytenmenge von der in situ verbleibenden
separierte. Anschließend wurde das Oozytensäckchen in eine sterile Petrischale mit
Kollagenaselösung gelegt und mit feinen Pinzetten portioniert.
Um die Operationswunde zu versorgen, wurden drei bis vier Knopfnähte gesetzt, wobei die
Muskelschicht mit der Faszie zuerst vernäht werden musste. Anschließend erfolgte die
Wiederherstellung einer intakten Hautoberfläche. Als Nahtmaterial wurde ein resorbierbares
Polyglactin (Ethicon, Vicryl rapid, Polyglactin geflochten, resorbierbar, steril) verwendet.
Nach der Wundkontrolle wurde das Tier in ein Aufwachbecken mit Leitungswasser gelegt,
das auf der einen Seite das Einfließen des Wassers und auf der anderen Seite einen Abfluss
ermöglichte, um die Aufwachphase des Tieres zu beschleunigen. Dabei musste beachtete
werden, dass sich die Atmungslöcher des Frosches über der Wasseroberfläche befanden, der
Körper aber ausreichend feucht gehalten wurde.
Nachdem sichergestellt wurde, dass das Tier aufgewacht war, erfolgte das Umsetzen für 24
Stunden in ein separates Becken, bevor es zu seinen Artgenossen zurückgesetzt werden
Eine erneute Oozytenpräparation des gleichen Tieres war in Abständen von sechs bis acht
Wochen möglich.
2.6.2 Vorbereitung und Selektion der Oozyten
Nach einer zwei- bis dreistündigen Inkubation des Oozytensäckchens in Ca2+-freier
Kollagenaselösung bei Raumtemperatur und unter leicht schüttelnden Bedingungen waren die
Oozyten frei von Blutgefäßen, Follikelzellen und Bindegewebe. Durch das mehrmalige
Waschen mit ND96-Lösung wurden die Oozyten für die Selektion vorbereitet und die
Kollagenase deaktiviert.
Für die elektrophysiologischen Untersuchungen eignen sich Oozyten der Reifephasen V und
VI, die aufgrund ihrer Größe (V 0,6-1mm und VI 1-1,2mm) und scharfen Abgrenzung der
beiden Pole leicht von den früheren Phasen zu unterscheiden waren. Nach der Selektion mit
Hilfe einfacher Plastik-Einmalpipetten (Sarstedt, Nümbrecht,D) unter einem
Binokularmikroskop wurden die Oozyten bis zur Injektion der cRNA für mehrere Stunden
oder über Nacht in einem Inkubator (Binder, D) bei konstant 17° C gelagert.
2.6.3 Mikroinjektion von cRNA
Für die Injektion der cRNA in die Xenopus laevis Oozyten wurden Glaspipetten (Drummond
scientific, USA) mit Hilfe eines Horizontal-Pipettenziehgerätes (DMZ-Universal-Puller;
Zeitz-Instrumente, Augsburg) gezogen, mit Mineralöl DC200 (Sigma-Aldrich) gefüllt und in
ein WPI Nanoliter 2000 Mikropipetten-Injektionsgerät (World Precision Instruments,
Sarasota, USA) eingespannt. Die zuvor hergestellte cRNA wurde auf das benötigte
Mischungsverhältnis gebracht, bevor sie injiziert werden konnte. Die Gesamtmenge der
cRNA setzte sich bei Co-Injektionsexperimenten im Verhältnis 1:1 aus den einzelnen cRNAs
zusammen, wobei die cRNA der KCNE1 und KCNE3 Untereinheiten zunächst auf 1:10
verdünnt wurde.
Die eisgekühlte cRNA wurde vor dem Aufziehen mit der Mikropipette auf einen gespannten
Parafilm pipettiert und somit verhindert, dass die Pipettenspitze bei der Aufnahme abbrach.
Unter einem Binokularmikroskop (Zeiss, Deutschland) erfolgte die Injektion von 50nl pro
Oozyte (Konzentration 0,5µg/µl) mit Mikropipetten mit einer Öffnung von 5-10µm
Durchmesser. Die Spitze der Pipette wurde zuvor mit einem sterilen Instrument angeschrägt
und besaß die Form einer Kanüle. Durch diese Maßnahme wurde das Einstechen erleichtert
und die Beschädigung der Zellen bei der Injektion möglichst gering gehalten.
Die anschließende Aufbewahrung der Oozyten erfolgte in ND96-Lösung separiert auf sterilen
96 Loch-Platten (Sarstedt, Nümbrecht, D) im Inkubator bei 17°C.
Als Kontrolle dienten Zellen, die lediglich mit dem RNA-Lösungsmittel (DEPC-H2O)
injiziert wurden.
2.6.4 Die Methode der Zwei-Elektroden-Spannungsklemme
Drei bis vier Tage nach der cRNA-Injektion wurden die Xenopus Oozyten mit Hilfe der Zwei-
Elektroden-Spannungsklemm-Methode elektrophysiologisch untersucht. Dieses Verfahren
erlaubt die Messung des Stromflusses durch die Kanäle in der Oozytenmembran in
Abhängigkeit vom Membranpotenzial. Die sich dabei verändernden Ströme konnten unter
Verwendung eines Turbo Tec 05x Verstärkers (npi electronic GmbH, Tamm, D) registriert
und mit Hilfe des Digidata 1322A Umwandlers (Axon Instruments, USA) in digitale Signale
konvertiert werden. Unter Anwendung der Software pCLAMP 9.2 wurden die Pulsprotokolle
gesteuert, an einen PC geleitet und ausgewertet.
Diese Messtechnik, die auf Cole und Curtis zurückgeht und auf den Untersuchungen von
Hodgkin und Huxley am Axon des Tintenfisches basiert, wurde nach Stühmer (Stuhmer et al.
1992) modifiziert und angewendet.
Zu diesem Zweck wurden Messelektroden aus Borosilikatglas-Filamentkapillaren (Clark
Electromedical Instruments, Reading, GB) mit Hilfe das Horizontal-Pipettenziehgerätes
(DMZ-Universal-Puller; Zeitz-Instrumente, Augsburg) hergestellt und anschließend
luftblasenfrei mit 2M KCl-Lösung befüllt. Durch das Aufschieben dieser Kapillare auf den
Elektrodenhalter, der zentral einen chlorierten Silberdraht enthielt, wurden die Spannnungs-
und Stromelektroden für das Experiment vorbereitet. Vor jeder Messung erfolgte eine
Widerstandsmessung der einzelnen Elektroden, die nur dann verwendet wurden, wenn die
Widerstände im Bereich von 0,5-1,5 MΩ lagen. Die Referenzelektroden wurden in Kammern
mit 2M KCl-Lösung verschraubt und standen über Agarbrücken (1% Agarose) in Verbindung
mit der Messkammer. Die in einer Vertiefung der Messkammer liegende Oozyte wurde über
ein Schwerkraft-getriebenes Perfusionssystem ständig mit frischer ND96-Lösung umspült und
durch eine am Kammerabfluss angeschlossene Saugpumpe wurde für ein gleichbleibendes
Lösungsvolumen gesorgt. Auf diese Weise konnten die unterschiedlichen Konzentrationen
der Wirksubstanzen mit dazwischen liegenden Auswaschphasen eingesetzt werden.
Abbildung 2.2: Schematische Darstellung eines Zwei-Elektroden-Spannungsklemmmsystems. Die Strom-
(I) und die Spannungselektrode (V) sind in eine Xenopus Oozyte hineingestochen, die sich in einer
Kontrolllösung befindet. Durch Anlegen von Kommandopulsen kann der Stromfluss in Abhängigkeit von der
Änderung des Membranpotenzials gemessen werden. Der induzierte Strom spiegelt dabei den Gesamtstrom
durch alle zu eine definierten Zeitpunkt geöffneten Ionenkanäle zuzüglich des Betrages anderer elektrogener
Transportprozesse wider.
Unter einem Binokular (Zeiss, Jena, D) wurden die Potenzial- und Stromelektrode mittels
Mikromanipulatoren
vorsichtig in die Oozyte hineingestochen. Die aktuelle
Potenzialdifferenz zwischen dem Inneren der Oozyte und der Badlösung, deren Potenzial
definitionsgemäß null Volt beträgt, konnte durch die Spannungselektrode gemessen werden.
Mit Hilfe der Stromelektrode konnte der Oozyte ein, vom Ruhezustand abweichendes
Membranpotenzial aufgezwungen werden.
Zu unterscheiden sind grundsätzlich zwei Messmethoden. Der voltage clamp
(Spannungsklemme) und der current clamp Modus (Stromklemme). Beim voltage clamp
Modus wird ein Potenzial, das als Klemmspannung bezeichnet wird, durch das Anlegen eines
Injektionsstromes über die Stromelektrode auf einen festen Wert eingestellt und konstant
gehalten. Weicht das über die Spannungselektrode gemessene tatsächliche Membranpotenzial
von dem eingestellten Klemmpotenzial ab, so wird das über eine Messeinrichtung registriert
und durch die Veränderung des Injektionsstromes dem eingestellten Sollwert angeglichen.
Der Injektionsstrom entspricht dem Gesamtfluss an geladenen Teilchen durch alle
Ionenkanäle und elektrogenen Transportprozesse in der Oozytenmembran.
Im Gegensatz zur Spannungsklemme wird im current clamp Modus der Strom konstant
gehalten, während das Potenzial als variable Größe erfasst wird. Das Membranpotenzial
entspricht dem Wert bei der Stromstärke null.
Bei beiden Messmethoden ist die Berechnung des Widerstandes über das Ohm sche Gesetz
Abbildung 2.3: Ohm sches Gesetz. R steht für Widerstand [in Ohm], U für das Membranpotenzial [in Volt]
und I für den Strom [in Ampere].
Das Ohm sche Gesetz beschreibt die Beziehung zwischen dem Membranpotenzial und der
Größe des Membranstromes. Der Leitwert der Zellmembran (G) kann dabei aus der Steigung
der Strom/Spannungskurve ermittelt werden und verhält sich ungekehrt proportional zum
Um den Stromfluss über die Membran messen zu können, musste zunächst ein geeignetes
Versuchsprotokoll gewählt werden. Die Oozyte wurde, ausgehend von einem Haltepotenzial
von -80 mV in jeweils 10 mV Schritten von -90mV bis +40 mV geklemmt. Die jeweiligen
Klemmschritte wurden 500ms lang gehalten, anschließend folgte eine 200ms lange
Klemmperiode bei -30mV (Abb. 2.4 C). Zwischen zwei Klemmprotokollen war eine Pause
von 30s bei einem Haltepotenzial von -80mV. Abweichende Protokolle sind jeweils
Wenn also ein bestimmtes Kanalprotein stark exprimiert wird, so repräsentiert der Stromfluss
über die Membran nahezu ausschließlich den Stromfluss durch diesen Kanal. Das wird auch
deutlich beim Vergleich der Ableitungsbeispiele Abb. 2.4 A und B. Werden die
Membranströme, die bei den verschiedenen Klemmspannungen gemessen wurden, gegen die
Spannung aufgetragen, so ergibt sich eine Strom-Spannungs-Kurve (Abb. 2.4 D). Ein
charakteristischer Parameter ist die Steigung (Zellmembranleitwert G). Die im Rahmen dieser
Arbeit ausgewerteten Ergebnisse zeigen den Zellmembranleitwert G bei jeweils drei
Spannungen an (-80mV; 0mV; 30mV).
-100 -80 -60 -40 -20
Abbildung 2.4: Spannungsprotokoll, Ableitungsbeispiele und Darstellung einer IV-Kurve. Dargestellt ist
ein typisches Ableitungsbeispiel einer mit KCNQ1 cRNA injizierten Oozyte (B) gegenüber einer nur mit H2O
injizierten (A). Zur Anwendung kam das Spannungsprotokoll C. Werden die Membranströme, die bei
verschiedenen Klemmspannungen generiert wurden gegen die Spannung aufgetragen, so entsteht eine Strom-
Spannungs-Kurve (D). Der Zeitraum für die Messung des jeweiligen Stromes lag hier zwischen 600-680ms.
Um die Effekte von Carbamazepin (CBZ) und seinem Metaboliten Carbamazepin-10,11-
Epoxid (EPX) zu untersuchen, wurden verschiedene Konzentrationen von 3µM bis 100µM
(EPX), bzw. 300µM (CBZ) getestet. Da das EPX schlecht wasserlöslich ist, wurde die
Stammlösung in DMSO angefertigt und bei 4°C im Dunkeln aufbewahrt.
Alle Experimente wurden bei Raumtemperatur und mit Abschirmung durch einen
Faradaykäfig durchgeführt.
2.6.5 Makroskopische Ströme
Durch eine starke Expression von bestimmten Ionenkanalproteinen im Expressionsmodell der
Xenopus Oozyte, repräsentiert der Stromfluss über der Membran nahezu ausschließlich den
Stromfluss durch diese Kanalproteine. Im Gegensatz zu der Patch-Clamp-Methode, die sich
mit einzelnen Ionenkanälen beschäftigt, werden hier Ströme erfasst, die durch die gesamte
Membran einer Zelle fließen. Es werden makroskopische Ströme (I) gemessen, die in einem
linearen Verhältnis zur Einzelkanalleitfähigkeit (g), der Offenwahrscheinlichkeit (Popen) und
der Menge an Ionenkanälen (N) in der Membran stehen. Demnach lautet die Gleichung:
I = N ⋅ P
Betrachtet man die Offenwahrscheinlichkeit von spannungsabhängigen Kanälen, so ist sie
nicht konstant sondern steht in Abhängigkeit von Membranpotenzial und Zeit, denn je länger
die Membran depolarisiert wird, desto mehr Kanäle befinden sich im geöffneten Zustand. Wie
im Ableitungsbeispiel in Abb. 2.4B zu sehen ist, verändert sich der makroskopische Strom
über die Zeit der Klemmperiode und erreicht nach einigen Millisekunden einen fast
stationären Zustand, der in diesem Beispiel besonders bei positiven Klammspannungen zu
beobachten ist. Die durch eine Depolarisation hervorgerufene Aktivierung der
spannungsabhängigen Kanäle zeigt im Kurvenverlauf seine charakteristischen Merkmale. So
beobachtet man z.B. bei einer KCNQ1/KCNE1 koexprimierenden Oozyte einen sehr langen
Aktivierungsverlauf, der selbst bei einem ausgedehnten Klemmprotokoll noch keinen
stationären Zustand erreicht (s. Abb. 3.1 G).
2.7 Statistik und Datenauswertungen
Die Datenauswertung erfolgte mit Origin 7.5 und die statistische Signifikanz (P<0.05)
zwischen zwei Mittelwerten wurde mit dem Student´s t-Test (Microsoft Excel) geprüft. Die
signifikanten Befunde sind mit einem Stern (∗) gekennzeichnet, n stellt die Anzahl der
2.7.1 Ermittlung der apparenten Offenwahrscheinlichkeit I/Imax
I/Imax stellt die apparante Offenwahrscheinlichkeit der untersuchten Kanäle dar. In einigen
Veröffentlichungen wird sie auch als Popen bezeichnet (Li et al. 2005; Tatulian et al. 2003).
Um I/Imax zu ermitteln, wurden die Tail-Ströme analysiert. Diese so genannten Tail-Ströme
lassen sich an einer bestimmten Stelle des Spannungsprotokolls ermitteln und zwar nach dem
Klemmsprung auf -30mV, nach einer vorangegangenen depolarisierenden Klemmperiode (s.
auch Spannungsprotokoll Abb. 3.1 J, K, Ergebnisse). Die Stromamplituden korrelieren dabei
mit der in der vorangegangenen Phase erreichten Offenwahrscheinlichkeit der einzelnen
Kanäle. So wurden die Amplituden der Tail-Ströme bei -30mV erfasst und auf die
Amplitudenwerte bei +40mV normiert.
3. Ergebnisse
3.1 Wirkung von Carbamazepin auf KCNQ1 Kanäle und akzessorische
KCNE –Untereinheiten
Der KCNQ1-Kaliumkanal kann mit verschiedenen ß-Untereinheiten der KCNE-Familie
assoziieren, was das Schaltverhalten beeinflussen kann.
Um die Wirkung von Carbamazepin auf den Stromfluss von beschriebenen Kaliumkanälen zu
untersuchen, wurden die Oozyten in das Zwei-Elektroden-Spannungsklemmsystem
eingespannt. Zuvor wurden den operativ entfernten Xenopus laevis Oozyten die cRNA der zu
untersuchenden Kaliumkanälen injiziert und die Oberflächenexpression abgewartet.
Die Abbildung 3.1 stellt die charakteristischen Ströme von KCNQ1 (A), KCNQ1/KCNE3 (D)
und KCNQ1/KCNE1 (G) injizierten Oozyten dar. Die Originalaufzeichnung der KCNQ1
Homotetramere zeigt einen spannungsabhängigen, langsam aktivierenden Strom. Eine
Koexpression mit der KCNE1 Untereinheit veränderte seine Kinetik fundamental. Das führte
zu einer mehrfachen Erhöhung der Stromamplitude, einer Verschiebung der
Spannungsabhängigkeit um ca. +30mV und einer drastischen Verlangsamung der Aktivierung
des Kanals (Abb. 3.1 G). Originalaufzeichnungen der KCNQ1/KCNE3 Ströme hingegen
zeigen einen weitgehend zeitunabhängigen Verlauf und eine lineare Strom-Spannungs-
Beziehung (Abb. 3.1 D, F). Eine kurze Inkubation der KCNQ1/KCNE3 injizierten Oozyten in
einer 100µM CBZ-Lösung zeigte eine Erhöhung der Stromamplituden (Abb. 3.1 E, F).
Demgegenüber konnten die Eigenschaften der Ströme, die durch KCNQ1-Kanäle generiert
wurden, nicht durch CBZ beeinflusst werden (Abb. 3.1 B, C). Auch wenn sich eine leichte
Inhibition der Strom-Spannungs-Kurve bei Zugabe von CBZ (Abb3.1 C) zeigte, so war kein
signifikanter Unterschied gegenüber den Kontrollwerten festzustellen. Zu beobachten war
jedoch eine Wirkung auf die koexprimierten Kanalproteine KCNQ1/KCNE1, wobei die
Amplitudenzunahme in Anwesenheit von CBZ bei positiven Klemmspannungen erfolgte
(Abb. 3.1 H, I).
Die Aktivierung der KCNQ1 /KCNE3 Kanäle durch das Antikonvulsivum CBZ bei großeren
Spannungen als 0mV wird auch in der Darstellung der Strom-Spannungs-Kurven, die auf die
maximale Stromamplitude der Kontrollwerte normiert wurden (Abb. 3.2 A) deutlich. Die
Auswertungen der absoluten Ströme bei +30mV ergaben eine Amplitudenzunahme um 18%.
-100 -80 -60 -40 -20
E KCNQ1 / KCNE3 + CBZ
-100 -80 -60 -40 -20
KCNQ1 / KCNE1 + CBZ
-100 -80 -60 -40 -20
Spannungsprotokoll
J KCNQ1 und KCNQ1/KCNE3
0 200 400 600 8001000
Abbildung 3.1: Wirkung einer 100µM CBZ-Lösung auf KCNQ1, KCNQ1/KCNE3 und KCNQ1/KCNE1
Kanäle. Die Grafik zeigt eine typische Aufzeichnung der Ströme einer KCNQ1 (A), KCNQ1/KCNE3 (D) bzw.
KCNQ1/KCNE1 (G) exprimierenden Oozyte unter Kontrollbedingungen, daneben (B, E, H) nach Zugabe einer
100µM CBZ-Lösung. Während die Stromamplitude von KCNQ1 (B) fast unverändert bleibt, erkennt man eine
deutliche Amplitudenzunahme der KCNQ1/KCNE3 (E) und KCNQ1/KCNE1 (H) Ströme nach Zugabe von
CBZ. Das verwendete Spannungsprotokoll für KCNQ1/KCNE1 Kanäle ist in K dargestellt, für KCNQ1 und
KCNQ1/KCNE3 ist der Grafik J zu entnehmen. Die Aufeinanderprojektion der Strom-Spannungs-Kurven unter
Kontrollbedingungen und nach Applikation von CBZ (C, F, I) bestätigen die Befunde.
Bemerkenswert war auch die Veränderung des Leitwertes nach Zugabe von CBZ (Abb. 3.2
B). Während der Leitwert g bei -80mV signifikant erniedrigt war, zeigte sich eine signifikante
Steigerung des Leitwertes bei einer Klemmspannung von 0mV und 30mV. Diese Befunde
werden durch die Auswertungen der Tail-Ströme und der Darstellung der apparenten
Offenwahrscheinlichkeit I/Imax (Abb. 3.2 C) unterstützt. Hier zeigte sich eine erniedrigte
Offenwahrscheinlichkeit des konstitutiv offenen KCNQ1/KCNE3 Kanals nach Zugabe von
CBZ bei negativen Spannungen.
Ein weiterer interessanter Aspekt ist der Einfluss von CBZ auf die Kinetik der
KCNQ1/KCNE3 Kanäle. Die Auswertungen der Aktivierungszeitkonstanten tau vor und nach
Applikation der Testsubstanz CBZ sind in Abbildung 3.2 D dargestellt. Dazu wurde der
Stromverlauf bei einer Klemmspannung von 0mV analysiert und mit einer passenden
Exponentialfunktion (Programm Origin 7.5, Exponential; ExpDec1) ausgewertet. Die
gegenüber den Kontrollbedingungen signifikant erniedrigte Aktivierungszeitkonstante tau
deutet auf eine schnellere Aktivierungskinetik der KCNQ1 /KCNE3 Kanäle nach Zugabe von
CBZ hin, wobei sein anschließender zeitunabhängiger Stromverlauf unbeeinflusst blieb.
A KCNQ1 / KCNE3 + CBZ
KCNQ1 / KCNE3 + CBZ
C KCNQ1 / KCNE3 + CBZ
-100 -80 -60 -40 -20
-100 -80 -60 -40 -20 0
g at -80mV g at 0mV g at 30mV
Abbildung 3.2: Wirkung von 100µM CBZ-Lösung auf KCNQ1/KCNE3
Die Grafik A zeigt anhand der normierten Strom-Spannungskurve-Kurve die Wirkung von CBZ auf die
KCNQ1/KCNE3 Kanäle (n = 21). Die Veränderung des Leitwertes g bei verschiedenen Klemmspannungen ist
im Diagramm B dargestellt. Eine signifikant erniedrigte Aktivierungszeitkonstante tau nach Inkubation mit der
Testsubstanz CBZ gegenüber der Vor- und Nachkontrolle ist der Grafik D zu entnehmen. Die Darstellung der
apparenten Offenwahrscheinlichkeit I/Imax (C) zeigt nach Zugabe von CBZ eine etwas erniedrigte
Offenwahrscheinlichkeit bei negativen Spannungen.
Den aktivierenden Einfluss von CBZ bei positiven Spannungen auf KCNQ1/KCNE3 Kanäle
kann man an dem KCNQ1/KCNE1 Kanal in abgeschwächter Form erkennen.
Während der Leitwert g bei positiven Klemmspannungen signifikant anstieg (Abb. 3.3 B),
blieb die Kinetik des Kanals durch die 100µM CBZ-Lösung unberührt. Aufgrund der
charakteristisch langsamen Aktivierungskinetik dieser Kanäle, wurde das Versuchsprotokoll
mit entsprechend längeren depolarisierenden Pulsen angepasst. Ausgehend von einem
Haltepotenzial von -80mV wurde die Oozytenmembran in 10mV Schritten repetitiv für
2000ms in einer Spanne von -90mV bis +40mV depolarisiert. Im Anschluss an die 2000ms
lange Klemmperiode wurde ein Spannungssprung auf -30mV vollzogen.
KCNQ1 / KCNE1 + CBZ
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
Abbildung 3.3: Wirkung von CBZ auf KCNQ1/KCNE1 Kanäle
Die Darstellung der normierten Strom-Spannungs-Kurven (A) zeigt eine leichte Amplitudenzunahme bei
positiven Klemmspannungen nach Zugabe von 100µM CBZ-Lösung. Das Diagramm des Leitwertes g bei
verschiedenen Klemmspannungen (B) weist auf die signifikante Zunahme von g bei +30mV hin (n = 17).
Die Abbildung 3.3 A stellt die Strom-Spannungs-Beziehung der aufeinander projizierten
Kurven unter Kontrollbedingungen und nach Inkubation von CBZ dar. Ihre Werte wurden am
Ende der 2000ms langen Klemmperiode entnommen und auf die maximale Amplitude der
Kontrollwerte normiert. Daraus lässt sich schließen, dass die beiden Kurven bis 0mV
deckungsgleich verlaufen und eine signifikante stimulierende Wirkung auf die
Stromamplitude des heteromeren KCNQ1/KCNE1 Kanals erst bei einer Spannung ab
+30mV zu erkennen ist. Insgesamt stieg die Amplitude um 16% an. Die aktivierende
Wirkung von CBZ war sowohl bei KCNQ1/KCNE3 als auch KCNQ1/KCNE1 Kanälen
3.2 Untersuchungen der neuronalen KCNQ2/KCNQ3 Kanäle nach Zugabe
von Carbamazepin
Nachdem ein aktivierender Einfluss von CBZ bei positiven Spannungen auf heteromere
KCNQ1/KCNE3 und KCNQ1/KCNE1 Kanäle beobachtet wurde, kam die Frage auf, ob die
neuronalen KCNQ-Kanäle ebenfalls von CBZ beeinflusst werden.
KCNQ2 und KCNQ3 sind Kanäle, die ausschließlich im neuronalen Gewebe exprimiert
werden (Biervert et al. 1998;(Yang et al. 1998)). Sie vermitteln bei Depolarisation langsam
aktivierende Kaliumauswärtsströme, die nach Repolarisation langsam deaktivieren und tragen
damit zur Stabilisierung des Membranpotenzials bei. Wie schon beschrieben, führen
genetische Defekte in einer der beiden Untereinheiten zu unkontrollierter neuronaler
Eine Koexpression der beiden KCNQ2 und KCNQ3 Heteromere führt, im Vergleich zu den
beiden homotetrameren Kanälen alleine, zum Anstieg der Stromamplitude um das zehnfach
und ist auf die erhöhte Anzahl funktioneller Kanäle in der Membran zurückzuführen
(Schwake et al. 2000). Die Abbildung 3.4 A zeigt die für KCNQ2/KCNQ3 charakteristisch
großen Ströme. Eine kurzzeitige Inkubation der KCNQ2/KCNQ3 exprimierenden Oozyte in
einer 100µM CBZ-Lösung führte zu einer leichten Verminderung der Gesamtstromamplitude
(Abb. 3.4 B). Die Analysen weiterer dreizehn Experimente sind in Form einer normierten
Strom-Spannungs-Kurve zusammengefasst und zeigen eine signifikante Inhibition der
Stromamplitude zwischen 9% und 11% bei Spannungschritten von -20mV bis +10mV
gegenüber den KCNQ2/KCNQ3 Strömen unter Kontrollbedingungen (Abb. 3.4 C). Bei
positiveren Klemmspannungen als +10mV konnte die Reduktion der Stromamplitude nicht
mehr als signifikant bestätig werden.
Bei negativen Klemmspannungen blieb der Leitwert der KCNQ2/KCNQ3 Kanäle durch das
Antiepileptikum CBZ unverändert, während sich eine signifikante Reduktion bei +30mV
zeigte (Abb. 3.4 D). Nach einer Auswaschperiode war die Wirkung von CBZ reversibel.
KCNQ2 / KCNQ3 + CBZ
-100 -80 -60 -40 -20 0
KCNQ2 / KCNQ3 + CBZ
g at -80mV g at 0mV g at 30mV
Abbildung 3.4: Wirkung von CBZ auf KCNQ2/KCNQ3 Kanäle. Typische Stromableitung an einer
KCNQ2/KCNQ3 exprimierenden Oozyte (A), zeigt nach Zugabe von 100µM CBZ-Lösung (B) eine leicht
verringerte Stromamplitude. Die Darstellung der aufeinander projizierten Strom-Spannungs-Kurven (C) und des
Leitwertes g bei unterschiedlichen Klemmspannungen (D) zeigt ebenfalls eine leichte Inhibition der
Stromamplitude bei positiven Spannungen und einen signifikant erniedrigten Leitwert bei 30mV (n = 13). Das
verwendete Spannungsprotokoll ist in Abb. 3.1 K dargestellt.
3.3 Wirkung von Carbamazepin auf homomere KCNQ2 und KCNQ3
Ein leicht inhibierender Effekt von CBZ auf die koexprimierten KCNQ2/KCNQ3 Kanäle
veranlasste die experimentelle Überprüfung der Wirkung auch auf einzeln exprimierte
KCNQ2 und KCNQ3 Kanalproteine. Diese Fragestellung ist ebenfalls unter dem Aspekt
interessant, dass in einigen Neuronen nur eine der beiden Untereinheiten exprimiert wird
(Cooper et al. 2000).
Die Auswertungen der Originalstromableitungen von KCNQ2 oder KCNQ3 exprimierenden
Oozyten (Abb. 3.5 A und D) zeigen zunächst, dass die KCNQ3 Ströme mehr als das 10-fache
kleiner sind als KCNQ2 Ströme. Die Zugabe von 100µM CBZ-Lösung hatte keine Wirkung
auf den KCNQ2 Stromfluss (Abb. 3.5 B), während die Stromamplitude der KCNQ3
Homomere deutlich anstieg (Abb3.5 E, F). Bemerkenswert war das Muster der
spannungsabhängigen Empfindlichkeit der KCNQ3 Kanälen auf CBZ. Bei einer
Klemmspannung von -30mV aktivierte CBZ die absoluten Ströme um 23%, bei Spannungen
von -20mV bis +10mV stieg die Stromamplitude um 15-18% an und bei +20mV war die
Aktivierung von nur noch 11% zu registrieren. Die Werte bei höheren Klemmspannungen
fielen weiter ab und erreichten nicht das Signifikanzniveau.
KCNQ2 + 100µM CBZ
-100 -80 -60 -40 -20
KCNQ3 + 100µM CBZ
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
g at -80mV g at 0mV g at 30mV
Abbildung 3.5: Wirkung einer 100µM CBZ-Lösung auf KCNQ2 und KCNQ3 Kanäle
Die Stromableitung einer Oozyte, die KCNQ2 (A) und KCNQ3 (D) exprimiert, sowie die normierten Strom-
Spannungs-Kurven (C; n =13, F; n = 5) sind vor und nach Zugabe von einer 100µM CBZ-Lösung dargestellt.
Das Diagramm G und H zeigt den Leitwert g bei angegebenen Klemmspannungen unter Einfluss von CBZ. Das
verwendete Spannungsprotokoll gleicht dem in Abb. 3.1 K.
Die Auswertungen des Leitwertes g bei -30mV, 0mV und 30mV zeigten allerdings, dass CBZ
weder auf den KCNQ2- noch auf den KCNQ3-Leitwert einen signifikanten Einfluss ausgeübt
hat (Abb. 3.5 G, H).
Zusammenfassend konnte beobachtet werden, dass die Anwesenheit von CBZ einen
spannungsabhängigen Anstieg
bewirkte, was in
Übereinstimmung mit der antikonvulsiven Wirkung von CBZ in Zusammenhang stehen
könnte. KCNQ2 Kanäle dagegen zeigten keine Veränderung der Stromamplitude nach
Zugabe von CBZ. Bei koexprimierten KCNQ2/KCNQ3 Kanälen konnte in Anwesenheit von
CBZ eine leichte Inhibition der Gesamtstromamplitude bei Spannungen ab -20mV beobachtet
Die Analyse der Tail-Ströme, die in der Darstellung der apparenten Offenwahrscheinlichkeit
I/Imax beschrieben werden (Abb. 3.6 A und B) zeigte, dass CBZ keinen Einfluss auf die
Offenwahrscheinlichkeit der KCNQ3 und KCNQ2/KCNQ3 Kanäle hatte.
B KCNQ2 / KCNQ3 + CBZ C
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
Abbildung 3.6: Darstellung der apparanten Offenwahrscheinlichkeit I/Imax.
Die Anwesenheit von 100µM CBZ-Lösung zeigt keinen Einfluss auf die Offenwahrscheinlichkeit der
KCNQ3(A) und KCNQ2/KCNQ3 Kanäle (B). KCNQ2 Kanäle (C) jedoch scheinen nach Zugabe von CBZ eine
geringfügig erhöhte Offenwahrscheinlichkeit aufzuzeigen, die jedoch nicht signifikant ist.
Allerdings konnte eine leicht erhöhte Offenwahrscheinlichkeit der KCNQ2 Kanäle nach
Zugabe von CBZ (Abb. 3.6 C) beobachtet werden (Halbmaximalen Aktivierung V1/2 unter
Kontrollbedingungen (-28,87±0,75) und in Anwesenheit von CBZ (-31,41±0,71)), die jedoch
nicht das festgelegte Signifikanzniveau erreicht hat. Die Werte für die halbmaximale
Aktivierung V1/2 wurden durch die Anwendung des Boltzmann Fits auf die I/Imax Kurve
3.4 Wirkung von Carbamazepin auf KCNQ5 Kanäle; Vergleich zu
Carbamazepin 10,11-Epoxid
Ein weiterer, in Neuronen exprimierter Kanal der KCNQ Genfamilie, ist KCNQ5. Er weist
eine breite Expression im Gehirn auf und, anders als seine anderen vier KCNQ
Familienmitglieder ebenfalls im Skelettmuskel (Schroeder et al.2000a).
Untersucht wurde im Rahmen dieser Arbeit sowohl die Wirkung von CBZ als auch seines
Metaboliten EPX. Die Originalaufzeichnungen zeigen zunächst wie langsam aktivierende
KCNQ5 Ströme durch die Zugabe von 100µM CBZ-Lösung und auch 100µM EPX-Lösung
unterschiedlich stark inhibiert werden (Abb. 3.7 A, D).
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
-100 -80 -60 -40 -20
Abbildung 3.7: Vergleich der Wirkung von CBZ und EPX auf KCNQ5 Kanäle.
Die Stromableitung einer KCNQ5 exprimierenden Oozyte zeigt nach Zugabe von 100µM CBZ-Lösung (A) und
100µM EPX-Lösung (D) eine unterschiedlich starke Hemmung der Stromamplituden. Das dazugehörige
Spannungsprotokoll ist in G abgebildet. Auch die Gegenüberstellung der aufeinander projizierten Strom-
Spannungs-Kurven vor und nach Zugabe der beiden Testsubstanzen spiegelt die unterschiedlich starke Inhibition
der Stromamplitude wieder (B, E). Die Wirkungsunterschiede von CBZ und EPX werden in der Darstellung des
Leitwertes g bei verschiedenen Klemmspannungen sehr deutlich (C, F). (n = 7)
Auch aus der Darstellung der Strom-Spannungs-Kurven (Abb. 3.7 B, E) wird deutlich, dass
KCNQ5 Ströme viel empfindlicher auf die Zugabe von EPX reagieren als auf CBZ. Die
Auswertungen weiterer Experimente ergaben einen signifikant höheren Leitwert der KCNQ5
Kanäle bei -80mV nach Zugabe von EPX, wobei der Leitwert bei 0mV und 30mV eine
drastische Reduktion aufzeigte (Abb. 3.7 F). Demgegenüber vermittelte die Wirkung von
CBZ bei allen analysierten Klemmspannungen eine annährend gleichstarke Reduktion der
KCNQ5 Leitwerte, die jedoch nur bei 0mV und 30mV die Signifikanz erreichten (Abb. 3.7
Ein weiterer interessanter Aspekt der Wirkung von EPX, die sich von der CBZ Wirkung auf
KCNQ5 Kanäle deutlich abhebt, ist die veränderte Kinetik der KCNQ5 vermittelten Ströme
(Abb. 3.8) in Anwesenheit von EPX. Die Analyse der Aktivierungsparameter tau1 und tau2,
die sich aus dem Fit des Kurvenverlaufs bei 0mV ermitteln liesen, zeigten in Anwesenheit
von EPX eine signifikant erniedrigte Aktivierungszeitkonstante tau1 (Abb. 3.8 A, B). Bei
näherem Betrachten der Stromverläufe, die in der Grafik 3.8 A abgebildet sind, fällt auf, dass
die rote Kurve, neben der erniedrigten Stromamplitude, initial auch einen viel steileren
Verlauf ausweist, als die schwarze Stromkurve unter Kontrollbedingungen. Dieser initial
steilere Verlauf spiegelt eine schnellere Aktivierungskinetik der KCNQ5-Ströme nach Zugabe
von EPX wieder. Während dieser Effekt nach einer kurzen Auswaschperiode vollkommen
reversibel zu sein scheint, war der Aktivierungsparameter tau2, der die langsamere
Komponente des Kurvenverlaufs beschreibt, auch nach dem Auswaschen signifikant
gegenüber der Kontrolle erniedrigt (Abb.3.8 C). Die fehlende Signifikanz der tau2 Werte in
Anwesenheit von EPX kann möglicherweise mit einer größeren Streuung der Daten erklärt
werden, wobei sich die anhaltende Reduktion der Aktivierungszeitkonstanten tau2 nach der
Auswaschperiode womöglich als kumulative Nachwirkung von EPX interpretiert werden
könnte (Abb.3.8 C). Ingesamt lässt sich die Wirkung von EPX auf die Kinetik des KCNQ5-
Stromes als auch auf die Reduktion der Stromamplitude als partiell reversibel einstufen.
Abbildung 3.8: EPX verändert die Kinetik der KCNQ5-Ströme
Die Grafik A zeigt einen Ausschnitt aufeinander projizierter Originalstromableitungen einer KCNQ5
exprimierenden Oozyte unter Kontrollbedingungen, nach EPX Zugabe und nach der Auswaschperiode. Dieser
Ausschnitt spiegelt den Stromfluss bei 0mV wieder und zeigt nach Zugabe von EPX eine schnellere
Aktivierungskinetik, die aufgrund des Kurvenverlaufs als tau1 (schnelle Komponente, B) und tau2 (langsame
Komponente, C) analysiert wurde (n = 7).
Um die pharmakologische Wirkung von CBZ und EPX genauer zu untersuchen, wurden
weitere Konzentrationen getestet.
Es zeigte sich eine konzentrationsabhängige Inhibition der KCNQ5-Stromamplitude nach
Zugabe von CBZ, wobei die Inhibition in Anwesenheit von EPX wesentlich stärker ausfiel.
Zur Darstellung der experimentellen Konzentrationen beider Testsubstanzen wurden jeweils
die gleichen Farben verwendet, um den Vergleich der Wirkung untereinander zu erleichtern.
Es wurden Konzentrationen von 3µM (grün), 10µM (magenta), 100µM (rot) und bei CBZ
zusätzlich noch 300µM (hellblau) getestet. Die graue Farbe beschreibt den Zustand nach der
Auswaschperiode. Auf Grund der geringen Löslichkeit von EPX, konnten Konzentrationen
größer als 100µM nicht getestet werden.
Der Vergleich der auf einander projizierten normierten Strom-Spannungs-Kurven (Abb. 3.9
A, D) zeigt nicht nur einen konzentrationsabhängigen Unterschied der Reduktion der
Stromamplituden, sondern auch einen unterschiedlichen Einfluss der beiden Testsubstanzen
auf die Spannungsabhängigkeit des Stromes. Während die KCNQ5 Ströme unter
Kontrollbedingungen ab -60mV langsam aktivierten, wurde nach Zugabe von CBZ bei einer
Konzentration von 10µM die Inhibition der Stromamplitude ab etwa -30mV sichtbar (Abb.
3.9 A). Im Vergleich dazu bewirkte die 10µM EPX-Lösung eine signifikante Reduktion der
Stromamplitude ab -50mV (Abb.3.9 D).
Die Ströme wurden bei +30mV genauer untersucht (Abb. 3.9 B, E), dabei zeigte sich schon
bei einer Konzentration von 3µM EPX-Lösung eine hochsignifikante Reduktion der Ströme
um 37%, 10µM EPX-Lösung erreichte eine Reduktion sogar um 63%. Auffällig ist, dass eine
10fach höhere Konzentration von EPX (100µM) eine geringfügigere Inhibition (58%) der
Gesamtstromamplitude bewirkte (Abb. 3.9 E). Im Unterschied dazu liesen sich die KCNQ5
Ströme erst bei einer Konzentration von 10µM CBZ signifikant reduzieren, wobei auch die
höchste getestete Konzentration von CBZ (300µM) nicht die Größenordnung der EPX
Inhibition erreichte. Auf Grund der geringen Löslichkeit der Testsubstanzen konnten keine
höheren Konzentrationen getestet werden. So lässt sich der IC50 Wert nur eingrenzen.
Anzunehmen ist, dass der IC50 Wert von CBZ deutlich >300µM ist, während sich der IC50
Wert für EPX bei 8,1±0,7 µM (Programm Origin 7.5, Logistic) befindet. Des Weiteren zeigte
sich auch die unterschiedliche Wirkung der beiden Testsubstanzen auf das Membranpotenzial
(Abb. 3.9 C, F) der KCNQ5 exprimierenden Oozyten. Nach Zugabe von 10µM und 100µM
EPX-Lösung konnte eine signifikante Hyperpolarisation der Oozytenmembran beobachtet
werden. Dieser Befund deckt sich gut mit der schon gezeigten Erhöhung des Leitwertes bei -
80mV (Abb. 3.7 F) und könnte auf der Erhöhung des fraktionellen Leitwertes für Kalium in
der Oocyte beruhen (s. Kap.1.2).
KCNQ5 + CBZ
con 3µM 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM 300µM nco
Membranpotenzial
KCNQ5 + EPX
con 3µM 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM nc
Abbildung 3.9: Konzentrationsabhängige Wirkung von CBZ und EPX auf KCNQ5 Kanäle.
Die Darstellung der normierten Strom-Spannungs-Kurven zeigt einen unterschiedlich starken Einfluss von CBZ
(A) und EPX (D) auf KCNQ5 Kanäle (n=7). Die Ströme bei +30mV werden durch eine 300µM CBZ
Konzentration bis zu 43% gehemmt (B), während eine 10µM Konzentration von EPX schon 63% des KCNQ5-
Stromflusses reduziert (E). Zusätzlich lässt sich nach Zugabe von EPX eine signifikante Hyperpolarisation des
Membranpotenzials registrieren (F), CBZ dagegen zeigt keinen Einfluss darauf (C).
Auch die Auswertungen der Tail-Ströme, die in der Darstellung der apparenten
Offenwahrscheinlichkeit I/Imax (Abb. 3.10 A, B) veranschaulicht werden, lassen die
unterschiedliche Wirkung der beiden Testsubstanzen erkennen. Dazu wurden die
Stromamplituden der Tail-Ströme nach einer 2s langen Phase eines definierten
Membranpotenzials zwischen -90 mV und +40 mV gemessen.
Beide Graphen (Abb. 3.10) zeigen unter Kontrollbedingungen (schwarz) eine Aktivierung des
KCNQ5-Kanals ab -60mV, wobei bei stark positiven Spannungen die I/Imax- Kurve wieder
abzufallen scheint. Ein derartiger Abfall der I/Imax-Kurve könnte einen
Inaktivierungsvorgang bei positiven Spannungen widerspiegeln, was auch bei einigen anderen
KCNQ-Kanälen zu beobachtet ist (Jensen et al. 2007; Tatulian et al. 2001). Dieser
Inaktivierungsvorgang scheint nach Zugabe von EPX um etwa 20mV nach links verschoben
zu sein (Abb. 3.10 B).
Diese Gegenüberstellung zeigt deutlich, dass CBZ die Offenwahrscheinlichkeit der KCNQ5
Kanäle nicht beeinflusst hat (Abb. 3.10 A), während die Anwesenheit von EPX eine
Linksverschiebung der I/Imax Kurve bewirkte (Abb. 3.10 B).
3µM EPX 10µM EPX 100µM EPX
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
Abbildung 3.10: Gegenüberstellung der unterschiedlichen Wirkung von CBZ und EPX auf KCNQ5-Tail-
Ströme. Die Darstellungen der apparenten Offenwahrscheinlichkeit I/Imax von KCNQ5 Kanälen nach Zugabe
von CBZ (A) und EPX (B) zeigen, dass nur die Anwesenheit von EPX eine Linksverschiebung der I/Imax Kurve
Das bedeutet, dass eine höhere Anzahl von Kanälen bei negativeren Membranpotenzialen
durch EPX geöffnet wurde. Als Werte für die halbmaximale Aktivierung wurden unter
Kontrollbedingungen V1/2 = -41,59 ± 0,42 mV, bei 3µM EPX V1/2 = -46,6 ± 4,0 mV, 10µM
EPX V1/2 = -53,16 ± 2,3 mV und bei 100µM V1/2 = -50,2 ± 1,54 mV, berechnet. Deutlich wird
auch hier, dass die 10µM EPX-Lösung einen viel stärkeren Effekt auf die KCNQ5 Kanäle
ausgeübt hat, als 100µM EPX-Lösung.
3.5 Wirkung von Carbamazepin auf heteromere KCNQ5 / KCNQ3 Kanäle;
Vergleich zu Carbamazepin 10,11-Epoxid
Da KCNQ5 mit KCNQ3 in vitro heteromere Kanäle bilden kann, die ebenfalls Eigenschaften
des M-Stroms aufweisen (Wickenden et al. 2001), wurde eine weitere Testreihe zur
pharmakologischen Untersuchung von CBZ und EPX durchgeführt.
Wie schon beschrieben, sind KCNQ3 Ströme sehr klein und sind oft nicht von
Hintergrundströmen einer Xenopus Oozyte zu unterscheiden. Eine Koexpression von KCNQ3
mit KCNQ5 führte zu einer eindeutig höheren Stromamplitude, gegenüber dem jeweiligen
Homomer. Auch diese Ströme waren empfindlich auf die CBZ und EPX Zugabe und
reagierten mit einer unterschiedlich starken Abnahme der Stromamplitude (Abb. 3.11 A, D).
Dabei fiel auf, dass die langsam aktivierenden KCNQ5/KCNQ3 Ströme nach Zugabe von
100µM EPX-Lösung nicht nur an Amplitudenhöhe verloren haben, sondern sich darüber
hinaus auch die Spannungsabhängigkeit änderte. Die KCNQ5/KCNQ3 Kanäle zeigten in
Anwesenheit von 100µM EPX-Lösung, im Gegensatz zur gleichen Konzentration von CBZ,
eine wesentlich frühere Aktivierung, was im Vergleich der Strom-Spannungs-Kurven (Abb.
3.11 B, E) deutlich wurde. Hier konnte eine Aktivierung der KCNQ5/KCNQ3 Ströme nach
Inkubation mit EPX schon ab -80mV beobachtet werden, während unter Kontrollbedingungen
die Aktivierung ab -60mV deutlich wurde.
Auch die Auswertungen des Leitwertes der KCNQ5/KCNQ3 Kanäle bei -80mV, 0mV und
+30mV zeigten eine unterschiedlich starke Wirkung von 100µM CBZ-Lösung gegenüber der
gleichen Konzentration der EPX-Lösung (Abb. 3.11 C, F). Beide Testsubstanzen bewirkten
bei einer Spannung von -80mV eine signifikante Steigerung des Leitwertes in Anwesenheit
von EPX sogar auf das Doppelte, während bei Spannungen um 0mV eine signifikante
Reduktion des KCNQ5/KCNQ3–Leitwertes beobachtet werden konnte. Bei positiven
Klemmspannungen machte sich bei beiden Testsubstanzen kaum eine Änderung des
Leitwertes bemerkbar, wobei die Stromamplituden in diesem Spannungsbereich am stärksten
auseinanderweichten. Das kann dadurch erklärt werden, dass die Darstellung des Leitwertes g
durch die Steigung der Strom-Spannungs-Kurve bei angegebenen Spannungen ermittelt
wurde und bei +30mV erreichte dieser Kanal einen nahezu stationären Zustand, so dass die
ermittelte Steigung sowohl unter Kontrollbedingungen, als auch nach Zugabe der
Testsubstanzen vergleichbar war, obwohl sich der Amplitudenunterschied sehr deutlich
A KCNQ5/KCNQ3 + CBZ
B KCNQ5/KCNQ3 + CBZ C
KCNQ5/KCNQ3 + CBZ
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
D KCNQ5/KCNQ3 + EPX
E KCNQ5/KCNQ3 + EPX
KCNQ5/KCNQ3 + EPX
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
Abbildung 3.11: Vergleich der Wirkung von 100µM CBZ- und EPX-Lösung auf KCNQ5/KCNQ3
Heteromere. Ein Ausschnitt einer typischen Stromableitung einer KCNQ5/KCNQ3 exprimierenden Oozyte
zeigt nach einer kurzen Inkubation mit 100µM CBZ-Lösung (A) und einer 100µM EPX-Lösung (D) eine
deutliche Reduktion der Stromamplitud. (Das Spanungsprotokoll gleicht dem in Abbildung 3.7 G.) Diese
unterschiedlich starke Wirkung wird auch in der Gegenüberstellung der Strom-Spannung-Kurven sichtbar (B,
E), wobei die signifikante Veränderung des Leitwertes g bei -80mV und 0mV diesen unterschiedlich starken
Effekt der beiden Testsubstanzen hervorhebt (C, F). (n = 9)
Die Untersuchungen weiterer Konzentrationen von CBZ und EPX haben einen Unterschied in
der Empfindlichkeit der KCNQ5/KCNQ3 Ströme gezeigt. Dabei hat die Zugabe von EPX bei
allen drei getesteten Konzentrationen (3µM; 10µM; 100µM) einen gleich starken
Maximaleffekt bewirkt, der bei stark negativen Spannungen eine frühere Aktivierung der
KCNQ5/KCNQ3 Ströme vermittelte und gleichzeitig ab einer Spannung von -30mV eine
Inhibition der Stromamplituden zeigte (Abb. 3.12 D). Die analysierten Ströme bei +30mV
haben bei allen drei Konzentrationen eine signifikante Reduktion der Stromamplituden um
30% gezeigt, wobei nach der Auswaschperiode noch eine Amplitudenrückgang von weiteren
7% beobachtet wurde (Abb. 3.12 E), die Wirkung war also nicht reversibel.
Membranpotezial
KCNQ5/KCNQ3 + CBZ
KCNQ5 / KCNQ3 + CBZ
KCNQ5/KCNQ3 + CBZ
con 3µM 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM 300µM nco
D KCNQ5/KCNQ3 + EPX E
Membranpotenzial
KCNQ5 / KCNQ3 + EPX
KCNQ5/KCNQ3 + EPX
con 3µM 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM nco
Abbildung 3.12: Wirkung von CBZ und EPX auf KCNQ5 / KCNQ3 Kanäle
Die auf einander projizierten Strom-Spannungs-Kurven, die auf die maximale Amplitude der Kontrollwerte
normiert wurden, zeigen eine konzentrationsabhängige Wirkung von CBZ (A) und eine spannungsabhängige
Wirkung von EPX (D). Die Analyse der Ströme bei +30mV stellen die signifikanten Befunde prozentual dar (B,
E). Grafik C und F zeigen den Einfluss der beiden Testsubstanzen auf das Membranpotenzial. (CBZ n = 9; EPX
n = 6)
Im Gegensatz dazu steht die Wirkung von CBZ. Es konnte ein konzentrationsabhängiger
Effekt auf die KCNQ5/KCNQ3 generierten Ströme beobachtet werden (Abb. 3.12 A, B), der
bei der niedrigsten getesteten Konzentration von 3µM sogar eine signifikante Aktivierung der
Ströme um 5% provozierte, was sich allerdings nur bei positiven Spannungen bemerkbar
machte. Höhere Konzentrationen von CBZ (100µM und 300µM) hatten dagegen eine
signifikant inhibierende Wirkung auf die Stromgröße. Ingesamt konnte eine Reduktion der
Stromamplitude bei einer Spannung von +30mV und 100µM CBZ-Lösung um gerade 13%
beobachtet werden, 300µM CBZ-Lösung bewirkte einen Rückgang um 41% (Abb. 3.12 B).
Im Gegensatz zu der Wirkung von EPX, war eine Erhöhung der Stromamplitude nach dem
Auswaschen der CBZ-Lösung sichtbar, diese war jedoch noch signifikant unterschiedlich
gegenüber der Vorkontrolle (Abb. 3.12 B, E). Das bedeutet, die Wirkung war teilweise
Einen weiteren Unterschied stellt die Wirkung von EPX auf das Membranpotenzial dar.
Während keine der getesteten CBZ Konzentrationen einen Einfluss auf das
Membranpotenzial von KCNQ5/KCNQ3 Kanälen gezeigt hat, bewirkten alle EPX-
Konzentrationen eine signifikante Hyperpolarisation der Membran (Abb. 3.12 C, F). Im
Gegensatz zu der Wirkung auf die Stromamplitude war dieser Effekt reversibel.
Die Auswertungen der Tail-Ströme
zeigen, dass beide Testsubstanzen die
Offenwahrscheinlichkeit der KCNQ5/KCNQ3 Kanäle beeinflusst haben, jedoch im
unterschiedlichen Ausmaß (Abb. 3.13 A, B). Aus dem Vergleich der beiden I/Imax Kurven
geht hervor, dass CBZ nur eine geringfügig erhöhte Offenwahrscheinlichkeit bewirken konnte
(Kontrolle V1/2= -30,4 ± 0,67 mV; 10µM V1/2= -31,5 ± 0,9 mV und 100µM V1/2= -31,9 ± 0,8
mV), während die Anwesenheit von EPX schon ab einer Konzentration von 3µM eine
deutliche Linksverschiebung in Richtung hyperpolarisierender Spannungen bewirkt hat (3µM
EPX V1/2= -45,6 ± 3,1 mV; 10µM EPX V1/2= -50,4 ± 3,8 mV ; 100µM -54,1 ± 3,4 mV;
Kontrolle V1/2= -30,7 ± 2,7 mV ).
A KCNQ5 / KCNQ3 + CBZ
B KCNQ5 / KCNQ3 + EPX
0 -100 -80 -60 -40 -20 0 20 40
-100 -80 -60 -40 -20 0
Abbildung 3.13: Darstellung der apparenten Offenwahrscheinlichkeit I/Imax. Die Anwesenheit von CBZ
bewirkt eine leicht erhöhte Offenwahrscheinlichkeit der KCNQ5/KCNQ3 Kanäle (A) bei negativen Spannungen.
Die Inkubation der KCNQ5/KCNQ3 Kanäle mit EPX (B) dagegen zeigt eine deutliche Linksverschiebung der
I/Imax Kurve.
Diese Ergebnisse, zusammen mit den einzugrenzenden IC50 Werten für CBZ (>300µM) und
EPX (1,3 ± 0,9 µM unter der Annahme, dass eine maximal Inhibition von nur 30% (Abb. 3.12
E) möglich ist) zeigen eine komplexe Wirkung der beiden Testsubstanzen auf
KCNQ5/KCNQ3 Kanäle. EPX zeigte dabei deutlich stärkere Auswirkungen.
3.6 Wirkung von Carbamazepin-10,11-Epoxid auf homomere KCNQ3
Kanäle im Vergleich zu KCNQ5/KCNQ3 und KCNQ5 Kanälen
Der sowohl in zentralen als auch peripheren Neuronen lokalisierte KCNQ3 Kanal hat im
Oozytenexpressionssystem in Anwesenheit von CBZ eine signifikante Aktivierung seiner
Stromamplitude bei Spannungen von -30mV bis +20mV gezeigt, was nicht auf eine erhöhte
Offenwahrscheinlichkeit oder signifikant erhöhte Leitwerte zurückzuführen ist (Kap.3.3).
Etwas anders sehen die Ergebnisse nach Zugabe von EPX aus. Eine Originalaufzeichnung der
KCNQ3 Ströme bei +40mV zeigt zunächst einen typischen Stromverlauf unter
Kontrollbedingungen, der nach Zugabe einer 100µM EPX-Lösung eine Erhöhung der
Stromamplitude beschreibt (Abb. 3.14 A, B). Die genauere Analyse der Strom-Spannungs-
Beziehung ergab einen signifikanten Anstieg der Ströme um etwa 20% bei Spannungen von -
20mV bis +30mV, bei Klemmspannungen von +40mV war eine Erhöhung der
Stromamplitude von 27% gegenüber den Kontrollwerten zu registrieren. Des Weiteren war
eine Zunahme des KCNQ3-Leitwertes zu beobachten, der bei -80mV und +30mV statistisch
signifikant war (Abb. 3.14 C). Diese Leitwerterhöhung lässt eine Hyperpolarisation des
Membranpotenzials erwarten. Das zeigte sich aber nur sehr geringfügig in Anwesenheit
unterschiedlicher Konzentrationen von EPX, wobei keiner der Werte das Signifikanzniveau
erreichen konnte (Abb. 3.15 C).
-100 -80 -60 -40 -20
g at -80mV g at 0mV g at 30mV
Abbildung 3.14: Wirkung von 100µM EPX-Lösung auf KCNQ3
Die Grafik A zeigt einen Ausschnitt einer Originalableitung einer KCNQ3 exprimierenden Oozyte unter
Kontrollbedingungen und nach Zugabe einer 100µM EPX-Lösung. Deutlich wird auch in der Darstellung der
Strom-Spannungs-Kurven, dass EPX einen aktivierenden Einfluss auf die Stromamplitude vermittelt (B). Auch
der Leitwert der KCNQ3 Kanäle steigt in Anwesenheit von EPX (C). (n = 5)
Weitere Analysen der Stromamplitude ergaben eine Erhöhung ab einer Konzentration von
10µM EPX, wobei interessanterweise die Stärke der Wirkung vergleichbar mit einer 10fach
höheren Konzentration war (Abb. 3.15 A, B). Diese etwa 20%ige Zunahme der
Stromamplitude war nach einer Auswaschperiode nur partiell reversibel, was aus der
Darstellung der Ströme bei +30mV (Abb. 3.15 B) zu entnehmen ist.
Membranpotenzial
con 3µM 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM ncon
Abbildung 3.15: Konzentrationsabhängige Wirkung von EPX auf KCNQ3 Kanäle
Die normierten Strom-Spannungs-Kurven zeigen in Anwesenheit von EPX eine Erhöhung der Stromamplituden
(A), die in Abhängigkeit von der Konzentration bei positiven Spannungen bis zu 20% steigt (B). Die Analyse
des Membranpotenzials zeigt eine geringfügige Hyperpolarisation, die jedoch nicht signifikant ist (C). (n = 5)
Werden diese Befunde mit der Wirkung von EPX auf KCNQ5 und koexprimierte
KCNQ5/KCNQ3 Kanäle verglichen, so wird eine vollkommen gegensätzliche Reaktion
dieser drei Kanäle nach Zugabe von EPX deutlich. Der Vergleich der Ströme bei positiven
Klemmspannungen (+30mV) zeigt schon bei der kleinsten getesteten EPX Konzentration
(3µM) eine signifikante Inhibition der KCNQ5 (um 37%) und KCNQ5/KCNQ3 (um 31%)
generierten Ströme (Abb. 3.9 E; Abb. 3.12 E). Höhere Konzentrationen von EPX zeigen nur
bei KCNQ5 Kanälen eine noch stärkere Reduktion der Stromamplituden. Diese Beobachtung
kann möglicherweise durch die Befunde der EPX Wirkung auf KCNQ3 Kanäle erklärt
werden. Hier wurde ein Anstieg der KCNQ3 Stromamplitude um 20% registriert (Abb. 3.15),
der möglicherweise bei der Koexpression von KCNQ5/KCNQ3 einer stärkeren
Strominhibition entgegenwirkte.
Bei diesem Vergleich der Wirkung von EPX werden auch Gemeinsamkeiten deutlich. 100µM
EPX-Lösung vermittelte bei allen drei neuronalen Kanälen eine Erhöhung des Leitwertes bei
stark negativen Spannungen (Abb. 3.11F; Abb. 3.7F; Abb. 3.14C). Bei allen drei Kanälen
machte sich auch eine Wirkung auf das Membranpotenzial bemerkbar. KCNQ5/KCNQ3 und
KCNQ5 Kanäle zeigten dabei eine signifikante Hyperpolarisation, die bei KCNQ3 Kanälen
nur sehr schwach ausfiel und nicht signifikant war (Abb. 3.9 F; Abb. 3.12 F; Abb. 3.15 C).
Des Weiteren war die Wirkung von EPX auf diese Kanäle nur partiell reversibel (Abb. 3.9E;
3.12E; 3.15B). Insgesamt war die Wirkung von EPX am stärksten bei koexprimierten
KCNQ5/KCNQ3 Kanälen ausgeprägt.
B KCNQ5 / KCNQ3 + EPX
3µM EPX 10µM EPX 100µM EPX
0 -100 -80 -60 -40 -20 0 20 40
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
Abbildung 3.16: Wirkung von EPX auf KCNQ3, KCNQ5 und KCNQ5/KCNQ3 Tail-Ströme. Die
Darstellungen der apparenten Offenwahrscheinlichkeit I/Imax von KCNQ3 (A), KCNQ5 (C) und
KCNQ5/KCNQ3 (B) Kanälen zeigt einen unterschiedlich starken Einfluss von EPX auf die
Offenwahrscheinlichkeit dieser Kanäle.
Diese Befunde lassen sich durch die Auswertungen der Tail-Ströme gut veranschaulichen
(Abb. 3.16). Während sich die Anwesenheit von EPX nur sehr geringfügig auf die
Offenwahrscheinlichkeit der KCNQ3 Kanäle auswirkte (Abb. 3.16 A), zeigte sich der
Einfluss auf heteromere KCNQ5/KCNQ3 Kanäle am stärksten (Abb. 3.16 B). Der Vergleich
der Werte für die halbmaximale Aktivierung nach Zugabe von 100µM EPX-Lösung bestätigte
diese Befunde mit einer Verschiebung der KCNQ5/KCNQ3 I/Imax Kurve um -24mV (s. Kap.
3.5), gegenüber KCNQ5 um -9mV (s. Kap. 3.4). Die Werte für die halbmaximale
Aktivierung für KCNQ3 Kanäle (Kontrolle V1/2 = -37,4 ± 1,7 mV; nach Zugabe von 100µM
EPX V1/2 = -38,5 ± 0,8 mV) waren nicht mehr signifikant unterschiedlich.
3.7 Elektrophysiologische Eigenschaften von koexprimierten KCNQ5
/KCNE3 Kanälen
Die Untereinheiten der KCNQ5 Kanäle können in Wechselwirkung mit anderen
Untereinheiten treten, wie z.B. schon mit KCNQ3 (Wickenden et al. 2001) gezeigt. Die
Interaktion des KCNQ5 Kanals mit ß-Untereinheiten wurde bisher kontrovers diskutiert
(Schroeder et al. 2000a; Lerche et al. 2000). Eine neue Studie (Roura-Ferrer et al. 2009) hat
inzwischen eine mögliche Interaktion von KCNQ5 mit KCNE1 oder KCNE3 Untereinheiten
vorgestellt. Demnach kommt die heteromere Konstellation von KCNQ5/KCNE3 im
Skelettmuskel und vaskulären glatten Muskelzellen vor.
In einer neuen Serie von Experimenten wurden die koexprimierten KCNQ5/KCNE3
Kanalproteine untersucht. Die Auswertungen der Ergebnisse haben vollkommen veränderte
Kanaleigenschaften gezeigt.
Während die Oozyten, die mit KCNQ5 cRNA injiziert worden waren, langsam aktivierende
Ströme aufzeigten (Abb. 3.17 C), konnte bei KCNQ5 und KCNE3 1:10 koinjizierten Oozyten
eine wesentlich schnellere Aktivierungskinetik der Ströme beobachtet werden. Ähnlich wie
die Ströme der KCNQ1/KCNE3 exprimierenden Oozyten (Abb. 3.17 E) zeigten die
KCNQ5/KCNE3 Ströme nach Erreichen ihrer maximalen Stromamplitude einen annähernd
zeitunabhängigen Verlauf (Abb. 3.17 A), was sich besonders bei positiven Spannungen
bemerkbar machte. Auch die Höhe der Stromamplituden befand sich bei Heteromeren von
KCNQ5/KCNE3 und KCNQ1/KCNE3 im vergleichbaren Bereich, während KCNQ5
injizierte Oozyten bis zu 10 fach größere Stromamplituden darstellten.
Der Vergleich der normierten Strom-Spannungs-Kurven unter Kontrollbedingungen zeigt,
dass KCNQ5/KCNE3
und KCNQ5 injizierte Oozyten
Klemmspannungen ein vergleichbares Strom-Spannungs-Verhältnis aufweisen (Abb. 3.17 B,
D). Im Bereich negativer Klemmspannungen allerdings zeigt KCNQ5/KCNE3 eine Tendenz
zum linearen Strom-Spannungs-Verhältnis, was auch ein typisches Merkmal von
KCNQ1/KCNE3 Kanälen ist (Abb. 3.17 F).
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20
-100 -80 -60 -40 -20
Abbildung 3.17: Gegenüberstellung der KCNQ5/KCNE3, KCNQ5 und KCNQ1/KCNE3 generierten
Ströme. Typische Stromableitungen einer KCNQ5/KCNE3 (A), KCNQ5 (C) und KCNQ1/KCNE3 (E)
injizierten Oozyte zeigen jeweils einen repräsentativen Stromverlauf unter Kontrollbedingungen. Die Grafiken
B, D und F stellen die Strom-Spannungsbeziehung der jeweiligen Konstrukte dar (KCNQ5/KCNE3 n = 18).
Spannungsprotokolle sind der Abb. 3.1 zu entnehmen.
Zusammenfassend konnte beobachtet werden, dass KCNQ5/KCNE3 koinjizierte Oozyten
einen Strom generierten, der im Vergleich zu KCNQ5 Strömen keine langsame
Aktivierungskinetik aufwies, wesentlich früher aktivierte (ab -80mV), dafür aber bei etwa
+20mV, ähnlich wie der KCNQ5-Strom, einen stationären Zustand erreichte (steady state).
Zusätzlich konnte eine Inhibition der Gesamtstromamplitude der koexprimierten
KCNQ5/KCNE3 Kanäle gegenüber einzeln exprimierten KCNQ5 Kanälen beobachtet
3.8 Wirkung von Carbamazepin auf KCNQ5/KCNE3 Heteromere;
Vergleich zu Carbamazepin-10,11-Epoxid
Bei positiven Spannungen zeigte das Antikonvulsivum CBZ eine aktivierende Wirkung auf
die Gesamsstromamplitude von KCNQ1/KCNE3 Kanälen, während bei stark negativen
Spannungen eine Leitwerterniedrigung und eine verminderte Offenwahrscheinlichkeit
beobachtet wurde (s.Kap 3.1). Neuronale KCNQ5 Kanäle dagegen wurden in Anwesenheit
von CBZ in ihrer Gesamtstromamplitude inhibiert. Eine noch stärkere Inhibition der KCNQ5
Gesamtstromamplitude wurde durch das EPX provoziert, während sich die komplexe
Wirkung von EPX auch durch eine erhöhte Offenwahrscheinlichkeit mit Linksverschiebung
der I/Imax Kurve zu hyperpolarisierenden Spannungen zeigte (s.Kap.3.4).
Wie schon beschrieben, resultiert aus der Koinjektion der Xenopus Oozyten mit KCNQ5 und
KCNE3 cRNA ein funktionstüchtiger Kanal, der Ströme generiert, die bis zu 10-fach kleiner
sind, als KCNQ5 Ströme. Dabei zeigte sich auch, dass der KCNQ5/KCNE3 Kanal schon ab -
80mV aktiviert wurde. Die experimentelle Überprüfung der pharmakologischen Wirkung von
CBZ und EPX auf diese Kanalproteine sollten nun mehr Aufschluss über die Charakteristika
dieser koexprimierten Kanäle geben.
Die koinjizierten KCNQ5/KCNE3 Oozyten zeigten Ströme, die scheinbar nicht empfindlich
auf 100µM CBZ-Lösung reagierten (Abb. 3.18 A, E). Andere Konzentrationen dagegen
führten zur deutlichen Veränderung der Stromamplituden. Geringe Konzentrationen (10µM)
zeigten einen Anstieg der Ströme, während stärkere Konzentrationen (300µM) eine Inhibition
der Stromamplitude provozierten (Abb. 3.18 B, C).
A KCNQ5 / KCNE3 + CBZ B KCNQ5 / KCNE3 + CBZ
KCNQ5 / KCNE3 + CBZ
-100 -80 -60 -40 -20
g at -80mV g at 0mV
g at -80mV g at 0mV
g at -80mV g at 0mV
Abbildung 3.18: Konzentrationsabhängige Wirkung von CBZ auf koexprimierte KCNQ5/KCNE3 Kanäle.
Die Originalströme einer KCNQ5/KCNE3 injizierten Oozyte bei 40mV zeigen nach Zugabe von 100µM CBZ-
Lösung (A) keine Veränderung, während 10µM eine Steigung der Stromamplitude provoziert und 300µM einen
gegenteiligen Effekt bewirkt (B, C). Die Darstellungen des analysierten KCNQ5/KCNE3 Leitwertes bestätigen
diese Befunde (D, E, F). (n = 10)
Auch die Analyse des Leitwertes g bei 0mV bestätigten sowohl einen signifikanten Anstieg
bei 10µM CBZ-Lösung (Abb. 3.18 D), als auch eine signifikante Reduktion des Leitwertes
dieser Kanalproteine in Anwesenheit von 300µM CBZ-Lösung (Abb. 3.18 F).
Im Gegensatz dazu, zeigte sich nach Zugabe einer 100µM EPX-Lösung eine deutliche
Reduktion der KCNQ5/KCNE3 Ströme, die auch aus dem Vergleich der Originalableitungen
(Abb. 3.19 A, B) zu entnehmen ist. Des Weiteren ist festzustellen, dass die Anwesenheit von
EPX eine Aktivierung der Ströme bei stark negativen Klemmspannungen bewirkte, was auch
durch die Leitwerterhöhung bei -80mV zum Ausdruck kam (Abb. 3.19 D). In der Darstellung
der über einander projizierten Strom-Spannungs-Kurven (Abb. 3.19 C) wurde die Reduktion
der Ströme in Anwesenheit von EPX ab einer Spannung von -60mV deutlich. Die Analyse
des KCNQ5/KCNE3 Leitwertes zeigte ebenfalls eine signifikante Reduktion bei 0mV (Abb.
B KCNQ5 / KCNE3 + EPX
C KCNQ5 / KCNE3 + EPX
-100 -80 -60 -40 -20
g at -80mV g at 0mV
Abbildung 3.19: Wirkung von EPX auf KCNQ5/KCNE3 Kanäle. Die Stromableitungen einer
KCNQ5/KCNE3 injizierten Oozyte (A) zeigen nach Zugabe einer 100µM EPX-Lösung einen deutlichen
Rückgang der Stromamplitude (B). Diese Wirkung wird auch in der Darstellung der Strom-Spannungs-Kurven
eines repräsentativen Experimentes deutlich (C). Die Analyse des Leitwertes der koinjizierten KCNQ5/KCNE3
Kanäle in Anwesenheit von EPX wird in der Grafik D vorgestellt.
Der Vergleich der Wirkung von CBZ und EPX zeigt gegensätzliche Reaktionen der
KCNQ5/KCNE3 Kanäle. Die normierten Strom-Spannungs-Kurven auf 40mV unterstreichen
die schon beschriebenen Ergebnisse von CBZ (Abb. 3.20 A) und zeigen eine
konzentrationsanhängige Wirkung auf KCNQ5/KCNE3 Kanäle. Demgegenüber zeigte sich
die Wirkung von EPX weniger konzentrationsabhängig, sondern lenkte die Aufmerksamkeit
auf spannungsabhängige Unterschiede (Abb. 3.20 D). Die Gegenüberstellung der
KCNQ5/KCNE3 Ströme bei +30mV zeigt nach Zugabe einer 10µM CBZ-Lösung (Abb. 3.20
B) eine signifikante Erhöhung der Stromamplitude um 23%, 10µM EPX-Lösung dagegen
eine Reduktion der Stromamplitude um 60% (Abb. 3.20 E). Während das Niveau der EPX
Inhibition auch durch stärker konzentriertere EPX-Lösung annährend gleich geblieben ist,
zeigte die höchste getestet CBZ-Konzentration (300µM) eine signifikante Inhibition der
Ströme bei +30mV um 23%. Auffällig war jedoch, dass nach der Auswaschperiode das
Inhibitionsniveau beider Testsubstanzen unverändert blieb (Abb. 3.20 B, E). Der IC50 Wert
für EPX lagt bei 3µM.
A KCNQ5 / KCNE3 + CBZ
KCNQ5 / KCNE3 + CBZ
Membranpotenzial
KCNQ5 / KCNE3 + CBZ
con 10µM 100µM 300µM ncon
-100 -80 -60 -40 -20
con 10µM 100µM 300µM ncon
D KCNQ5 / KCNE3 + EPX
KCNQ5 / KCNE3 + EPX
Membranpotenzial
KCNQ5 / KCNE3 + EPX
con 3µm 10µM 100µM ncon
-100 -80 -60 -40 -20
con 3µM 10µM 100µM ncon
Abbildung 3.20: Vergleich der Wirkung von CBZ und EPX auf KCNQ5/KCNE3 Kanäle. Normierte
Strom-Spannungs-Kurven zeigen nach Zugabe von CBZ eine konzentrationsabhängige Wirkung (A), die in
Anwesenheit von EPX auch bei kleineren Konzentrationen einen inhibierenden Effekt darstellt (D). Die
Grafiken B und E stellen die Ströme bei +30mV nach Zugabe unterschiedlicher Konzentrationen der jeweiligen
Testsubstanz dar. Die Wirkung von CBZ (C) und EPX (F) auf das Membranpotenzial zeigt ebenfalls erhebliche
Unterschiede. (CBZ n = 10; EPX n = 6)
Des Weiteren konnte in Anwesenheit von EPX (10µM und 100µM) eine signifikante
Hyperpolarisation des Membranpotenzials beobachtet werden (Abb. 3.20 F). Demgegenüber
konnte die 10µM und 100µM CBZ-Lösung keinen Effekt auf das Membranpotenzial erzielen,
wobei die Anwesenheit einer 300µM CBZ-Lösung eine leichte, dennoch signifikante
Depolarisation der KCNQ5/KCNE3 injizierten Oozyte bewirkte (Abb. 3.20 C).
3.9 Vergleich der Wirkung von Carbamazepin-10,11-Epoxid auf KCNQ5,
KCNQ5/KCNE3 und KCNQ1/KCNE3 Kanäle
Vorangegangene Untersuchungen haben gezeigt, dass die Anwesenheit von EPX eine starke
Inhibition der KCNQ5/KCNE3 Stromamplituden vermittelt hat. Dabei konnte beobachtet
werden, dass sich bei negativen Klemmspannungen ein gegenteiliger Effekt bemerkbar
machte. Diese Beobachtung kann durch die Auswertung der Tail-Ströme, die als apparente
Offenwahrscheinlichkeit durch eine I/Imax Kurve dargestellt sind (Abb. 3.21 A), bestätigt
werden. Daraus lässt sich ableiten, dass die Offenwahrscheinlichkeit der KCNQ5/KCNE3
Kanalproteine in Anwesenheit von EPX ganz deutlich ansteigt. Die Berechnung der
halbmaximalen Aktivierungsspannung V1/2 = -41,8 ± 3,6 mV für Kontrolle und V1/2 = -57,7 ±
5,8mV in Anwesenheit von 100µM EPX haben eine deutliche Verschiebung der I/Imax
Kurve zu negativeren Spannungen gezeigt (3µM V1/2 = -53,7 ± 5,7mV und 10µM V1/2 = -58,5
± 6,9mV). Die Offenwahrscheinlichkeit der KCNQ5/KCNE3 Kanäle in Anwesenheit von
CBZ wurde dagegen nicht beeinflusst (Daten nicht gezeigt).
In Anbetracht der Tatsache, dass Xenopus laevis Oozyten auch einen endogenen xKCNQ1
besitzen (Goldin 1991), wurde auch eine Testreihe mit koinjizierten KCNQ1/KCNE3
Kanälen durchgeführt. Diese Ergebnisse haben allerdings gezeigt, dass die Anwesenheit von
EPX weder einen Einfluss auf die Stromamplitude (Daten nicht gezeigt), noch auf die
Offenwahrscheinlichkeit der KCNQ1/KCNE3 Kanäle ausgeübt hat (Abb. 3.21 B).
A KCNQ5 / KCNE3 + EPX B KCNQ1 / KCNE3 + EPX C
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
-100 -80 -60 -40 -20 0
Abbildung 3.21: Gegenüberstellung der Wirkung von EPX auf KCNQ5/KCNE3, KCNQ1/KCNE3 und
KCNQ5 Kanäle. Die Darstellung der apparenten Offenwahrscheinlichkeit anhand der I/Imax Kurven, die in
dieser Abbildung auf die maximale Amplitude und nicht auf die Werte bei +40mV normiert wurden, zeigen den
unterschiedlichen Einfluss von EPX auf KCNQ5/KCNE3 (A), KCNQ1/KCNE3 (B) und KCNQ5 (C) Kanäle.
Im Gegensatz dazu vermittelte EPX eine erhöhte Offenwahrscheinlichkeit der KCNQ5
Kanäle, die hier durch eine modifizierte Darstellung der I/Imax Kurven gezeigt wird (Abb.
3.21 C). Die Werte wurden nicht, wie bisher gezeigt, auf +40mV normiert, sondern auf den
jeweiligen Maximalwert, da die I/Imax Kurven der KCNQ5 und KCNQ5/KCNE3 Kanäle bei
positiven Spannungen einen Inaktivierungsvorgang beschreiben.
Zusammengefasst konnte beobachtet werden, dass sowohl KCNQ5 als auch KCNQ5/KCNE3
Kanäle eine Inhibition der Gesamtstromamplitude als Antwort auf die Zugabe von EPX
zeigten. Dabei wurde der Strom um bis zu ca. 60% reduziert (10µM und 100µM EPX) (Abb.
3.9 E; Abb. 3.19 E). Bei beiden Kanälen konnte des Weiteren in Anwesenheit von EPX ein
erhöhter Leitwert bei -80mV (Abb. 3.7 E; Abb. 3.19 D) und eine Hyperpolarisation der
Membran beobachtet werden. Allerdings zeigten KCNQ5/KCNE3 Kanälen nach Inkubation
mit EPX eine deutlich höhere Offenwahrscheinlichkeit (Abb. 3.21A) als KCNQ5 Kanäle
(Abb. 3.21 C). Diese stärkere Empfindlichkeit der KCNQ5/KCNE3 Kanäle gegenüber dem
EPX könnte einen weiteren Hinweis auf eine Interaktion der beiden Untereinheiten darstellen.
4 Diskussion
KCNQ-Kanäle haben eine bedeutende physiologische und pathophysiologische Rolle im
menschlichen Organismus (Jentsch, 2000). Durch ihre große funktionelle Vielfalt, die
zusätzlich noch durch Assemblierung mit akzessorischen ß-Untereinheiten der KCNE-Familie
vervielfacht wird und ihre zahlreiche Lokalisationen in unterschiedlichen Gewebesorten stellt
diese Kaliumkanalfamilie eine große Breite an möglichen Angriffspunkten für Medikamente
dar. So zeigen sich neuronale KCNQ-Kanäle für die Entwicklung von Medikamenten gegen
Krankheiten wie Epilepsie oder chronische Schmerzzustände als viel versprechende
Angriffspunkte. Von besonderer Bedeutung ist dabei eine ausschließliche Wirkung auf
neuronale KCNQ-Kanäle (KCNQ2-KCNQ5), um KCNQ1 vermittelte, kardiale
Nebenwirkungen zu vermeiden (Tatulian et al. 2001).
Ein vielseitig eingesetztes Antiepileptikum stellt das Carbamazepin (CBZ) dar. Seine
Hauptwirkung beruht auf der Hemmung spannungsgesteuerter Natriumkanäle (Willow et al.
1984), die in großer Dichte mit spannungsgesteuerten KCNQ-Kanälen kolokalisiert sind,
besonders am Axonhügel der Neuronen (Maljevic et al. 2008).
Die Ergebnisse dieser Arbeit zeigen eine bisher nicht bekannte Wirkung von CBZ auf
KCNQ-Kanäle. So konnte auch in Anwesenheit des metabolischen Folgeproduktes
Carbamazepin-10,11-Epoxid (EPX), dem ebenfalls antiepileptische Eigenschaften
zugesprochen werden (Albright et al. 1984; Bourgeois et al. 1984a), eine starke Wirkung auf
KCNQ-Kanäle beobachtet werden. Diese Wirkung war sehr komplex, wobei ganz klar
hervorgeht, dass EPX im Vergleich zu CBZ eine viel größere Potenz aufweist. Demgegenüber
konnte auch gezeigt werden, dass KCNQ1 generierte Ströme nicht von CBZ beeinflusst
4.1 Untersuchungen von KCNQ- Kanälen im Expressionssystem der Oozyte
Das in dieser Arbeit gewählte Expressionssystem der Xenopus Oozyte bietet neben einer
recht unkomplizierten Handhabung der Versuchstiere und einer gut erlernbaren Technik der
Gewinnung einer großen Anzahl an Oozyten auch eine gut etablierte Methode zur
pharmakologischen Untersuchung an ausgewählten Ionenkanälen (Dascal 1987). Ein Nachteil
zeigt sich allerdings durch die Größe der Oozyte und der dadurch bedingten großen Kapazität
ihrer Plasmamembran (Goldin 1991). Aus diesem Grund stellt sich das Membranpotenzial
nicht sofort nach Anlegen eines Kommandopotenzials ein. Die Kapazitäten können zwar am
Verstärker kompensiert werden, aber es bleibt sehr schwierig, Ströme innerhalb der ersten
Millisekunden nach einem Spannungssprung zu messen. Dieser Umstand wurde insbesondere
bei der Analyse der Tail-Ströme berücksichtigt indem der Zeitpunkt der zu analysierenden
Tail-Ströme außerhalb dieser kapazitiven Transienten gelegt wurde.
An dieser Stelle sollte auch Eigenkritik geäußert werden. Üblicherweise verwendet man für
die Analyse der Tail- Ströme ein Spannungsprotokoll, das wesentlich negativere Spannungen
beschreibt (z.B. -140mV bis +40mV), um so z.B. Spannungsverschiebungen zu negativeren
Potenzialen besser darstellen zu können. Für die meisten Experimente war zwar das gewählte
Spannungsprotokoll beginnend ab -90mV für die Darstellung der I/Imax Kurve ausreichend,
für den koexprimierten KCNQ5/KCNE3 Kanal hätte man sich jedoch ein etwas größeres
Spannungsfenster wünschen können.
Des Weiteren soll an dieser Stelle die Bedeutung der endogenen Proteine der Oozyten
diskutiert werden. So besitzen die Xenopus laevis Oozyten endogene xKCNQ1 Kanäle, die
z.B. bei der Koexpression von KCNQ5 und KCNE3 Kanälen eine relevante Rolle spielen
könnten. Bei starker Expression eines bestimmten Kanalproteins ist der Strom durch den zu
untersuchenden Ionenkanal dominierend (Schwake et al. 2010), was bedeutet, dass der
gemessene Strom fast ausschließlich auf den gewünschten Kanal zurückzuführen ist. Die
Ergebnisse der pharmakologischen Untersuchung von CBZ zeigen außerdem, dass H2O
injizierte Oozyten nicht von CBZ oder EPX beeinflusst werden. Auch KCNQ1 injizierte
Oozyten zeigen keine Änderungen der Parameter in Anwesenheit von CBZ. Allerdings ist es
denkbar, dass es bei einer Koinjektion von KCNQ5/KCNE3 möglicherweise zu einer
Interaktion zwischen KCNE3 und dem endogenen xKCNQ1 kommen könnte. Am Beispiel
der Entdeckung von KCNE1, der interessanterweise acht Jahre vor der Entdeckung von
KCNQ1 kloniert wurde (Takumi et al. 1988), konnte gezeigt werden, dass KCNE1 mit dem
endogenen xKCNQ1 assemblieren kann. Damals konnte man sich nicht erklären, wie so ein
kleines Protein in Xenopus laevis Oozyten einen großen, spannungsabhängigen und sehr
langsam aktivierenden Kaliumstrom induzieren konnte und warum dieser Strom in keinem
anderen Expressionssystem zu beobachten war. Heute weiß man, dass KCNE1 nicht selbst
einen Kanal bilden kann, sondern mit KCNQ1 assoziiert, um einen heteromeren Kanal zu
formen (Barhanin et al.1996; Sanguinetti et al.1996). Auf der anderen Seite zeigt eine ganz
neue Studie (Roura-Ferrer et al.2009), dass KCNQ5 mit anderen KCNE-Untereinheiten
funktionstüchtige Kanäle bildet. So zeigt Roura-Ferrer et al., dass KCNQ5 koinjiziert mit
KCNE3 sowohl im Expressionssystem der Oozyte als auch in HEK-293-Zellen einen Kanal
bilden, der verglichen mit homomeren KCNQ5, eine mehr als 60% niedrigere
Stromamplitude aufweist und bei stark negativen Spannungen schneller aktiviert. Diese
Befunde stehen in Übereinstimmung mit den gezeigten Ergebnissen dieser Arbeit.
Des Weiteren wird schon seit der Klonierung von KCNQ5 über die physiologische Rolle
akzessorischer KCNE-Untereinheiten kontrovers diskutiert (Schroeder et al.2000b; Lerche et
al.2000). Während Lerche et al. der tatsächliche Beweis für die Interaktion mit KCNE-
Untereinheiten noch fehlt, bezweifelt Schroeder et al. überhaupt die physiologische Relevanz
dieser Konstellationen auf Grund fehlender Präsenz der KCNE-Untereinheiten im neuronalen
Gewebe und in der Muskulatur. Heutzutage liegt eine Vielzahl an Beweisen für eine Relevanz
dieser Interaktion vor. So wurde KCNE1 mRNA in der Skelettmuskulatur der Maus mittels
PCR nachgewiesen (Lesage et al. 1992). Des Weiteren konnte eine Expression von allen
KCNE- Untereinheiten und KCNQ5 in vaskulären glatten Muskelzellen nachgewiesen
werden (Yeung et al. 2007) und eine pathophysiologische Bedeutung der KCNE3
Untereinheit in muskulärem Gewebe zeigte sich durch Mutationen in dieser akzessorischen
Untereinheit, die zu periodischen Paralysen führen kann (Abbott et al. 2001).
Eine Assemblierung von KCNQ5 und KCNE3 ist also durchaus denkbar, was durch Studien
an HEK-293-Zellen bekräftig wird (Roura-Ferrer et al.2009). Einen weiteren Hinweis
könnten auch die Ergebnisse dieser Arbeit liefern, die zeigen, dass KCNQ1/KCNE3 Kanäle
nicht sensitiv auf EPX reagieren, während KCNQ5/KCNE3 injizierte Oozyten in
Anwesenheit von EPX eine wesentlich größere Offenwahrscheinlichkeit und eine
Linksverschiebung der Aktivierungskurve aufzeigen, die sich in ihrer Größe deutlich von
KCNQ5 injizierten Oozyten unterscheiden.
4.2 Akzessorische KCNE-Untereinheiten steigern die Empfindlichkeit auf
Auf der Suche nach einem mutierten Protein, das verantwortlich für die Entstehung der
hereditären Form des Long-QTSyndroms ist, wurde 1996 der spannungsabhängige
Kaliumkanal KCNQ1 kloniert. Das inzwischen sehr gut untersuchte Beispiel der Interaktion
von KCNQ1 und der akzessorischen KCNE1-Untereinheit zeigt die physiologische
Bedeutung in der Repolarisationsphase des kardialen Aktionspotenzials. Mutationen in einer
der beiden Untereinheiten können zu kardialen Arrythmien (Long-QTSyndrom) und in
Abhängigkeit vom Erbgang auch noch zusätzlich zu kongenitaler Taubheit (JLN-Syndrom)
führen (Barhanin et al.1996; Sanguinetti et al. 1996). Diesem heteromeren Kaliumkanal liegt
demnach die Entstehung des kardialen Iks-Stroms zugrunde. Dieser Iks-Strom zeichnet sich
durch eine langsame Aktivierung durch die Depolarisation der Membran aus, die zur
Beschleunigung der Repolarisation der Kardiomyozyten in der dritten Phase des
Aktionspotenzials führt. Die Koexpression von KCNQ1/KCNE1 im Innenohr steht im
Zusammenhang mit der Endolymphproduktion (Rivas, Francis 2005; Warth, Barhanin 2002)
In dieser Arbeit wurde die Wirkung von CBZ auf diesen Kanal untersucht. Dabei zeigte sich,
dass der homomere KCNQ1 Kanal nicht von CBZ beeinflusst wurde, während bei
Koexpression mit KCNE1 ein Anstieg der Stromamplitude bei positiven Spannungen in
Anwesenheit von CBZ beobachtet werden konnte. Dieser Anstieg der Ströme kann mit einem
signifikant erhöhten Leitwert der KCNQ1/KCNE1 exprimierenden Oocyte bei +30mV erklärt
Interessant in diesem Zusammenhang ist das häufig beschriebene Phänomen einer CBZ
induzierten Bradykardie (Arhan et al. 2009; Kasarskis et al. 1992; Kaul et al. 2000), die
sowohl bei therapeutischen Dosierungen, als auch bei Überdosierungen beobachtet wird.
Andere Studien, die an Hunden durchgeführt wurden zeigen ebenfalls, dass CBZ in strukturell
gesundem kardialen System bradykarde Symptome auslösen kann (Steiner et al. 1970). Des
Weiteren scheint die Einnahme von CBZ auch das auditorische System zu beeinflussen. De la
Cruz et al. beschreibt, dass CBZ eine temporäre, bilaterale Taubheit nach Überdosierung
induzieren kann (de la et al. 1999).
Der Befund der Aktivierung des KCNQ1/KCNE1 Kanals in Anwesenheit von CBZ wurde bei
einer Konzentration von 100µM CBZ (23mg/l) beobachtet, die sich außerhalb der
therapeutischen Dosierung befindet. So verdeutlichen die Ergebnisse dieser Arbeit und die
vorgestellten Studien noch einmal wie wichtig die richtige Einstellung des therapeutischen
Bereiches und eine regelmäßige Kontrolle des Serumspiegels bei CBZ Patienten sind.
Die Koexpression von KCNQ1/KCNE3 zeigte in Anwesenheit von CBZ ebenfalls eine
signifikante Aktivierung der Ströme bei positiven Spannungen. Allerdings vermittelte CBZ
bei negativen Spannungen eine verminderte Offenwahrscheinlichkeit, die von einem
signifikant erniedrigten Leitwert bei -80mV begleitet wurde. Diese Befunde weisen auf eine
spannungsabhängige Wirkung von CBZ hin. Diese spannungsabhängige CBZ Wirkung wird
ebenfalls auf spannungsabhängige Na+-Kanäle beschrieben (Willow et al. 1985), die den
Hauptangriffspunkt in der antikonvulsiven Behandlung mit CBZ darstellen.
KCNQ1/KCNE3 Kanäle befinden sich vermehrt in Kolonkrypten, wo sie in die Cl- -Sekretion
involviert sind (Schroeder et al. 2000b; Greger et al. 1997; Bleich et al. 1997). Studien zeigen,
dass die spezifische Hemmung dieser cAMP-abhängigen Kaliumkanäle mit dem Wirkstoff
293B zum fast kompletten Abfall elektrogener Cl- - Sekretion führen kann (Warth et al.
Ussing-Kammer Untersuchungen an isolierten Kolongewebestücken (Sievers, 2008) zeigen
eine konzentrationsabhängige Inhibition der cAMP-vermittelten Cl- - Sekretion in
Anwesenheit von CBZ. Dabei konnte im zeitlichen Verlauf ein initial aktivierender Effekt,
gefolgt von einer stärkeren Inhibition beobachtet werden. Diese Befunde liesen sich durch
weitere Analysen zellulärer Mechanismen auf eine CBZ vermittelte Reduktion der cAMP-
Konzentration und einer kurzfristigen Steigerung der Ca2+-Aktivität zurückführen. Weitere
Studien zeigen ebenfalls, dass CBZ die cAMP-Produktion hemmen kann (Chen et al. 1996),
indem CBZ die Forskolin-induzierte Phosphorylierung des CREP (cAMP response element
binding protein), das für die Aktivierung der Adenylatcyclase (AC) notwendig ist, inhibiert.
Diese Befunde können auch im Zusammenhang mit den gezeigten Ergebnissen der
vorliegenden Arbeit gebracht werden. So ist anzunehmen, dass der verminderte Leitwert und
die reduzierte Offenwahrscheinlichkeit der KCNQ1/KCNE3 Kanäle nach Zugabe von CBZ
durch die Reduktion der cAMP-Konzentration erklärt werden kann. Demzufolge vermittelt
CBZ die Inhibition der cAMP-vermittelten Cl- - Sekretion indirekt auch über den cAMP-
abhängigen KCNQ1/KCNE3 Kaliumkanal. Dass second Messenger wie cAMP im
Expressionssystem der Xenopus laevis Oozyte zur Verfügung stehen, zeigen zahlreiche
Studien, die Rezeptoren in der Membran der Oozyte identifiziert haben, die über diesen
second Messenger fungieren (Lotan et al. 1982; Sumikawa et al. 1984; Woodward et al.
1987). Der bei positiven Spannungen beobachtete aktivierende Effekt von CBZ zeigt die
Komplexität der Wirkung dieses Pharmakons. Zusätzlich zur Aktivierung, verändert CBZ die
Aktivierungskinetik dieser Kanäle (Zeitkonstante signifikant erniedrigt). Die Zunahme der
Stromamplitude kann mit dem gesteigerten Leitwert bei 0mV und +30mV erklärt werden.
Diese Befunde könnten einen Hinweis auf eine direkte Wirkung an KCNQ1/KCNE3 Kanälen
darstellen, wobei ein weiteres, in die CBZ Wirkung involviertes System nicht ausgeschlossen
Zusammenfassend lässt sich festhalten, dass die Assemblierung von KCNQ1 mit
akzessorischen Untereinheiten wie KCNE1 und KCNE3 die pharmakologischen
Eigenschaften dahingehend verändert, dass die Empfindlichkeit auf das Antikonvulsivum
4.3 Vergleich der Wirkung von CBZ und EPX
Das trizyclische Antikonvulsivum CBZ und sein metabolisches Folgeprodukt EPX zeigen
unterschiedlich starke Wirkungen auf neuronale KCNQ Kanäle (s. Ergebnisse). CBZ stellt
das Mittel der ersten Wahl in der Behandlung von partiellen und tonisch-clonischen
Krämpfen dar (Bertilsson et al. 1986). Bei Monotherapie mit CBZ wird ein therapeutischer
Bereich von 4-12 mg/l empfohlen. Höhere Konzentration führen häufig zu Nebenwirkungen,
die sogar die Krampfbereitschaft verstärken können (Bridge et al. 1994; Schmidt et al. 1995).
Der Wirkmechanismus von CBZ ist bisher nur teilweise geklärt. CBZ stabilisiert übererregte
Nervenmembranen und hemmt Entladungen von Nervenzellen. Damit wird die
Krampfschwelle angehoben, sowie die Schmerzüberleitung vermindert. CBZ entfaltet seine
Hauptwirkung auf neuronale spannungsabhängige Na+-Kanäle (Willow et al. 1985).
Außerdem wird auch eine inhibitorische Wirkung auf spannungsanhängige Ca2+ Kanäle
beschrieben (Schirrmacher et al. 1993; Walden et al. 1993). Auf diese Weise scheint CBZ
dem Anstieg der intrazellulären Ca2+ -Konzentration in Nervenzellen während epileptischer
Aktivität entgegenzuwirken (Wiemann et al. 1996).
Auch das metabolische Folgeprodukt EPX weist antiepileptische Eigenschaften auf (Albright,
Bruni 1984; Bourgeois et al. 1984b). Dabei werden häufig Nebenwirkungen im
Zusammenhang mit einer erhöhten Konzentration dieses Metaboliten gebracht. So wird
während einer CBZ Therapie ein Plasmakonzentrationsverhältnis von etwa 1:10 bis 1:5
(EPX:CBZ) angegeben, wobei Kombitherapien das Verhältnis zugunsten des EPX verändern
können, was mit erheblichen Nebenwirkungen einher gehen kann (Schoeman et al. 1984).
Des weiteren zeigt sich eine lineare Beziehung zwischen der Gehirn- und
Plasmakonzentration sowohl von CBZ als auch von EPX (Morselli et al. 1977).
Die Ergebnisse dieser Arbeit zeigen eine bisher nicht beschriebene Wirkung von CBZ und
EPX auf neuronale KCNQ-Kaliumkanäle. Dabei konnten erhebliche Unterschiede in der
Wirkung dieser beiden Testsubstanzen beobachtet werden: 1) Während CBZ die
Offenwahrscheinlichkeit der neuronalen Kaliumkanäle nicht, bzw. nur sehr geringfügig
(KCNQ5/KCNQ3) beeinflusste, zeigte sich in Anwesenheit von EPX bei allen getesteten
neuronalen KCNQ-Kanälen eine erhöhte Offenwahrscheinlichkeit und eine Verschiebung der
halbmaximalen Aktivierungsspannung in Richtung hyperpolarisierende Spannungen. 2) Die
erhöhte Offenwahrscheinlichkeit nach Zugabe von EPX wurde von signifikanter
Hyperpolarisation der Membran begleitet, während CBZ keinen Einfluss auf die
Membranspannung ausgeübt hat. 3) Des Weiteren zeigte sich bei depolarisierenden
Spannungen eine zusätzliche inhibitorische Wirkung auf die Stromamplituden in
Anwesenheit von EPX, mit Ausnahme der KCNQ3 Kanäle, wobei die Zugabe von niedrig
konzentrierten CBZ-Lösungen bei KCNQ5/KCNQ3 und KCNQ5/KCNE3 Kanälen einen
gegenteiligen, aktivierenden Effekt auf die Stromamplituden bewirkte. 4) Einen weiteren
Unterschied stellt der IC50 Wert dar. (Dieser wurde aus den Konzentrations-Wirkungs Kurven
unter der Annahme einer maximalen Hemmung von 100% des Stromes errechnet und damit
im Zweifelsfall sogar überschätzt.) So zeigte sich bei KCNQ5 Kanälen bei stark
depolarisierenden Spannungen eine Inhibition der Stromamplituden, sowohl mit CBZ als
auch EPX behandelten Kanälen. Während jedoch der IC50 Wert von CBZ deutlich größer
300µM einzugrenzen ist, zeigt EPX einen IC50 kleiner 10µM (2,3mg/l). Bei heteromeren
Kanälen wie KCNQ5/KCNQ3 und KCNQ5/KCNE3 lässt sich in Anwesenheit von EPX sogar
der IC50 Wert ≤ 3µM (≤ 0,7 mg/l) eingrenzen, wobei die Zugabe von EPX bei
KCNQ5/KCNQ3 Kanälen scheinbar eine maximale Inhibition der Ströme um 30% bewirkte.
Die neuronalen KCNQ-Kanäle haben ihre physiologische Bedeutung in der
Aufrechterhaltung und Wiederherstellung des Ruhemembranpotenzials. Ein Verlust oder die
Reduktion ihrer Aktivität kann zur neuronalen Übererregbarkeit führen, die als
Entstehungsursache epileptischer Krampfanfälle angesehen wird. Dieser Zusammenhang
zeigt sich auch bei Mutationen der KCNQ2 und KCNQ3 Kanäle, die zur Entstehung einer
Form frühkindlicher Epilepsie (BFNC) führen (Biervert et al. 1998). Diese Kanäle, genau so
wie KCNQ4 und KCNQ5, tragen zu dem durch Muskarin aktivierbaren K+ -Strom (sog. M-
Strom) bei, der eine wichtige Rolle bei der Regulation der Erregbarkeit von Neuronen spielt.
In diesem Zusammenhang könnten die vorgestellten Ergebnisse, die auf eine sehr komplexe
Wirkung von EPX und CBZ hindeuten, einen begründeten Hinweis auf das so enge
therapeutische Fenster liefern. Da sich in Anwesenheit von EPX zusätzliche Veränderungen
der Aktivierungsparameter zeigen, könnte das in Übereinstimmung mit der in der Literatur
beschriebenen antiepileptischen Wirkung, die bei EPX vermutet wird, stehen. Zusätzlich zeigt
sich auch in Anwesenheit von CBZ eine Aktivierung von KCNQ3, KCNQ5/KCNQ3 und
KCNQ5/KCNE3 Strömen bei positiven Spannungen, allerdings nur bei Konzentrationen
(3µM und 10µM), die sich im therapeutischen Bereich befinden. Höhere Konzentrationen von
CBZ scheinen einen gegenteiligen Effekt an diesen Kanälen zu bewirken, was wiederum für
den empfohlenen therapeutischen Bereich sprechen würde. Eine Ausnahme scheint der
KCNQ3 Kanal darzustellen, der auch bei höheren Konzentrationen beider Testsubstanzen
einen Anstieg der Stromamplituden zeigte. Neben den Befunden, die Hinweise auf eine
unterstützende antikonvulsive Wirkung von CBZ und EPX auf neuronale KCNQ Kanäle
hindeuten, könnten die inhibitorischen Komponenten der CBZ und EPX vermittelten
Wirkung möglicherweise eine Begründung für die beobachteten Nebenwirkungen, wie die
Verstärkung der Krampfbereitschaft bei Überdosierung (Bridge et al. 1994; Schmidt et al.
1995) darstellen. Die höhere Empfindlichkeit der neuronalen KCNQ Kanäle auf das EPX
kann die Notwendigkeit einer regelmäßigen Kontrolle der CBZ:EPX Verhältnisse
unterstreichen. So korrelieren Veränderungen, die ein zugunsten von EPX verschobenes
CBZ:EPX Verhältnis aufweisen oder größere absolute Konzentration von EPX im Plasma
zeigen, mit klinischen Nebenwirkungen (Schoeman et al. 1984). Es ist daher sehr wichtig bei
Therapieansetzen, besonders bei Kombinationstherapien, eine regelmäßige Kontrolle beider
Wirkspiegel zu überprüfen.
4.4 Bedeutung der CBZ und EPX Wirkung auf neuronale KCNQ Kanäle
Ströme durch neuronale KCNQ-Kanäle weisen durch ihre biophysikalischen und
pharmakologischen Eigenschaften sowie ihr neuronales Expressionsprofil
Übereinstimmungen mit dem sog. M-Strom auf und werden als das molekulare Korrelat
dieses Stroms angesehen (Schroeder et al. 2000a). Der M-Strom wird durch die
auswärtsgerichteten K+-Ströme, die unterhalb des Schwellenwertes unmittelbar vor
Auslösung eines Aktionspotenzials von Bedeutung sind, repräsentiert. Er spielt eine
dominante Rolle bei der Kontrolle neuronaler Erregbarkeit und der Abstimmung der
Feuerverhaltens von Neuronen (Halliwell et al. 1982). Zahlreiche Rezeptoren und second
Messenger werden als Modulatoren des M-Stroms diskutiert. So scheint die intrazelluläre
Ca2+ Konzentration einen Einfluss auf den makroskopischen Strom auszuüben (Marrion
1997b). Weitere evidente Einflüsse auf dem M-Stom wurden durch intrazelluläres cAMP
(Schroeder et al. 1998) und membrangebunderes Phosphatidylinositol-4,5-biphosphat (PIP2)
(Suh et al. 2002) gezeigt.
Da Carbamazepin, wie zahlreiche Studien zeigen, die cAMP Konzentration reduzieren kann,
was höchstwahrscheinlich über eine direkte Wirkung auf die Adenylatzyklase (AC) vermittelt
wird (Mann et al. 2009; Montezinho et al. 2007), ist es nicht unwahrscheinlich, dass die
gezeigte Reduktion der Stromamplitude der KCNQ2/KCNQ3 Kanäle in Anwesenheit von
CBZ, auf diesen Wirkmechanismus zurückzuführen ist. Schroeder et al. konnte zeigen, dass
die Erhöhung der intrazellulären cAMP Konzentration einen Anstieg der KCNQ2/KCNQ3
Ströme vermitteln kann. Das wäre im Umkehrschluss mit den Befunden und der
Schlussfolgerung in Einklang zu bringen. Interessanterweise ergänzen Schroeder et al. ihre
Ergebnisse durch einen Hinweis, dass der cAMP vermittelte Effekt in Abhängigkeit von einer
intakten Phosphorylierung des N-Terminus der KCNQ2 Untereinheit steht. Die Ergebnisse
der pharmakologischen Wirkung von CBZ auf homomere KCNQ3 Kanäle zeigten eine
Aktivierung der Stromamplitude, was gegen einen über cAMP vermittelten Effekt und eher
für eine direkte kanalvermittelte Wirkung sprechen würde. Die Stromamplitude der
homomeren KCNQ2 Kanäle blieb nach Zugabe von CBZ unverändert. Es kann darüber nur
spekuliert werden, ob die Befunde an homomeren Kanälen eine kanalvermittelte Wirkung
darstellen und ob eine Assemblierung dieser Untereinheiten molekulare Gegebenheiten
schafft, die für eine cAMP vermittelte Wirkung von Notwendigkeit sind.
Pharmakologische Untersuchungen der homomeren KCNQ5 Kanäle und heteromere
Konstellation wie KCNQ5/KCNQ3 und KCNQ5/KCNE3 zeigen eine spannungsabhängige
Wirkung von CBZ und EPX. Diese komplexe Wirkung lässt sich in zwei gegensätzliche
Reaktionen einteilen. Eine Aktivierung der Kanäle bei stark negativen Spannungen, die durch
eine erhöhte Offenwahrscheinlichkeit, einer Verschiebung der Spannungsabhängigkeit zu
hyperpolarisierenden Spannungen und einer signifikanten Hyperpolarisation vermittelt wird
und ein zweiter Effekt, der besonders bei mittleren und positiven Spannungen eine
signifikante Inhibition der Stromamplitude bewirkt. Die antikonvulsive Wirkung beider
Testsubstanzen würde die aktivierenden Befunde gut unterstützen. Angelehnt an das
Wirkprofil von Retigabin, das seine antikonvulsive Wirkung durch eine direkte,
kanalvermittelte Aktivierung von neuronalen KCNQ Kanälen entfaltet (Schenzer et al. 2005;
Wickenden et al. 2000; Wickenden, Zou, Wagoner, Jegla 2001) könnten Gemeinsamkeiten
möglicherweise auf einen ähnlichen Mechanismus hindeuten. Retigabin aktiviert alle
neuronalen KCNQ Kanäle (KCNQ2-KCNQ5), wobei die gesteigerte Aktivität auf die
Erhöhung der maximalen Offenwahrscheinlichkeit und eine
Verschiebung der
Spannungsabhängigkeit zu hyperpolarisierenden Spannungen zurückzuführen ist (Tatulian et
al. 2001; Tatulian et al. 2003; Wickenden et al. 2001). Diese Befunde konnten in einer
abgeschwächten Form auch in Anwesenheit von EPX beobachtet werden (KCNQ2 und
KCNQ2/KCNQ3 nicht getestet). Weitere Gemeinsamkeit ist die fehlende Wirkung auf
KCNQ1 Kanäle. Eine sehr offensichtliche Wirkung allerdings unterscheidet diese
antikonvulsiven Präparate. Während Retigabin eine ganz eindeutige Aktivierung der
Gesamtstromamplitude vermittelt (Wickenden et al. 2001), zeigt die Anwesenheit von EPX
eine starke Inhibition der Stromamplituden der KCNQ5, KCNQ5/KCNQ3 und
KCNQ5/KCNE3 Kanäle. Auch die Anwesenheit von CBZ hemmt die Stromamplitude dieser
Kanäle, allerdings bei höheren Konzentrationen. Es kann darüber spekuliert werden, ob diese
Inhibition eine spannungsabhängige Wirkung von EPX und CBZ darstellt, oder womöglich
sekundäre Botenstoffe in diese Wirkung involviert sein könnten. Eine direkte
Schlussfolgerung auf den Wirkmechanismus erlauben die Befunde jedoch nicht. Die
Vermittlung der inhibitorischen Wirkung (bei KCNQ5, KCNQ5/KCNQ3 und
KCNQ5/KCNE3 Kanälen) über die Konzentration von cAMP scheint allerdings
unwahrscheinlich. Dafür spricht 1) dass die basale cAMP Konzentration der Xenopus laevis
Oozyte höchstwahrscheinlich nicht den Umfang der beobachteten Inhibition (bis zu 60%)
induzieren kann. 2) Diese Inhibition wurde sowohl in Anwesenheit von CBZ als auch von
EPX beobachtet, wobei CBZ bei niedrigeren Konzentrationen eine leichte Aktivierung
(KCNQ5/KCNQ3 und KCNQ5/KCNE3) der Stromamplitude zeigte. 3) Die Anwesenheit von
EPX zeigt keinen Einfluss auf cAMP-abhängige KCNQ1/KCNE3 Kanäle.
5 Zusammenfassung
KCNQ-Kanäle haben eine bedeutende physiologische und pathophysiologische Rolle im
menschlichen Organismus. Ihre funktionelle Vielfalt wird zusätzlich noch durch
Assemblierung mit verschiedenen akzessorischen ß-Untereinheiten der KCNE-Familie
erweitert. Diese Kaliumkanalfamilie ist Angriffspunkt für zahlreiche Medikamente und
erklärt ihre Wirkung bzw. Nebenwirkungen.
Carbamazepin (CBZ) ist ein Antikonvulsivum und wird seit den 50er Jahren des letzen
Jahrhunderts zur Behandlung fokaler und sekundär generalisierter Anfälle eingesetzt. Das
Anwendungsspektrum ist vielseitig und reicht von der Behandlung psychiatrischer
Erkrankungen wie akute Manien bis hin zum Diabetes insipidus centralis. Der bisher
bekannte Wirkungsmechanismus von Carbamazepin beruht hauptsächlich auf einer
reversiblen Bindung an spannungsgesteuerte Na+-Kanäle, wobei repetitive neuronale
Entladungen gehemmt werden. In Neuronen, besonders am Axonhügel sind diese Na+-Kanäle
in großer Dichte mit spannungsgesteuerten KCNQ-Kanälen kolokalisiert.
Ein metabolisches Folgeprodukt von CBZ ist das Carbamazepin-10-11-Epoxid (EPX), dem
ebenfalls antiepileptische Eigenschaften zugesprochen werden.
Die zentrale Fragestellung dieser Arbeit war die Wirkung von CBZ und EPX auf KCNQ
Kanäle. Im Expressionsmodel der Xenopus laevis Oozyte mit Hilfe der Zwei-Elektroden-
Spannungsklemmtechnik wurden pharmakologische und funktionelle Untersuchungen der
KCNQ Kanäle vorgenommen, die zu folgenden Ergebnissen geführt haben:
1) CBZ übte keinen Einfluss auf KCNQ1 Kanäle aus. Die Verbindung mit den ß-
Untereinheiten KCNE1 und KCNE3 änderte die pharmakologischen Eigenschaften
dahingehend, dass eine Aktivierung der Ströme bei positiven Spannungen beobachtet
werden konnte. Gleichzeitig zeigte sich eine inhibitorische Wirkung von CBZ auf
KCNQ1/KCNE3 Kanäle bei negativen Spannungen. EPX zeigte keinen Einfluss auf
KCNQ1/KCNE3 Kanäle.
2) Die Wirkung von CBZ und EPX auf neuronale KCNQ Kanäle war komplex. Im
therapeutisch relevanten Konzentrationsbereich führte EPX zu einer Aktivierung der
neuronalen KCNQ Kanäle durch eine größere Offenwahrscheinlichkeit bei negativen
Spannungen, einer Linksverschiebung der Aktivierungskurve und signifikant
erhöhtem Leitwert, begleitet von einer Hyperpolarisation der Membran. Diese
Befunde waren bei KCNQ5/KCNQ3 und KCNQ5/KCNE3 Kanälen am stärksten
ausgeprägt. Gleichzeitig zeigte sich eine inhibitorische Wirkung von CBZ und EPX
auf die Stromamplituden bei mittleren und positiven Spannungen. In diesem
Spannungsbereich war der Leitwert dieser neuronalen KCNQ Kanäle signifikant
erniedrigt. Diese Inhibition wurde allerdings nicht bei homomeren KCNQ2 und
KCNQ3 Kanälen beobachtet.
Die Ergebnisse dieser Arbeit zeigen erstmals, dass CBZ und sein Metabolit EPX ihre
Wirkung auch auf KCNQ Kanäle entfalten. Eine wesentlich potentere Wirkung wurde dabei
für den Metaboliten EPX festgestellt. Die Beobachtung der Aktivierung der neuronalen
KCNQ Kanäle bei negativen Spannungen könnte dazu beitragen, die antikonvulsive Wirkung
dieses Medikaments besser zu verstehen. Gleichzeitig deutet die inhibitorische
Wirkkomponente darauf hin, dass der ausgewählte therapeutische Konzentrationsbereich
streng limitiert werden muss, um unerwünschte Nebenwirkungen zu vermeiden.
6 Literaturverzeichnis
Alberts B, Johnson A, Lewis J, and Raff M, Roberts K, and Walter, P (2003).
"Molekularbiologie der Zelle", 4. Auflage (deutsch).
Ashcroft FM, (2000). Ion channels and disease. Academic Press.
Abbott GW, Butler MH, Bendahhou S, Dalakas MC, Ptacek LJ, Goldstein SA. MiRP2 forms
potassium channels in skeletal muscle with Kv3.4 and is associated with periodic paralysis.
Cell 2001;104:217-31.
Albright PS, Bruni J. Effects of carbamazepine and its epoxide metabolite on amygdala-
kindled seizures in rats. Neurology 1984;34:1383-86.
Arhan E, Aycicek S, Akaln N, Guven A, Kose G. Cardiac effects of carbamazepine treatment
in childhood epilepsy. Neurologist 2009;15:268-73.
Ballenger JC, Post RM. Carbamazepine in manic-depressive illness: a new treatment. Am J
Psychiatry 1980;137:782-90.
Barhanin J, Lesage F, Guillemare E, Fink M, Lazdunski M, Romey G. K(V)LQT1 and lsK
(minK) proteins associate to form the I(Ks) cardiac potassium current. Nature 1996;384:78-
80.
Barrons R, Roberts N. The role of carbamazepine and oxcarbazepine in alcohol withdrawal
syndrome. J Clin Pharm Ther 2010;35:153-67.
Bertilsson L, Tomson T. Clinical pharmacokinetics and pharmacological effects of
carbamazepine and carbamazepine-10,11-epoxide. An update. Clin Pharmacokinet
1986;11:177-9Biervert C, Schroeder BC, Kubisch C et al. A potassium channel mutation in
neonatal human epilepsy. Science 1998;279:403-6.
Biervert C, Schroeder BC, Kubisch C et al. A potassium channel mutation in neonatal human
epilepsy. Science 1998;279:403-6.
Bleich M, Briel M, Busch AE et al. KVLQT channels are inhibited by the K+ channel blocker
293B. Pflugers Arch 1997;434:499-501.
Bleich M, Riedemann N, Warth R et al. Ca2+ regulated K+ and non-selective cation channels
in the basolateral membrane of rat colonic crypt base cells. Pflugers Arch 1996;432:1011-22.
Bourgeois BF, Wad N. Individual and combined antiepileptic and neurotoxic activity of
carbamazepine and carbamazepine-10,11-epoxide in mice. J Pharmacol Exp Ther
1984a;231:411-15.
Bourgeois BF, Wad N. Individual and combined antiepileptic and neurotoxic activity of
carbamazepine and carbamazepine-10,11-epoxide in mice. J Pharmacol Exp Ther
1984b;231:411-15.
Braunhofer J, Zicha L. [Does Tegretal offer new possibilities of therapy in several
neurologic and endocrine diseases? A clinical electroencephalographic and thin-layer
chromatographic study]. Med Welt 1966;1875-80.
Bridge TA, Norton RL, Robertson WO. Pediatric carbamazepine overdoses. Pediatr Emerg
Care 1994;10:260-263.
Brown DA, Adams PR. Muscarinic suppression of a novel voltage-sensitive K+ current in a
vertebrate neurone. Nature 1980;283:673-76.
Brueggemann LI, Moran CJ, Barakat JA, Yeh JZ, Cribbs LL, Byron KL. Vasopressin
stimulates action potenzial firing by protein kinase C-dependent inhibition of KCNQ5 in A7r5
rat aortic smooth muscle cells. Am J Physiol Heart Circ Physiol 2007;292:H1352-H1363.
Cascorbi I. Pharmacogenetics of cytochrome p4502D6: genetic background and clinical
implication. Eur J Clin Invest 2003;33 Suppl 2:17-22.
Charlier C, Singh NA, Ryan SG et al. A pore mutation in a novel KQT-like potassium
channel gene in an idiopathic epilepsy family. Nat Genet 1998;18:53-55.
Chen G, Pan B, Hawver DB, Wright CB, Potter WZ, Manji HK. Attenuation of cyclic AMP
production by carbamazepine. J Neurochem 1996;67:2079-86.
Chen J, Zheng R, Melman YF, McDonald TV. Functional interactions between KCNE1 C-
terminus and the KCNQ1 channel. PLoS One 2009;4:e5143.
Cooper EC, Aldape KD, Abosch A et al. Colocalization and coassembly of two human brain
M-type potassium channel subunits that are mutated in epilepsy. Proc Natl Acad Sci U S A
2000;97:4914-19.
Courtney KR, Etter EF. Modulated anticonvulsant block of sodium channels in nerve and
muscle. Eur J Pharmacol 1983;88:1-9.
Dascal N. The use of Xenopus oocytes for the study of ion channels. CRC Crit Rev Biochem
1987;22:317-87.
de la Cruz CM, Bance M. Carbamazepine-induced sensorineural hearing loss. Arch
Otolaryngol Head Neck Surg 1999;125:225-27.
Dedek K, Kunath B, Kananura C, Reuner U, Jentsch TJ, Steinlein OK. Myokymia and
neonatal epilepsy caused by a mutation in the voltage sensor of the KCNQ2 K+ channel. Proc
Natl Acad Sci U S A 2001a;98:12272-77.
Dedek K, Waldegger S. Colocalization of KCNQ1/KCNE channel subunits in the mouse
gastrointestinal tract. Pflugers Arch 2001b;442:896-902.
Delmas P, Brown DA. Pathways modulating neural KCNQ/M (Kv7) potassium channels. Nat
Rev Neurosci 2005;6:850-862.
Delpon E, Cordeiro JM, Nunez L et al. Functional effects of KCNE3 mutation and its role in
the development of Brugada syndrome. Circ Arrhythm Electrophysiol 2008;1:209-18.
Engel J, Jr., Troupin AS, Crandall PH, Sterman MB, Wasterlain CG. Recent developments in
the diagnosis and therapy of epilepsy. Ann Intern Med 1982;97:584-98.
Gado-Escueta AV, Treiman DM, Walsh GO. The treatable epilepsies. N Engl J Med
1983;308:1508-14.
Goldin AL. Expression of ion channels by injection of mRNA into Xenopus oocytes.
Methods Cell Biol 1991;36:487-509.
Grahammer F, Herling AW, Lang HJ et al. The cardiac K+ channel KCNQ1 is essential for
gastric acid secretion. Gastroenterology 2001;120:1363-71.
Greger R, Bleich M, Riedemann N, Van DW, Ecke D, Warth R. The role of K+ channels in
colonic Cl- secretion. Comp Biochem Physiol A Physiol 1997a;118:271-75.
Greger R, Bleich M, Warth R. New types of K+ channels in the colon. Wien Klin
Wochenschr 1997b;109:497-98.
Greger R, Mall M, Bleich M et al. Regulation of epithelial ion channels by the cystic fibrosis
transmembrane conductance regulator. J Mol Med 1996;74:527-34.
Gutman GA, Chandy KG, Grissmer S et al. International Union of Pharmacology. LIII.
Nomenclature and molecular relationships of voltage-gated potassium channels. Pharmacol
Rev 2005;57:473-508.
Halliwell JV, Adams PR. Voltage-clamp analysis of muscarinic excitation in hippocampal
neurons. Brain Res 1982;250:71-92.
Hansen HH, Waroux O, Seutin V, Jentsch TJ, Aznar S, Mikkelsen JD. Kv7 channels:
interaction with dopaminergic and serotonergic neurotransmission in the CNS. J Physiol
2008;586:1823-32.
Heitzmann D, Grahammer F, von HT et al. Heteromeric KCNE2/KCNQ1 potassium
channels in the luminal membrane of gastric parietal cells. J Physiol 2004;561:547-57.
Heitzmann D, Warth R. Physiology and pathophysiology of potassium channels in
gastrointestinal epithelia. Physiol Rev 2008;88:1119-82.
Helbig I, Mefford HC, Sharp AJ et al. 15q13.3 microdeletions increase risk of idiopathic
generalized epilepsy. Nat Genet 2009;41:160-162.
Hille B, (2001) Ion channels of excitable membranes, 3rd edition. Sinauer associates.
Hubner CA, Jentsch TJ. Ion channel diseases. Hum Mol Genet 2002;11:2435-45.
Jensen HS, Callo K, Jespersen T, Jensen BS, Olesen SP. The KCNQ5 potassium channel
from mouse: a broadly expressed M-current like potassium channel modulated by zinc, pH,
and volume changes. Brain Res Mol Brain Res 2005;139:52-62.
Jensen HS, Grunnet M, Olesen SP. Inactivation as a new regulatory mechanism for neuronal
Kv7 channels. Biophys J 2007;92:2747-56.
Jentsch TJ. Neuronal KCNQ potassium channels: physiology and role in disease. Nat Rev
Neurosci 2000;1:21-30.
Jentsch TJ, Schroeder BC, Kubisch C, Friedrich T, Stein V. Pathophysiology of KCNQ
channels: neonatal epilepsy and progressive deafness. Epilepsia 2000;41:1068-69.
Jepps TA, Greenwood IA, Moffatt JD, Sanders KM, Ohya S. Molecular and functional
characterization of Kv7 K+ channel in murine gastrointestinal smooth muscles. Am J Physiol
Gastrointest Liver Physiol 2009;297:G107-G115.
Kasarskis EJ, Kuo CS, Berger R, Nelson KR. Carbamazepine-induced cardiac dysfunction.
Characterization of two distinct clinical syndromes. Arch Intern Med 1992;152:186-91.
Kaul S, Meena AK, Murthy JM. Carbamazepine induced bradycardia. Neurol India
2000;48:403-4.
Kharkovets T, Dedek K, Maier H et al. Mice with altered KCNQ4 K+ channels implicate
sensory outer hair cells in human progressive deafness. EMBO J 2006;25:642-52.
Kubisch C, Schroeder BC, Friedrich T et al. KCNQ4, a novel potassium channel expressed in
sensory outer hair cells, is mutated in dominant deafness. Cell 1999;96:437-46.
Kunzelmann K, Bleich M, Warth R, Levy-Holzman R, Garty H, Schreiber R. Expression and
function of colonic epithelial KvLQT1 K+ channels. Clin Exp Pharmacol Physiol
2001a;28:79-83.
Kunzelmann K, Hubner M, Schreiber R et al. Cloning and function of the rat colonic
epithelial K+ channel KVLQT1. J Membr Biol 2001b;179:155-64.
Lenzi A, Lazzerini F, Grossi E, Massimetti G, Placidi GF. Use of carbamazepine in acute
psychosis: a controlled study. J Int Med Res 1986;14:78-84.
Lerche C, Scherer CR, Seebohm G et al. Molecular cloning and functional expression of
KCNQ5, a potassium channel subunit that may contribute to neuronal M-current diversity. J
Biol Chem 2000;275:22395-400.
Lesage F, Attali B, Lazdunski M, Barhanin J. Developmental expression of voltage-sensitive
K+ channels in mouse skeletal muscle and C2C12 cells. FEBS Lett 1992;310:162-66.
Li Y, Gamper N, Hilgemann DW, Shapiro MS. Regulation of Kv7 (KCNQ) K+ channel open
probability by phosphatidylinositol 4,5-bisphosphate. J Neurosci 2005;25:9825-35.
Lorenz C, Pusch M, Jentsch TJ. Heteromultimeric CLC chloride channels with novel
properties. Proc Natl Acad Sci U S A 1996;93:13362-66.
Lotan I, Dascal N, Cohen S, Lass Y. Adenosine-induced slow ionic currents in the Xenopus
oocyte. Nature 1982;298:572-74.
Lundquist AL, Turner CL, Ballester LY, George AL, Jr. Expression and transcriptional
control of human KCNE genes. Genomics 2006;87:119-28.
Mackie AR, Byron KL. Cardiovascular KCNQ (Kv7) potassium channels: physiological
regulators and new targets for therapeutic intervention. Mol Pharmacol 2008;74:1171-79.
Maljevic S, Wuttke TV, Lerche H. Nervous system KV7 disorders: breakdown of a
subthreshold brake. J Physiol 2008;586:1791-801.
Mann L, Heldman E, Bersudsky Y et al. Inhibition of specific adenylyl cyclase isoforms by
lithium and carbamazepine, but not valproate, may be related to their antidepressant effect.
Bipolar Disord 2009;11:885-96.
Marrion NV. Control of M-current. Annu Rev Physiol 1997a;59:483-504.
Marrion NV. Control of M-current. Annu Rev Physiol 1997b;59:483-504.
McLean MJ, Macdonald RL. Carbamazepine and 10,11-epoxycarbamazepine produce use-
and voltage-dependent limitation of rapidly firing action potentials of mouse central neurons
in cell culture. J Pharmacol Exp Ther 1986;238:727-38.
Melman YF, Krummerman A, McDonald TV. KCNE regulation of KvLQT1 channels:
structure-function correlates. Trends Cardiovasc Med 2002;12:182-87.
Melman YF, Um SY, Krumerman A, Kagan A, McDonald TV. KCNE1 binds to the KCNQ1
pore to regulate potassium channel activity. Neuron 2004;42:927-37.
Montezinho LP, Mork A, Duarte CB, Penschuck S, Geraldes CF, Castro MM. Effects of
mood stabilizers on the inhibition of adenylate cyclase via dopamine D(2)-like receptors.
Bipolar Disord 2007;9:290-297.
Möller, Laux und Kapfhammer. Psychiatrie und Psychotherapie. 2 Auflage (2005),Springer
Verlag. 3-540-25074-3
Moric E, Herbert E, Trusz-Gluza M, Filipecki A, Mazurek U, Wilczok T. The implications of
genetic mutations in the sodium channel gene (SCN5A). Europace 2003;5:325-34.
Morselli PL, Baruzzi A, Gerna M, Bossi L, Porta M. Carbamazepine and carbamazepine-10,
11-epoxide concentrations in human brain. Br J Clin Pharmacol 1977;4:535-40.
Neyroud N, Tesson F, Denjoy I et al. A novel mutation in the potassium channel gene
KVLQT1 causes the Jervell and Lange-Nielsen cardioauditory syndrome. Nat Genet
1997;15:186-89.
Padilla K, Wickenden AD, Gerlach AC, McCormack K. The KCNQ2/3 selective channel
opener ICA-27243 binds to a novel voltage-sensor domain site. Neurosci Lett 2009;465:138-
42.
Panaghie G, Abbott GW. The role of S4 charges in voltage-dependent and voltage-
independent KCNQ1 potassium channel complexes. J Gen Physiol 2007;129:121-33.
Placidi GF, Lenzi A, Lazzerini F, Cassano GB, Akiskal HS. The comparative efficacy and
safety of carbamazepine versus lithium: a randomized, double-blind 3-year trial in 83 patients.
J Clin Psychiatry 1986;47:490-494.
Poeck K. [Heinz Ganshirt --forerunner of research on cerebrovascular diseases in Germany].
Fortschr Neurol Psychiatr 2001;69 Suppl 1:S45-S47.
Rivas A, Francis HW. Inner ear abnormalities in a Kcnq1 (Kvlqt1) knockout mouse: a model
of Jervell and Lange-Nielsen syndrome. Otol Neurotol 2005;26:415-24.
Robbins J. KCNQ potassium channels: physiology, pathophysiology, and pharmacology.
Pharmacol Ther 2001;90:1-19.
Rogawski MA. KCNQ2/KCNQ3 K+ channels and the molecular pathogenesis of epilepsy:
implications for therapy. Trends Neurosci 2000;23:393-98.
Roura-Ferrer M, Etxebarria A, Sole L et al. Functional implications of KCNE subunit
expression for the Kv7.5 (KCNQ5) channel. Cell Physiol Biochem 2009;24:325-34.
Sanguinetti MC, Curran ME, Zou A et al. Coassembly of K(V)LQT1 and minK (IsK)
proteins to form cardiac I(Ks) potassium channel. Nature 1996;384:80-83.
Schenzer A, Friedrich T, Pusch M et al. Molecular determinants of KCNQ (Kv7) K+ channel
sensitivity to the anticonvulsant retigabine. J Neurosci 2005;25:5051-60.
Schirrmacher K, Mayer A, Walden J, Dusing R, Bingmann D. Effects of carbamazepine on
action potentials and calcium currents in rat spinal ganglion cells in vitro.
Neuropsychobiology 1993;27:176-79.
Schmidt S, Schmitz-Buhl M. Signs and symptoms of carbamazepine overdose. J Neurol
1995;242:169-73.
Schoeman JF, Elyas AA, Brett EM, Lascelles PT. Correlation between plasma
carbamazepine-10,11-epoxide concentration and drug side-effects in children with epilepsy.
Dev Med Child Neurol 1984;26:756-64.
Schroeder BC, Hechenberger M, Weinreich F, Kubisch C, Jentsch TJ. KCNQ5, a novel
potassium channel broadly expressed in brain, mediates M-type currents. J Biol Chem
2000a;275:24089-95.
Schroeder BC, Kubisch C, Stein V, Jentsch TJ. Moderate loss of function of cyclic-AMP-
modulated KCNQ2/KCNQ3 K+ channels causes epilepsy. Nature 1998;396:687-90.
Schroeder BC, Waldegger S, Fehr S et al. A constitutively open potassium channel formed
by KCNQ1 and KCNE3. Nature 2000b;403:196-99.
Schwake M, Jentsch TJ, Friedrich T. A carboxy-terminal domain determines the subunit
specificity of KCNQ K+ channel assembly. EMBO Rep 2003;4:76-81.
Schwake M, Pusch M, Kharkovets T, Jentsch TJ. Surface expression and single channel
properties of KCNQ2/KCNQ3, M-type K+ channels involved in epilepsy. J Biol Chem
2000;275:13343-48.
Schwake M, Hermey G. Der Experimentator Neurowissenschaften. (2010), Spektrum
Selyanko AA, Hadley JK, Wood IC, Abogadie FC, Jentsch TJ, Brown DA. Inhibition of
KCNQ1-4 potassium channels expressed in mammalian cells via M1 muscarinic
acetylcholine receptors. J Physiol 2000;522 Pt 3:349-55.
Shapiro MS, Roche JP, Kaftan EJ, Cruzblanca H, Mackie K, Hille B. Reconstitution of
muscarinic modulation of the KCNQ2/KCNQ3 K(+) channels that underlie the neuronal M
current. J Neurosci 2000;20:1710-1721.
Sievers B, www.physiologie.uni- kiel.de/dissertationen(2008)
Singh NA, Charlier C, Stauffer D et al. A novel potassium channel gene, KCNQ2, is mutated
in an inherited epilepsy of newborns. Nat Genet 1998;18:25-29.
Steiner C, Wit AL, Weiss MB, Damato AN. The antiarrhythmic actions of carbamazepine
(Tegretol). J Pharmacol Exp Ther 1970;173:323-35.
Stuhmer W. Electrophysiological recording from Xenopus oocytes. Methods Enzymol
1992;207:319-39.
Suh BC, Hille B. Recovery from muscarinic modulation of M current channels requires
phosphatidylinositol 4,5-bisphosphate synthesis. Neuron 2002;35:507-20.
Sumikawa K, Parker I, Miledi R. Messenger RNA from rat brain induces noradrenaline and
dopamine receptors in Xenopus oocytes. Proc R Soc Lond B Biol Sci 1984;223:255-60.
Takumi T, Ohkubo H, Nakanishi S. Cloning of a membrane protein that induces a slow
voltage-gated potassium current. Science 1988;242:1042-45.
Tapper AR, George AL, Jr. Location and orientation of minK within the I(Ks) potassium
channel complex. J Biol Chem 2001;276:38249-54.
Tatulian L, Brown DA. Effect of the KCNQ potassium channel opener retigabine on single
KCNQ2/3 channels expressed in CHO cells. J Physiol 2003;549:57-63.
Tatulian L, Delmas P, Abogadie FC, Brown DA. Activation of expressed KCNQ potassium
currents and native neuronal M-type potassium currents by the anti-convulsant drug
retigabine. J Neurosci 2001;21:5535-45.
Taylor JC, Brauer S, Espir ML. Long-term treatment of trigeminal neuralgia with
carbamazepine. Postgrad Med J 1981;57:16-18.
Walden J, Grunze H, Mayer A et al. Calcium-antagonistic effects of carbamazepine in
epilepsies and affective psychoses. Neuropsychobiology 1993;27:171-75.
Wang HS, Pan Z, Shi W et al. KCNQ2 and KCNQ3 potassium channel subunits: molecular
correlates of the M-channel. Science 1998;282:1890-1893.
Wang Q, Curran ME, Splawski I et al. Positional cloning of a novel potassium channel gene:
KVLQT1 mutations cause cardiac arrhythmias. Nat Genet 1996;12:17-23.
Warth R, Barhanin J. The multifaceted phenotype of the knockout mouse for the KCNE1
potassium channel gene. Am J Physiol Regul Integr Comp Physiol 2002;282:R639-R648.
Warth R, Riedemann N, Bleich M, Van DW, Busch AE, Greger R. The cAMP-regulated and
293B-inhibited K+ conductance of rat colonic crypt base cells. Pflugers Arch 1996;432:81-
88.
Wickenden AD, Yu W, Zou A, Jegla T, Wagoner PK. Retigabine, a novel anti-convulsant,
enhances activation of KCNQ2/Q3 potassium channels. Mol Pharmacol 2000;58:591-600.
Wickenden AD, Zou A, Wagoner PK, Jegla T. Characterization of KCNQ5/Q3 potassium
channels expressed in mammalian cells. Br J Pharmacol 2001;132:381-84.
Wiemann M, Jones D, Straub H, Altrup U, Speckmann EJ. Simultaneous blockade of
intracellular calcium increases and of neuronal epileptiform depolarizations by verapamil.
Brain Res 1996;734:49-54.
Willow M, Gonoi T, Catterall WA. Voltage clamp analysis of the inhibitory actions of
diphenylhydantoin and carbamazepine on voltage-sensitive sodium channels in
neuroblastoma cells. Mol Pharmacol 1985;27:549-58.
Willow M, Kuenzel EA, Catterall WA. Inhibition of voltage-sensitive sodium channels in
neuroblastoma cells and synaptosomes by the anticonvulsant drugs diphenylhydantoin and
carbamazepine. Mol Pharmacol 1984;25:228-34.
Wollnik B, Schroeder BC, Kubisch C, Esperer HD, Wieacker P, Jentsch TJ.
Pathophysiological mechanisms of dominant and recessive KVLQT1 K+ channel mutations
found in inherited cardiac arrhythmias. Hum Mol Genet 1997;6:1943-49.
Woodward RM, Miledi R. Hormonal activation of ionic currents in follicle-enclosed
Xenopus oocytes. Proc Natl Acad Sci U S A 1987;84:4135-39.
Yang WP, Levesque PC, Little WA et al. Functional expression of two KvLQT1-related
potassium channels responsible for an inherited idiopathic epilepsy. J Biol Chem
1998;273:19419-23.
Yeung SY, Pucovsky V, Moffatt JD et al. Molecular expression and pharmacological
identification of a role for K(v)7 channels in murine vascular reactivity. Br J Pharmacol
2007;151:758-70.
Danksagung
An dieser Stelle möchste ich mich ganz herzlich bei Prof. Dr. Markus Bleich für die
Möglichkeit der Anfertigung dieser Doktorarbeit bedanken. Vielen Dank für das Vertrauen,
die Geduld und all die herausfordernden Aufgabestellungen, an den ich sowohl fachlich als
auch persönlich wachsen konnte.
Dr. Nina Himmerkus und Dr. Birte Sievers bin ich zu großem Dank verpflichtet, für die große
Hilfsbereitschaft, gute Ratschläge und die gute Arbeitsatmosphäre im Labor.
Mein Großer Dank geht auch an das biochemische Institut. Ganz besonders möchte ich Herrn
Dr. Michael Schwake für die Bereitstellung der Konstrukte, die Einführung in die
Oozytenexperimente und die geduldige Betreuung bedanken. Bei Katharina Stiebelings
möchte ich mich für die herzliche Betreuung und Hilfbereitschaft im Labor bedanken. Nicht
zu vergessen ist die gute Zusammenarbeit mit Dr. Christian Beimgraben, der mir mit Rat und
Tat zur Seite stand. Vielen Dank dafür!
Ohne meine Familie wäre das alles nicht möglich. Der größte Dank geht an meine Eltern, den
ich für mein Leben, für das ermöglichte Studium und den Glauben an mich danken möchte.
Mit Euch ist meine Grenze der Himmel!
Ein besonderer Dank geht auch an die besten Schwiegereltern der Welt!
Meiner zweiten Hälfte, meinem Mann, möchte ich meinen tiefsten Dank aussprechen. Ich
danke ihm für seine aufrichtige Liebe, seine Geduld, die ehrliche Kritik und seine Kraft mich
so zu nehmen wie ich bin.
Lebenslauf
Persönliche Daten
Name:
Olga Haferkamp, geb. Jagodin
Rita-Bardenheuer-Str.1, 28213 Bremen
Geburtsdatum u.-ort:
02.01.1982 in Kiew (Ukraine)
Staatsangehörigkeit:
Schulische Ausbildung
1989
Einschulung in ein musikalisches Internat in Kiew
Moabiter-Grundschule in Berlin
Musikalische Ausbildung (Jungstudentin) an der Carl-
Philipp-Emanuel-Bach-Oberschule in Berlin
Kippenberg-Gymnasium Bremen , Abitur
Beruflicher Werdegang
Sep 2002- März 2003
Zahntechnisches Praktikum bei Feldmann & Partner in
Zahnmedizinstudium an der Christian-Albrechts-
Universität zu Kiel
August 2005-2008
Studentisch-wissenschaftliche Mitarbeiterin und
Doktorandin am Physiologischen Institut bei Prof. Bleich
in Kiel (Abschluss des experimentellen Abschnitts)
Februar/März 2008
Praktikum bei Prof. Bremerich, Mund-Kiefer-
Gesichtschirurgie am Klinikum Bremen Mitte
Zahnärztliches Praktikum in der Praxis Dr. Stahlberg &
Staatsexamen Zahnmedizin (Gesamtnote: 1,7)
Januar 2009 bis heute
Weiterbildungsassistentin für Oralchirurgie in der Praxis
Dr. Menke und Partner Okt. 2009-Dez. 2010
Wiederaufnahme der Tätigkeit in der Praxis Dr.Menke
Weitere Auszeichnungen und Tätigkeiten
1989-2002
Solide musikalische Ausbildung (Klavierausbildung)
Mehrfache Preisträgerin bei Jugend Musiziert
Referententätigkeit im Rahmen eines Kolloquiums,
Physiologisches Institut CAU-Kiel
Wissenschaftlicher Vortrag und Posterpräsentation, Acta
Physiologica, The Federation of European Physiological
Societies, München
Abbott GW, Butler MH, Bendahhou S, Dalakas MC, Ptacek LJ, Goldstein SA. MiRP2 forms
potassium channels in skeletal muscle with Kv3.4 and is associated with periodic paralysis.
Cell 2001;104:217-31.
Albright PS, Bruni J. Effects of carbamazepine and its epoxide metabolite on amygdala-
kindled seizures in rats. Neurology 1984;34:1383-86.
Arhan E, Aycicek S, Akaln N, Guven A, Kose G. Cardiac effects of carbamazepine treatment
in childhood epilepsy. Neurologist 2009;15:268-73.
Ballenger JC, Post RM. Carbamazepine in manic-depressive illness: a new treatment. Am J
Psychiatry 1980;137:782-90.
Barrons R, Roberts N. The role of carbamazepine and oxcarbazepine in alcohol withdrawal
syndrome. J Clin Pharm Ther 2010;35:153-67.
Bertilsson L, Tomson T. Clinical pharmacokinetics and pharmacological effects of
carbamazepine and carbamazepine-10,11-epoxide. An update. Clin Pharmacokinet
Biervert C, Schroeder BC, Kubisch C et al. A potassium channel mutation in neonatal human
epilepsy. Science 1998;279:403-6.
Bleich M, Briel M, Busch AE et al. KVLQT channels are inhibited by the K+ channel blocker
293B. Pflugers Arch 1997;434:499-501.
Bleich M, Riedemann N, Warth R et al. Ca2+ regulated K+ and non-selective cation channels
in the basolateral membrane of rat colonic crypt base cells. Pflugers Arch 1996;432:1011-22.
Bourgeois BF, Wad N. Individual and combined antiepileptic and neurotoxic activity of
carbamazepine and carbamazepine-10,11-epoxide in mice. J Pharmacol Exp Ther
1984a;231:411-15.
Bourgeois BF, Wad N. Individual and combined antiepileptic and neurotoxic activity of
carbamazepine and carbamazepine-10,11-epoxide in mice. J Pharmacol Exp Ther
1984b;231:411-15.
Braunhofer J, Zicha L. [Does Tegretal offer new possibilities of therapy in several neurologic
and endocrine diseases? A clinical electroencephalographic and thin-layer chromatographic
study]. Med Welt 1966;1875-80.
Bridge TA, Norton RL, Robertson WO. Pediatric carbamazepine overdoses. Pediatr Emerg
Care 1994;10:260-263.
Brown DA, Adams PR. Muscarinic suppression of a novel voltage-sensitive K+ current in a
vertebrate neurone. Nature 1980;283:673-76.
Brueggemann LI, Moran CJ, Barakat JA, Yeh JZ, Cribbs LL, Byron KL. Vasopressin
stimulates action potential firing by protein kinase C-dependent inhibition of KCNQ5 in A7r5
rat aortic smooth muscle cells. Am J Physiol Heart Circ Physiol 2007;292:H1352-H1363.
Cascorbi I. Pharmacogenetics of cytochrome p4502D6: genetic background and clinical
implication. Eur J Clin Invest 2003;33 Suppl 2:17-22.
Charlier C, Singh NA, Ryan SG et al. A pore mutation in a novel KQT-like potassium
channel gene in an idiopathic epilepsy family. Nat Genet 1998;18:53-55.
Chen G, Pan B, Hawver DB, Wright CB, Potter WZ, Manji HK. Attenuation of cyclic AMP
production by carbamazepine. J Neurochem 1996;67:2079-86.
Chen J, Zheng R, Melman YF, McDonald TV. Functional interactions between KCNE1 C-
terminus and the KCNQ1 channel. PLoS One 2009;4:e5143.
Cooper EC, Aldape KD, Abosch A et al. Colocalization and coassembly of two human brain
M-type potassium channel subunits that are mutated in epilepsy. Proc Natl Acad Sci U S A
2000;97:4914-19.
Courtney KR, Etter EF. Modulated anticonvulsant block of sodium channels in nerve and
muscle. Eur J Pharmacol 1983;88:1-9.
Dascal N. The use of Xenopus oocytes for the study of ion channels. CRC Crit Rev Biochem
de la CM, Bance M. Carbamazepine-induced sensorineural hearing loss. Arch Otolaryngol
Head Neck Surg 1999;125:225-27.
Dedek K, Kunath B, Kananura C, Reuner U, Jentsch TJ, Steinlein OK. Myokymia and
neonatal epilepsy caused by a mutation in the voltage sensor of the KCNQ2 K+ channel. Proc
Natl Acad Sci U S A 2001a;98:12272-77.
Dedek K, Waldegger S. Colocalization of KCNQ1/KCNE channel subunits in the mouse
gastrointestinal tract. Pflugers Arch 2001b;442:896-902.
Delmas P, Brown DA. Pathways modulating neural KCNQ/M (Kv7) potassium channels. Nat
Rev Neurosci 2005;6:850-862.
Delpon E, Cordeiro JM, Nunez L et al. Functional effects of KCNE3 mutation and its role in
the development of Brugada syndrome. Circ Arrhythm Electrophysiol 2008;1:209-18.
Engel J, Jr., Troupin AS, Crandall PH, Sterman MB, Wasterlain CG. Recent developments in
the diagnosis and therapy of epilepsy. Ann Intern Med 1982;97:584-98.
gado-Escueta AV, Treiman DM, Walsh GO. The treatable epilepsies. N Engl J Med
1983;308:1508-14.
Goldin AL. Expression of ion channels by injection of mRNA into Xenopus oocytes. Methods
Cell Biol 1991;36:487-509.
Grahammer F, Herling AW, Lang HJ et al. The cardiac K+ channel KCNQ1 is essential for
gastric acid secretion. Gastroenterology 2001;120:1363-71.
Greger R, Bleich M, Riedemann N, Van DW, Ecke D, Warth R. The role of K+ channels in
colonic Cl- secretion. Comp Biochem Physiol A Physiol 1997a;118:271-75.
Greger R, Bleich M, Warth R. New types of K+ channels in the colon. Wien Klin Wochenschr
1997b;109:497-98.
Greger R, Mall M, Bleich M et al. Regulation of epithelial ion channels by the cystic fibrosis
transmembrane conductance regulator. J Mol Med 1996;74:527-34.
Gutman GA, Chandy KG, Grissmer S et al. International Union of Pharmacology. LIII.
Nomenclature and molecular relationships of voltage-gated potassium channels. Pharmacol
Rev 2005;57:473-508.
Halliwell JV, Adams PR. Voltage-clamp analysis of muscarinic excitation in hippocampal
neurons. Brain Res 1982;250:71-92.
Hansen HH, Waroux O, Seutin V, Jentsch TJ, Aznar S, Mikkelsen JD. Kv7 channels:
interaction with dopaminergic and serotonergic neurotransmission in the CNS. J Physiol
2008;586:1823-32.
Heitzmann D, Grahammer F, von HT et al. Heteromeric KCNE2/KCNQ1 potassium channels
in the luminal membrane of gastric parietal cells. J Physiol 2004;561:547-57.
Heitzmann D, Warth R. Physiology and pathophysiology of potassium channels in
gastrointestinal epithelia. Physiol Rev 2008;88:1119-82.
Helbig I, Mefford HC, Sharp AJ et al. 15q13.3 microdeletions increase risk of idiopathic
generalized epilepsy. Nat Genet 2009;41:160-162.
Hubner CA, Jentsch TJ. Ion channel diseases. Hum Mol Genet 2002;11:2435-45.
Jensen HS, Callo K, Jespersen T, Jensen BS, Olesen SP. The KCNQ5 potassium channel
from mouse: a broadly expressed M-current like potassium channel modulated by zinc, pH,
and volume changes. Brain Res Mol Brain Res 2005;139:52-62.
Jensen HS, Grunnet M, Olesen SP. Inactivation as a new regulatory mechanism for neuronal
Kv7 channels. Biophys J 2007;92:2747-56.
Jentsch TJ. Neuronal KCNQ potassium channels: physiology and role in disease. Nat Rev
Neurosci 2000;1:21-30.
Jentsch TJ, Schroeder BC, Kubisch C, Friedrich T, Stein V. Pathophysiology of KCNQ
channels: neonatal epilepsy and progressive deafness. Epilepsia 2000;41:1068-69.
Jepps TA, Greenwood IA, Moffatt JD, Sanders KM, Ohya S. Molecular and functional
characterization of Kv7 K+ channel in murine gastrointestinal smooth muscles. Am J Physiol
Gastrointest Liver Physiol 2009;297:G107-G115.
Kasarskis EJ, Kuo CS, Berger R, Nelson KR. Carbamazepine-induced cardiac dysfunction.
Characterization of two distinct clinical syndromes. Arch Intern Med 1992;152:186-91.
Kaul S, Meena AK, Murthy JM. Carbamazepine induced bradycardia. Neurol India
Kharkovets T, Dedek K, Maier H et al. Mice with altered KCNQ4 K+ channels implicate
sensory outer hair cells in human progressive deafness. EMBO J 2006;25:642-52.
Kubisch C, Schroeder BC, Friedrich T et al. KCNQ4, a novel potassium channel expressed in
sensory outer hair cells, is mutated in dominant deafness. Cell 1999;96:437-46.
Kunzelmann K, Bleich M, Warth R, Levy-Holzman R, Garty H, Schreiber R. Expression and
function of colonic epithelial KvLQT1 K+ channels. Clin Exp Pharmacol Physiol
Kunzelmann K, Hubner M, Schreiber R et al. Cloning and function of the rat colonic
epithelial K+ channel KVLQT1. J Membr Biol 2001b;179:155-64.
Lenzi A, Lazzerini F, Grossi E, Massimetti G, Placidi GF. Use of carbamazepine in acute
psychosis: a controlled study. J Int Med Res 1986;14:78-84.
Lerche C, Scherer CR, Seebohm G et al. Molecular cloning and functional expression of
KCNQ5, a potassium channel subunit that may contribute to neuronal M-current diversity. J
Biol Chem 2000;275:22395-400.
Lesage F, Attali B, Lazdunski M, Barhanin J. Developmental expression of voltage-sensitive
K+ channels in mouse skeletal muscle and C2C12 cells. FEBS Lett 1992;310:162-66.
Li Y, Gamper N, Hilgemann DW, Shapiro MS. Regulation of Kv7 (KCNQ) K+ channel open
probability by phosphatidylinositol 4,5-bisphosphate. J Neurosci 2005;25:9825-35.
Lorenz C, Pusch M, Jentsch TJ. Heteromultimeric CLC chloride channels with novel
properties. Proc Natl Acad Sci U S A 1996;93:13362-66.
Lotan I, Dascal N, Cohen S, Lass Y. Adenosine-induced slow ionic currents in the Xenopus
oocyte. Nature 1982;298:572-74.
Lundquist AL, Turner CL, Ballester LY, George AL, Jr. Expression and transcriptional
control of human KCNE genes. Genomics 2006;87:119-28.
Mackie AR, Byron KL. Cardiovascular KCNQ (Kv7) potassium channels: physiological
regulators and new targets for therapeutic intervention. Mol Pharmacol 2008;74:1171-79.
Maljevic S, Wuttke TV, Lerche H. Nervous system KV7 disorders: breakdown of a
subthreshold brake. J Physiol 2008;586:1791-801.
Mann L, Heldman E, Bersudsky Y et al. Inhibition of specific adenylyl cyclase isoforms by
lithium and carbamazepine, but not valproate, may be related to their antidepressant effect.
Bipolar Disord 2009;11:885-96.
Marrion NV. Control of M-current. Annu Rev Physiol 1997a;59:483-504.
Marrion NV. Control of M-current. Annu Rev Physiol 1997b;59:483-504.
McLean MJ, Macdonald RL. Carbamazepine and 10,11-epoxycarbamazepine produce use-
and voltage-dependent limitation of rapidly firing action potentials of mouse central neurons
in cell culture. J Pharmacol Exp Ther 1986;238:727-38.
Melman YF, Krummerman A, McDonald TV. KCNE regulation of KvLQT1 channels:
structure-function correlates. Trends Cardiovasc Med 2002;12:182-87.
Melman YF, Um SY, Krumerman A, Kagan A, McDonald TV. KCNE1 binds to the KCNQ1
pore to regulate potassium channel activity. Neuron 2004;42:927-37.
Montezinho LP, Mork A, Duarte CB, Penschuck S, Geraldes CF, Castro MM. Effects of
mood stabilizers on the inhibition of adenylate cyclase via dopamine D(2)-like receptors.
Bipolar Disord 2007;9:290-297.
Moric E, Herbert E, Trusz-Gluza M, Filipecki A, Mazurek U, Wilczok T. The implications of
genetic mutations in the sodium channel gene (SCN5A). Europace 2003;5:325-34.
Morselli PL, Baruzzi A, Gerna M, Bossi L, Porta M. Carbamazepine and carbamazepine-10,
11-epoxide concentrations in human brain. Br J Clin Pharmacol 1977;4:535-40.
Neyroud N, Tesson F, Denjoy I et al. A novel mutation in the potassium channel gene
KVLQT1 causes the Jervell and Lange-Nielsen cardioauditory syndrome. Nat Genet
Padilla K, Wickenden AD, Gerlach AC, McCormack K. The KCNQ2/3 selective channel
opener ICA-27243 binds to a novel voltage-sensor domain site. Neurosci Lett 2009;465:138-
Panaghie G, Abbott GW. The role of S4 charges in voltage-dependent and voltage-
independent KCNQ1 potassium channel complexes. J Gen Physiol 2007;129:121-33.
Placidi GF, Lenzi A, Lazzerini F, Cassano GB, Akiskal HS. The comparative efficacy and
safety of carbamazepine versus lithium: a randomized, double-blind 3-year trial in 83 patients.
J Clin Psychiatry 1986;47:490-494.
Poeck K. [Heinz Ganshirt --forerunner of research on cerebrovascular diseases in Germany].
Fortschr Neurol Psychiatr 2001;69 Suppl 1:S45-S47.
Rivas A, Francis HW. Inner ear abnormalities in a Kcnq1 (Kvlqt1) knockout mouse: a model
of Jervell and Lange-Nielsen syndrome. Otol Neurotol 2005;26:415-24.
Robbins J. KCNQ potassium channels: physiology, pathophysiology, and pharmacology.
Pharmacol Ther 2001;90:1-19.
Rogawski MA. KCNQ2/KCNQ3 K+ channels and the molecular pathogenesis of epilepsy:
implications for therapy. Trends Neurosci 2000;23:393-98.
Roura-Ferrer M, Etxebarria A, Sole L et al. Functional implications of KCNE subunit
expression for the Kv7.5 (KCNQ5) channel. Cell Physiol Biochem 2009;24:325-34.
Schenzer A, Friedrich T, Pusch M et al. Molecular determinants of KCNQ (Kv7) K+ channel
sensitivity to the anticonvulsant retigabine. J Neurosci 2005;25:5051-60.
Schirrmacher K, Mayer A, Walden J, Dusing R, Bingmann D. Effects of carbamazepine on
action potentials and calcium currents in rat spinal ganglion cells in vitro.
Neuropsychobiology 1993;27:176-79.
Schmidt S, Schmitz-Buhl M. Signs and symptoms of carbamazepine overdose. J Neurol
1995;242:169-73.
Schoeman JF, Elyas AA, Brett EM, Lascelles PT. Correlation between plasma
carbamazepine-10,11-epoxide concentration and drug side-effects in children with epilepsy.
Dev Med Child Neurol 1984;26:756-64.
Schroeder BC, Hechenberger M, Weinreich F, Kubisch C, Jentsch TJ. KCNQ5, a novel
potassium channel broadly expressed in brain, mediates M-type currents. J Biol Chem
2000a;275:24089-95.
Schroeder BC, Kubisch C, Stein V, Jentsch TJ. Moderate loss of function of cyclic-AMP-
modulated KCNQ2/KCNQ3 K+ channels causes epilepsy. Nature 1998;396:687-90.
Schroeder BC, Waldegger S, Fehr S et al. A constitutively open potassium channel formed by
KCNQ1 and KCNE3. Nature 2000b;403:196-99.
Schwake M, Jentsch TJ, Friedrich T. A carboxy-terminal domain determines the subunit
specificity of KCNQ K+ channel assembly. EMBO Rep 2003;4:76-81.
Schwake M, Pusch M, Kharkovets T, Jentsch TJ. Surface expression and single channel
properties of KCNQ2/KCNQ3, M-type K+ channels involved in epilepsy. J Biol Chem
2000;275:13343-48.
Selyanko AA, Hadley JK, Wood IC, Abogadie FC, Jentsch TJ, Brown DA. Inhibition of
KCNQ1-4 potassium channels expressed in mammalian cells via M1 muscarinic
acetylcholine receptors. J Physiol 2000;522 Pt 3:349-55.
Shapiro MS, Roche JP, Kaftan EJ, Cruzblanca H, Mackie K, Hille B. Reconstitution of
muscarinic modulation of the KCNQ2/KCNQ3 K(+) channels that underlie the neuronal M
current. J Neurosci 2000;20:1710-1721.
Singh NA, Charlier C, Stauffer D et al. A novel potassium channel gene, KCNQ2, is mutated
in an inherited epilepsy of newborns. Nat Genet 1998;18:25-29.
Steiner C, Wit AL, Weiss MB, Damato AN. The antiarrhythmic actions of carbamazepine
(Tegretol). J Pharmacol Exp Ther 1970;173:323-35.
Stuhmer W. Electrophysiological recording from Xenopus oocytes. Methods Enzymol
1992;207:319-39.
Suh BC, Hille B. Recovery from muscarinic modulation of M current channels requires
phosphatidylinositol 4,5-bisphosphate synthesis. Neuron 2002;35:507-20.
Sumikawa K, Parker I, Miledi R. Messenger RNA from rat brain induces noradrenaline and
dopamine receptors in Xenopus oocytes. Proc R Soc Lond B Biol Sci 1984;223:255-60.
Takumi T, Ohkubo H, Nakanishi S. Cloning of a membrane protein that induces a slow
voltage-gated potassium current. Science 1988;242:1042-45.
Tapper AR, George AL, Jr. Location and orientation of minK within the I(Ks) potassium
channel complex. J Biol Chem 2001;276:38249-54.
Tatulian L, Brown DA. Effect of the KCNQ potassium channel opener retigabine on single
KCNQ2/3 channels expressed in CHO cells. J Physiol 2003;549:57-63.
Tatulian L, Delmas P, Abogadie FC, Brown DA. Activation of expressed KCNQ potassium
currents and native neuronal M-type potassium currents by the anti-convulsant drug
retigabine. J Neurosci 2001;21:5535-45.
Taylor JC, Brauer S, Espir ML. Long-term treatment of trigeminal neuralgia with
carbamazepine. Postgrad Med J 1981;57:16-18.
Walden J, Grunze H, Mayer A et al. Calcium-antagonistic effects of carbamazepine in
epilepsies and affective psychoses. Neuropsychobiology 1993;27:171-75.
Wang HS, Pan Z, Shi W et al. KCNQ2 and KCNQ3 potassium channel subunits: molecular
correlates of the M-channel. Science 1998;282:1890-1893.
Wang Q, Curran ME, Splawski I et al. Positional cloning of a novel potassium channel gene:
KVLQT1 mutations cause cardiac arrhythmias. Nat Genet 1996;12:17-23.
Warth R, Barhanin J. The multifaceted phenotype of the knockout mouse for the KCNE1
potassium channel gene. Am J Physiol Regul Integr Comp Physiol 2002;282:R639-R648.
Warth R, Riedemann N, Bleich M, Van DW, Busch AE, Greger R. The cAMP-regulated and
293B-inhibited K+ conductance of rat colonic crypt base cells. Pflugers Arch 1996;432:81-
Wickenden AD, Yu W, Zou A, Jegla T, Wagoner PK. Retigabine, a novel anti-convulsant,
enhances activation of KCNQ2/Q3 potassium channels. Mol Pharmacol 2000;58:591-600.
Wickenden AD, Zou A, Wagoner PK, Jegla T. Characterization of KCNQ5/Q3 potassium
channels expressed in mammalian cells. Br J Pharmacol 2001;132:381-84.
Wiemann M, Jones D, Straub H, Altrup U, Speckmann EJ. Simultaneous blockade of
intracellular calcium increases and of neuronal epileptiform depolarizations by verapamil.
Brain Res 1996;734:49-54.
Willow M, Gonoi T, Catterall WA. Voltage clamp analysis of the inhibitory actions of
diphenylhydantoin and carbamazepine on voltage-sensitive sodium channels in
neuroblastoma cells. Mol Pharmacol 1985;27:549-58.
Willow M, Kuenzel EA, Catterall WA. Inhibition of voltage-sensitive sodium channels in
neuroblastoma cells and synaptosomes by the anticonvulsant drugs diphenylhydantoin and
carbamazepine. Mol Pharmacol 1984;25:228-34.
Wollnik B, Schroeder BC, Kubisch C, Esperer HD, Wieacker P, Jentsch TJ.
Pathophysiological mechanisms of dominant and recessive KVLQT1 K+ channel mutations
found in inherited cardiac arrhythmias. Hum Mol Genet 1997;6:1943-49.
Woodward RM, Miledi R. Hormonal activation of ionic currents in follicle-enclosed Xenopus
oocytes. Proc Natl Acad Sci U S A 1987;84:4135-39.
Yang WP, Levesque PC, Little WA et al. Functional expression of two KvLQT1-related
potassium channels responsible for an inherited idiopathic epilepsy. J Biol Chem
1998;273:19419-23.
Yeung SY, Pucovsky V, Moffatt JD et al. Molecular expression and pharmacological
identification of a role for K(v)7 channels in murine vascular reactivity. Br J Pharmacol
2007;151:758-70.
Source: http://www.physiologie.uni-kiel.de/en/research/physiology-of-membrane-transport/haferkamp-thesis.pdf
ORIGINAL INVESTIGATION Pregnancy Outcome Following GestationalExposure to Echinacea A Prospective Controlled Study Michael Gallo, BSc; Maumita Sarkar, BSc; Waisze Au, BSc; Kimberlee Pietrzak, MD; Beatriz Comas, MD;Michael Smith, MD; Thomas V. Jaeger, PhD; Adrienne Einarson, RN; Gideon Koren, MD Background: Echinacea products are among the most
MEDICAL COMMISSION OF THE INTERNATIONAL BOXING ASSOCIATION (AIBA) SEVENTH EDITION 2009 Electronic adaptation Editor's Note _ 3 Foreword 4 The Medical Commission and the Medical Jury 6 Disqualifying Conditions _ 7 Medical Examinations _ 8 Medical Responsibilities of the Ringside Physician _ 10


