Alteraciones en la biodistribución de los radiofármacos causadas por interacciones medicamentosas
04 de mayo de 2012
Alteraciones en la biodistribución de los radiofármacoscausadas por interacciones medicamentosas
Ana Agudo Martínez1, Jesús Luis Gómez Perales 2, Juan Luis Tirado 3.
1 - Servicio de Medicina Nuclear, Hos pital Univers itario Virgen Macarena (Sevilla, Es paña).
2 - Servicio de Medicina Nuclear, Hos pital Puerta del Mar (Cádiz, Es paña).
3 - Servicio de Medicina Nuclear, Univers itario Virgen del Rocío (Sevilla, Es paña).
Resumen / Abstract
Los fármacos pueden interferir en las pruebas de Medicina Nuclear por numerosos mecanismos. En algunas ocasiones alterandirectamente la identidad química del radiofármaco, mientras que en otras afectan al estado fisiológico del órgano diana. Encualquier caso es importante conocer el efecto que la medicación del paciente tiene sobre la biodistribución del radiofármaco,así cómo el mecanismo por el cual interaccionan para identificar la posible causa de una captación atípica, que en algunasocasiones incluso puede conducir a un resultado falso. El objetivo de este trabajo fue reunir las interacciones medicamentosascon radiofármacos documentadas en la literatura en una guía que sirva como instrumento de consulta útil y de fácil manejopara la práctica clínica diaria del especialista en Medicina Nuclear. La guía se ha estructurado en apartados según la pruebaafectada y el radiofármaco empleado. Cada apartado incluye una tabla con los fármacos causantes de la interacción, el efectosobre dicha prueba y el mecanismo de interacción, en caso de que sea conocido.
Drugs can interfere with nuclear medicine tests in several ways. Sometimes, they directly alter the chemical identity of theradiopharmaceuticals, while others they affect the physiological state of the target organ. In any case, it is important to know theeffect that the patient's medication has on the biodistribution of radiopharmaceuticals, as wel as the mechanism by which thedrug and the radiopharmaceutical interact, in order to identify the possible cause of an atypical uptake, which sometimes mayeven cause a misdiagnosis. The aim of this work was to formulate a list of those drug interactions with radiopharmaceuticals thatare documented in the literature, in order to develop a guide. This guide could serve as a reference tool, easy to use and usefulfor the daily clinical practice of the nuclear medicine specialist. The guide is divided into sections according to the test and theradiopharmaceutical used. Each section includes a table of drugs causing the interaction, the effect on the test and themechanism of interaction - when known.
En el desarrol o de cualquier técnica de Medicina Nuclear, tanto diagnóstica como terapéutica, además del conocimiento de losmecanismos de acción de los radiofármacos empleados, es necesario tener presente las posibles interaccionesmedicamentosas que puedan dar lugar a alteraciones en la biodistribución. Normalmente, estas interferencias provocan unaumento o una disminución de la captación del radiofármaco por parte del órgano o tejido diana, pudiendo incluso dar lugar afalsos positivos o negativos. En cualquier caso, el desconocimiento por parte del especialista en Medicina Nuclear, de los efectosde la medicación del paciente sobre la biodistribución del radiofármaco, podría conducir a un diagnóstico erróneo.
Según el Real Decreto 1345/2007, por el que se regula en España el procedimiento de autorización, registro y condiciones dedispensación de los medicamentos de uso humano fabricados industrialmente, los radiofármacos deben someterse a unprocedimiento de evaluación y registro por parte de la Agencia Española de Medicamentos y Productos Sanitarios y se autorizanpara las condiciones de uso especificadas en el resumen de las Características del Producto o Ficha Técnica, donde debendocumentarse las interacciones con otros medicamentos.
Si el radiofármaco es de uso terapéutico, en general las posibles interacciones medicamentosas se encuentran más
ampliamente estudiadas, ya que en estos casos la alteración de la distribución in vivo del radiotrazador supone la irradiación nodeseada con emisores beta de alta energía. Un ejemplo conocido es el empleo de 131I-yoduro sódico para el tratamiento decáncer de tiroides o de hipertiroidismo, en el que está bien establecido los fármacos que el paciente debe suprimir e incluso elperiodo de tiempo en el que debe hacerlo, antes del tratamiento con el radioisótopo.
Los fármacos pueden interferir en los procedimientos diagnósticos o terapéuticos por numerosos mecanismos. En algunasocasiones, alteran directamente la identidad química del radiofármaco, mientras que en otras afectan al estado fisiológico delórgano diana. Aunque el efecto toxicológico causado por el fármaco no es una interacción propiamente dicha, es importanteconocerlo para identificar la posible causa de una captación atípica. Si se conocen las interacciones medicamentosas conradiofármacos y las mismas se encuentran convenientemente categorizadas(1) , es posible distinguir si la biodistribuciónanormal de un trazador se debe a una alteración del órgano diana causada por la medicación, a una interacción in vivo genuinaentre el radiofármaco y el fármaco, a un daño inducido por la medicación del paciente o simplemente a una interacción entre elradiofármaco y los catéteres o jeringas empleados en la inyección.
Existen muchas clasificaciones propuestas para estas interacciones; una de las más extendidas las agrupa en cuatrocategorías: farmacológicas, toxicológicas, farmacocinéticas y físico-químicas. Aunque estas categorías no están claramentedefinidas y además una misma interacción puede estar determinada por más de un mecanismo, se pueden describir de lasiguiente manera(2) :
01.
Interferencias farmacológicas. El efecto farmacológico es tan acusado que interfiere en la vía de
transporte del radiofármaco hacia el órgano diana. Es, por ejemplo, el caso de los analgésicos narcóticos enun estudio de vías biliares, que provocan un patrón semejante a una obstrucción del conducto biliar por unretraso en el tránsito del radiofármaco desde la vía biliar al intestino.
02.
Interferencias toxicológicas. El fármaco ejerce un efecto tóxico en el órgano de interés, de forma que
modifica la captación del radiotrazador. Uno de cada 10 pacientes en tratamiento farmacológico presentatoxicidad provocada por algún fármaco; un ejemplo de este tipo de interferencia es la nefrotoxicidadcausada por algunos antibióticos que provoca un aumento inusual de la captación por parte de los riñones.
Algunas de estas interferencias se han utilizado para determinar la nefrotoxicidad de algunos fármacoscomo la ciclosporina-A en estudios realizados en animales, que demuestran la alteración en la biodistribucióndel 99m Tc-mercaptoacetiltriglicina o MAG-3 (3) .
03.
Interferencias farmacocinéticas. El mecanismo específico del fármaco interfiere en la captación y la
excreción del radiotrazador. Por ejemplo, la captación de galio-67 observado en las mamas de pacientes entratamiento con fármacos que inducen la síntesis de prolactina, tales como la metoclopramida yclorpromacina.
04.
Interferencias físico-químicas. e produce una interacción directa entre el trazador y el fármaco,
creándose uno o más focos de actividad inesperados. A este grupo pertenece una de las interacciones demayor incidencia: la quelación por sales de hierro (en tratamientos de larga duración) con radiofármacostecneciados. Estos complejos son retirados por las células de Kupffer del hígado, visualizándose este órganoen la imagen.
Por la importancia del tema y su utilidad como herramienta de trabajo, es necesaria la difusión y el seguimiento de lasinteracciones detectadas en los distintos servicios de Medicina Nuclear. Para el o se requiere una estrecha colaboración entre elmédico nuclear, que detecta una imagen anómala o inesperada, y el radiofarmacéutico, que investiga las posibles causas.
Como no es posible que todas las interferencias se encuentren documentadas en la ficha técnica del producto, deberíaadquirirse la práctica de comunicarlas al laboratorio productor del radiofármaco y al Comité de Radiofarmacéuticos de laSociedad Europea de Medicina Nuclear, para la elaboración de una base de datos sobre potenciales interferencias y su difusiónen el informe anual que se publica en el European Journal of Nuclear Medicine and Molecular Imaging.
El objetivo de este trabajo es reunir las interacciones medicamentosas con radiofármacos documentadas en la literatura en unaguía, que sirva como instrumento de consulta útil y de fácil manejo para la práctica clínica diaria del especialista en MedicinaNuclear. La guía se ha estructurado en apartados según la prueba afectada y el radiofármaco empleado. Cada apartado incluyeuna tabla con los fármacos causantes de la interacción, el efecto sobre dicha prueba y el mecanismo de interacción, en caso deque el mismo sea conocido.
99m Tc-difosfonatos: gammagrafía ósea
Los difosfonatos marcados con 99mTc se acumulan en zonas osteogénicas activas permitiendo visualizar áreas o focos conosteogénesis alterada. Las interacciones más importantes descritas con estos trazadores son las causadas por fármacos deestructura similar, como son el etidronato y el pamidronato. Estos fármacos se utilizan para el tratamiento de la enfermedad dePaget, de la hipercalcemia tumoral y de la osteoporosis. Tanto el fármaco como el radiofármaco tienen el mismo mecanismo deacción, uniéndose estrechamente a la matriz ósea mediante un proceso de quimioadsorción a la superficie de los cristales dehidroxiapatita, lo que provoca una competencia directa por los sitios de unión al hueso debido a la similitud en su estructura.
Este tipo de fármacos disminuye de forma drástica el metabolismo óseo con menor afectación en zonas metastásicas, aunquepuede suceder que usando terapias de bajas dosis y larga duración esté disminuida la captación del radiofármaco en lasmetástasis, dando lugar a algún falso negativo(4) . La administración de etidronato es una contraindicación para la realización dela gammagrafía ósea, ya que disminuye la sensibilidad para la detección de la enfermedad; es necesario suspender eltratamiento entre 2 y 4 semanas antes de la realización de la prueba(5) . Otro difosfonato utilizado en el tratamiento de estasenfermedades es el clodronato, aunque existen evidencias de que no disminuye la sensibilidad de la imagen gamagráfica óseapara la detección de metástasis(6) . En la Tabla 1 se presentan los fármacos que interfieren con la captación de 99mTc-difosfonatos, con su efecto sobre la imagen y el mecanismo de acción.
Tabla 1. Fármacos que interfieren con la captación de difosfonatos.
Efecto sobre la imagen
Mecanismo de interacción
Formación de complejos de hierro y 99mTc que s on
Hierro coloidal i/v.
Captación difus a en hígado.
retirados por las células de Kupffer. (7,8)
Probablemente por dis ociación de 99mTc del ligante
Es pecialidades que contienen
Dis minución de la captación ós ea, aumento de
debido a la acción de iones metálicos : (hierro II). Se
hierro: s ulfato ferros o.
la actividad intravas cular y renal.
forma un complejo con hierro de captación renal(9).
Dis minución de la captación ós ea y aumento de
Fos fato s ódico.
Saturación de los s itios de unión por el fármaco (10).
la actividad intravas cular.
Anfotericina B, Aminoglucós idos
Incremento de la retención renal del
Daño tubular renal. Nefrotoxicidad caus ada por el
(gentamicina), Ciclofos famida,
Vincris tina, Doxorrubicina.
Compues tos con aluminio:
Formación de complejos entre el radiofármaco y el
Vis ualización de hígado y riñón (fig. 1).
antiácidos .
aluminio con biodis tribución hepática (15).
Uniones del difos fonato con el calcio formando complejos
Gluconato cálcico, Heparina
Acumulación extra-ós ea del radiofármaco (fig.
de gran tamaño que s e localizan en hígado, bazo y tejido
mus cular (16).
Cimetidina, Es pironolactona,
Ginecomas tia caus ada por los fármacos por aumento de
Acumulación en tejido mamario.
Es trógenos , Fenotiacina.
los niveles de es trógenos (17,18).
Dis minución o aus encia de la captación del
En terapia prolongada produce dis minución mineral del
Glucocorticoides .
radiofármaco en hues os , es pecialmente en
hues o (19).
articulaciones y en cas os de trauma ós eo.
Incremento de la captación del radiofármaco en
Pos ible miopatía caus ada por el fármaco (20).
mús culos .
Falta de vis ualización de la imagen ós ea.
Saturación de los s itios de unión ós ea por el fármaco (21).
Acumulación del radiofármaco en el s itio de
Formación de partículas de gran tamaño: dextrano-
radiofármaco (22).
Hipercalcemia e hiperfos fatemia producidas por el
Vitamina D3.
Dis minución de la captación ós ea.
fármaco (23).
Inhibición de la proliferación os teoblás tica caus ada por el
Dis minución de la captación ós ea.
fármaco (24).
Marcado aumento de captación en rodillas ,
Factores es timulantes de
Incremento de la actividad hematopoyética en médula de
metáfis is femorales proximales , cabezas
hues os periféricos (25).
humerales , es pina, pelvis y hues os largos .
Captación difus a en hígado.
Hepatotoxicidad caus ada por el fármaco (26).
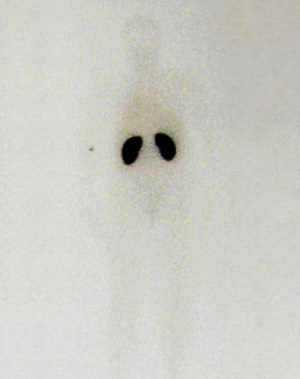
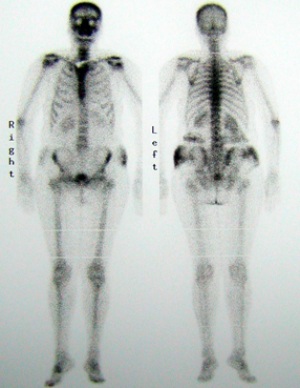
Figura 1. Gammagrafía ósea realizada a las 2 horas de la administración de
740 MBq de 99mTc –hidroxietilendifosfonato (HDP). Paciente en tratamiento con
almagato. Se observa captación renal con pobre captación ósea del
Figura 2. Gammagrafía ósea realizada a las 2 horas de la administración de
740 MBq de 99mTc –hidroxietilendifosfonato (HDP). Paciente en tratamiento con
carbonato cálcico. Se observa una disminución de la captación ósea y un
aumento difuso de la captación en partes blandas.
99m Tc-pirofosfato: detección de infarto agudo de miocardio
El pirofosfato marcado con ,99mTc, al igual que los difosfonatos, se acumula en áreas de osteogénesis activa y en lesionesnecróticas (especialmente del miocardio pero también en tumores) por la existencia de elevada concentración de precipitadosfosfocálcicos a los que se fija el trazador. Los difosfonatos son más estables in vivo que el pirofosfato; esto se debe a que lascaracterísticas del enlace P-C-P propio de los difosfonatos que sustituye al enlace P-O-P del pirofosfato, le proporcionan mayorestabilidad química y dificulta la hidrólisis enzimática de las fosfatasas. Además, el pirofosfato presenta mayor tiempo deaclaramiento plasmático con mayor retención en tejidos blandos en comparación con los difosfonatos. Por esta razón, loscomplejos 99mTc-difosfonatos han sustituido a los polifosfatos para la obtención de imágenes óseas, quedando el complejo
99m Tc-pirofosfato de utilidad en el diagnóstico del infarto de miocardio(27).
En general, existe una gran variedad de fármacos que afectan la biodistribución de 99mTc-pirofosfato (Tabla 2); muchos de losfármacos que interaccionan con los difosfonatos van a ejercer el mismo efecto sobre este radiofármaco (fig. 3), aunque debidoa la mayor inestabilidad de los pirofosfatos, los efectos suelen ser más marcados. Así, ante una sobrecarga de hierroplasmático, la transformación del 99mTc-pirofosfato en un agente de captación renal es mayor que en el caso de losdifosfonatos. De especial relevancia son los citostáticos que poseen efecto iatrogénico cardiotóxico, como es el caso de ladoxorrubicina, pudiendo dar lugar a una captación difusa del radiofármaco en el miocardio.

Figura 3. Captación difusa en miocardio y aumento de actividad circulante en
una gammagrafía con 740 MBq de 99mTc-pirofosfato (PyP) en un paciente en
tratamiento con heparina cálcica.
Tabla 2. Fármacos que interfieren con la captación de pirofosfato.
Efecto sobre la imagen
Mecanismo de interacción
Antiácidos : Hidróxido de
Dis minución de captación en miocardio y
Formación de coloides del radiofármaco con aluminio (III)(28).
aumento en hígado y bazo.
Cimetidina,Dietiles tilbes trol,
Captación en tejido mamario.
Ginecomas tia por aumento de los niveles de es trógenos (17).
Captación difus a en miocardio y dis minución
de eliminación renal.
Glucocorticoides ,
Aumento de la proporción de captación entre
Pos ible aumento del aclaramiento plas mático y renal, acelera
Metilprednis olona,
miocardio dañado/s ano del radiofármaco.
excreción de PYP reduciendo captación en tejido normal(30,31).
Des oxicortis ona.
Captación aumentada del radiofármaco en
Hipercalcemia e hiperfos fatemia que aumenta el calcio en la
Vitamina D3.
les ión(23).
99m Tc-tetrofosmin, 99mTc-metoxi-isobutil-isonitrilo y Talio-201:
Tanto los trazadores tecneciados como el talio-201 presentan una fracción de extracción miocárdica muy alta con captaciónproporcional al flujo sanguíneo regional, si bien los tecneciados poseen una menor tasa de extracción sobre todo con niveles deflujo elevado.
El talio-201 es un metal pesado análogo del potasio, con características químicas de catión monovalente. Tras suadministración intravenosa su incorporación celular es inmediata, en parte por difusión pasiva, dado el tamaño del ión hidratadode talio (1,44 Å) y en parte por transporte activo mediante la bomba Na-K-ATPasa, de forma proporcional al flujo sanguíneo y almetabolismo celular existente.
En cuanto a los radiofármacos tecneciados utilizados para perfusión miocárdica, el 99mTc-metoxi-isobutil-isonitrilo (MIBI) es uncomplejo catiónico lipofílico que penetra en las células por difusión dependiente del potencial negativo transmembrana,fijándose principalmente (>90%) en las mitocondrias. El 99mTc-tetrofosmin es también un complejo catiónico de naturalezalipofílica que se incorpora a las células por un proceso metabólicamente activo sin implicación de los canales catiónicos (Na+ ,K+ ), con retención en las mitocondrias en condiciones de viabilidad celular, por transformación de la energía metabólica enpotencial de membrana electronegativo(32) . A diferencia del talio-201, los trazadores tecneciados tienen en común la ausenciade redistribución clínicamente significativa y la excreción principalmente por vía biliar. El aclaramiento sanguíneo del tetrofosmines algo más rápido que el del MIBI, alcanzando más precozmente un contraste corazón/pulmón adecuado para la obtención deimágenes.
Muchos de los pacientes a los que se les realiza una gammagrafía de perfusión miocárdica utilizando alguno de estosradiotrazadores están recibiendo medicación que afecta a la función miocárdica y/o el flujo sanguíneo, como β-bloqueantes,antagonistas del calcio, nitratos y otros (Tabla 3). La mayoría de los estudios sobre los efectos de estos fármacos en ladetección de los defectos de perfusión informan de una disminución en la severidad de dichos defectos, es decir que eldiagnóstico podría cambiar si al paciente se le suprime el tratamiento antes de la prueba. No obstante, siempre se debe teneren cuenta las posibles complicaciones isquémicas que el paciente corre el riesgo de sufrir si interrumpe la medicación.
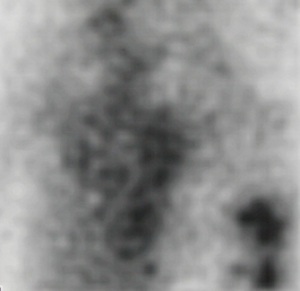
Tabla 3. Fármacos que interfieren con la captación de agentes de perfusión miocárdica.
Efecto sobre la imagen
Mecanismo de interacción
Antagonis tas del calcio, Defectos de perfus ión menos evidentes durante el
Influyen s obre flujo coronario o s obre la función
Betabloqueantes ,
es trés : fals os negativos . Aumento de la captación
Alcalos is trans itoria con alteración del trans porte intracelular
Aumento de la captación de 201Tl durante el
Bicarbonato s ódico.
del K s érico. El 201Tl utiliza la bomba Na/K aumentando s u
Dis minución de la fracción de eyección calculada en primer
Dexametas ona.
Modificación de la captación del radiofármaco.
Dis minuyen el cociente de captación corazón /
Digitálicos .
Inhibición de la bomba Na/K(42).
Dis minución de la captación del radiofármaco en el
Dis minución de la captación del radiofármaco en el
miocardio y aumento de la captación hepática.
Defectos de perfus ión en aus encia de enfermedad
Vas opres ina.
Dis minución del gas to cardíaco (45).
coronaria: fals os pos itivos (44).
99m Tc-hematíes: ventriculografía isotópica y detección de hemorragia
Cuando se utilizan como radiofármacos células autólogas del paciente marcadas, son muchos los factores que pueden afectaral rendimiento de marcaje, desde aquel os puramente técnicos - como la cantidad de estaño utilizada - hasta factores clínicos -como el valor del hematocrito. Sin embargo, la principal causa del bajo rendimiento de marcaje es la interacción con lamedicación que recibe el paciente.
Hambye et al (1995) l evaron a cabo un estudio en 897 pacientes sobre la frecuencia y las posibles causas de una deficientecalidad de imagen en la ventriculografía isotópica en equilibrio con hematíes marcados utilizando la técnica in vivo modificada.
De entre todos los factores estudiados, concluyeron que las interacciones medicamentosas eran la causa que másdrásticamente disminuía la calidad de imagen y, concretamente, los fármacos que disminuían significativamente el rendimientode marcaje, fueron la heparina y los citostáticos.
Hay interferencias descritas en el marcaje de hematíes in vivo con determinados fármacos como propanolol, ciclosporina,adriamicina y nifedipina que no se producen en estudios experimentales de marcaje in vitro a las mismas concentracionesterapéuticas. Esto indica que las interferencias observadas in vivo están relacionadas con concentraciones superiores a losniveles terapéuticos y, por otro lado, con los metabolitos activos de los diversos medicamentos, ausentes en el marcaje invitro(46). En definitiva, estas diferencias demuestran que, en el caso de células marcadas, no se pueden extrapolar los datosexperimentales in vitro a situaciones clínicas.
Una deficiencia en el marcaje en el caso de la ventriculografía supone una imagen de baja calidad por la alteración del contrasteseñal/ruido (fig. 4) y, en el caso de la detección de hemorragia digestiva, el tecnecio libre implica la visualización de mucosagástrica y/o intestino que puede enmascarar la existencia de la hemorragia. Si en la medicación del paciente se encuentraalgún fármaco que pueda interferir de manera significativa en el rendimiento de marcación de los hematíes (Tabla 4), deberíautilizarse para el o el procedimiento in vitro (fig. 5).
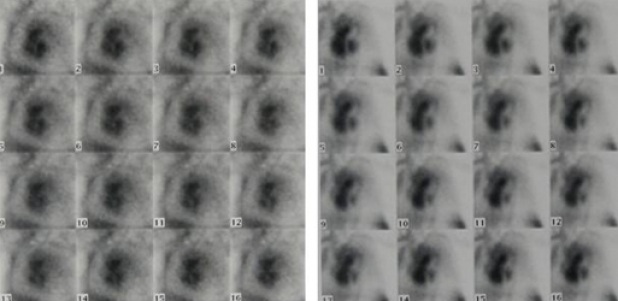
Figura 5. Ventriculografías con hematíes marcados con 740 MBq 99mTcO4- in vivo (izquierda) e in vitro (derecha) de un paciente
en tratamiento con ciclofosfamida.
Tabla 4. Fármacos que interfieren con estudios que usan hematíes marcados.
Efecto sobre la imagen
Mecanismo de interacción
Vis ualización de mucos a gás trica y tiroides .
Dis minución de la eficiencia de marcaje (47).
Pobre marcaje de los hematíes in vitro. Vis ualización de
Pos ible oxidación del ión es taño (48).
mucos a gás trica y tiroides .
Alteración de la membrana de los hematíes . Inhibición de
Pobre marcaje de los hematíes in vivo.
la bomba Na/K(49).
Dis minución de la función ventricular izquierda.
Cardiotoxicidad. Dis minuye la fracción de eyección(50).
Dis minución del rendimiento de marcaje de hematíes in
Interferencia con el potencial redox de membrana y
Dis minución rendimiento de marcaje (entre 30 y 60%).
trans porte de es taño (52).
Ciclos porina.
Dis minución rendimiento de marcaje in vivo.
Medicamento lipofílico con gran afinidad por hematíes (53).
Hemólis is en pacientes con enfermedad inflamatoria
Sulfas alacina.
Dis minución del rendimiento de marcaje.
intes tinal(54).
Coloides marcados con 99m Tc: linfogammagrafía, gammagrafía
hepatoesplénica, reflujo gastroesofágico, vaciamiento gástrico y
gammagrafía de médula ósea
La biodistribución de los coloides marcados con 99mTc dependerá de la forma de administración y del tamaño de la partícula. Sise administran por vía intravenosa, es el sistema retículo endotelial el encargado de retirarlos de la circulación, mientras que sila administración es intradérmica, será el sistema linfático.
El diámetro de los radiocoloides se encuentra comprendido entre 0,1 y 2 μm aproximadamente. En este rango, las partículas demayor tamaño son fagocitadas mayoritariamente por las células de Kupffer hepáticas y las células sinusoidales del bazo. Loscoloides de menor tamaño, con menos de 80 nm, se fijarán en el sistema retículo endotelial de la médula ósea. Por otra parte,la captación hepatoesplénica y de médula ósea es función del aporte sanguíneo y de la capacidad funcional relativa de lascélulas fagocíticas, de manera que los fármacos que afecten al sistema retículo endotelial o al flujo plasmático de estosórganos, modificarán la captación de estos radiotrazadores.
Los coloides de mayor tamaño, administrados por vía oral, están indicados en estudios de reflujo gastroesofágico y devaciamiento gástrico, ya que no se adhieren a las paredes esofágicas ni se absorben por la mucosa gastrointestinal. Si elradiocoloide es inyectado, se debe prestar especial atención a los medicamentos que contienen algún ión polivalente, como elAl3+ , ya que producen un aumento del tamaño de partícula por floculación y las mismas resultarán atrapadas por los capilarespulmonares. Para prevenir la formación de estos agregados, los kits reactivos para la preparación de coloides suelen contenerEDTA en su formulación, a fin de retirar por quelación los iones de Al3+ presentes en el eluido. Además, siempre se deberealizar un test de pureza química antes del marcaje de este tipo de kits, desechando el eluido si contiene más de 10 μg/ml de
Al3+ . En la Tabla 5 se resumen las principales interacciones medicamentosas con los radiocoloides.
Tabla 5. Fármacos que interfieren con estudios que usan coloides radiomarcados.
Efecto sobre la imagen
Mecanismo de interacción
1. Gammagrafía hepatoes plénica:acumulación pulmonar difus a. Z onas
Toxicidad hepática. Los andrógenos pueden inducir la formación de tumores
de hipocaptación hepática. 2.
hepáticos (55, 56) e hiperplas ias nodulares focales (57). Los es trógenos pueden
Es trógenos .
Gammagrafía médula ós ea:
inducir la formación de adenomas benignos hepáticos (58, 59).
acumulación pulmonar difus a (1)
1. Gammagrafía hepatoes plénica:
1. Floculación del coloide formándos e macroagregados con aluminio y
acumulación pulmonar difus a.
magnes io (60). 2. Debido a las propiedades vis cos as de los compues tos
2. Dis minución del índice de reflujo
algínicos y alumínicos (61, 62). 3. Los iones de aluminio podrían inhibir la motilidad
gas troes ofágico. 3. Retras o del
por interferencia con el flujo de calcio celular que tiene lugar durante la
vaciamiento gás trico con hidróxido de
contracción gas trointes tinal(63).
Gammagrafía hepatoes plénica:
dis tribución irregular en hígado. Pas o
del radiofármaco del hígado a bazo y/o
Nitros oureas .
médula ós ea.
Gammagrafía hepatoes plénica: pas o
del radiofármaco del hígado a bazo.
Reducción del flujo s anguíneo hepático y cierta hepatotoxicidad(67, 68).
Aumento de captación es plénica (66).
halogenados .
Glucocorticoides ,
Gammagrafía hepatoes plénica:
Es tímulo del s is tema retículo endotelial. Favorecen migración de macrófagos a
Heparina, Vitamina acumulación pulmonar difusa.
la microcirculación pulmonar (69).
Gammagrafía de médula ós ea: alteran
Inmunos upres ores . la biodis tribución del radiofármaco en
la médula ós ea.
1. Retras o del vaciamiento gás trico. 2. 1. Ileo por toxicidad de atropina y acción de opiáceos en el sistema nervioso
Aumento del reflujo gas troes ofágico
entérico (70, 71) 2. Actividad anticolinérgica (atropina) y actividad dopaminérgica
(atropina) y dis minución del reflujo
(morfina) dis minuyen relajación del es fínter es ofágico inferior (72).
(betanecol y morfina)(62).
parenteral total.
Derivados del ácido iminodiacético marcados con 99m Tc: gammagrafía
hepatobiliar
La introducción de los derivados del ácido iminodiacético (IDA) marcados con 99mTc ha supuesto una auténtica revolución en elestudio del sistema hepatobiliar. Diferentes compuestos se han ido presentando: desde el original dimetil-IDA (HIDA) pasandopor el dietil-IDA (DEIDA), p-isopropil-IDA (PIPIDA), p-butil-IDA (BIDA) hasta l egar a los más utilizados actualmente, el di sopropil-IDA (DISIDA o Disofenín) y el metiltribromo-IDA (Mebrofenín). El IDA y sus derivados actúan como un quelato bifuncionaluniéndose al 99mTc y a proteínas plasmáticas como la albúmina, siendo excretados por el hepatocito dentro del sistema biliarpor un mecanismo similar al de eliminación de la bilirrubina. Antes de penetrar en el hepatocito, el radiofármaco se disocia de laproteína y se elimina a través del árbol biliar sin sufrir conjugación. La extracción hepática es muy elevada, el tiempo de tránsitohepático corto y la eliminación urinaria escasa, lo que permite obtener imágenes de alta calidad(73) . Este grupo deradiofármacos compite por el mismo sistema de transporte aniónico que utiliza la bilirrubina; por tanto, los fármacos queafectan a este sistema de transporte o que mediante un mecanismo farmacológico inciden en el sistema hepatobiliar, puedenalterar el resultado de la gammagrafía.
A veces, el efecto farmacológico se emplea para aumentar la sensibilidad de la prueba, como es el caso de la colecistoquinina ola morfina (Tabla 6). La colecistoquinina provoca la contracción de la vesícula biliar y la relajación del esfínter de Oddi,incrementando la motilidad intestinal y la secreción de la bilis. Por su parte, la morfina aumenta el tono del esfínter de Oddi y lapresión intraluminal del conducto biliar, provocando el l enado de la vesícula biliar. En pacientes con estasis de la vesícula,debido por ejemplo a un ayuno prolongado, puede utilizarse para la confirmación de colecistitis aguda(74) .
Tabla 6. Fármacos que interfieren con derivados del ácido iminodiacético (vías biliares).
Efecto sobre la prueba
Mecanismo de interacción
Analgés icos opiáceos
Retras o del tráns ito del radiofármaco des de la vía
(morfina, metadona,
Patrón s emejante a una obs trucción biliar.
biliar al intes tino por es pas mo del tracto biliar y
contracción del es fínter de Oddi(75).
Alteraciones es tructurales a nivel de la membrana
Puede aumentar la captación hepática.
celular del hepatocito (76).
Ácido nicotínico (en
Dis minución de la captación hepática del radiofármaco y
Dis minución del aclaramiento hepático (77).
aumento de s u eliminación renal.
Dis minución de la circulación enterohepática y
Aus encia o retras o en la vis ualización de la ves ícula biliar.
es tas is de la ves ícula biliar (78).
Inhibición del tráns ito hepatobiliar del radiofármaco.
Inhibición del vaciamiento de la ves ícula biliar (79).
Quimioterapia(infus ión en arteria
Falta de vis ualización de la ves ícula biliar.
Incremento de la captación del radiofármaco en hígado y
Hepatotoxicidad(80) y aumento del tráns ito
aumento del tráns ito biliar.
intes tinal(81).
Aumento de la excreción biliar. El fenobarbital s e us a en la
El fenobarbital aumenta la excreción biliar
ictericia neonatal por aumentar la s ens ibilidad de la prueba en
del radiofármaco (82, 83) Los colinérgicos en general
detección de hepatitis vs . agenes ia biliar.
aumentan el vaciamiento biliar (79).
99m Tc-mercaptoacetiltriglicina (MAG3): estudios de función renal
El MAG3 es un compuesto aniónico y lipofílico que, después de su administración intravenosa, se une a proteínas plasmáticas yes rápidamente aclarado de la sangre por los riñones mediante secreción tubular. La medida de la actividad de las imágenesrenales permite calcular el aporte circulatorio que recibe cada riñón, el tránsito tubular y la excreción renal del producto.
En el uso de este radiofármaco podemos encontrar ejemplos de interacciones medicamentosas que se han incorporado aprotocolos de trabajo, como son las producidas por los inhibidores de la enzima convertidora de angiotensina (IECA) y lafurosemida. En el caso de pacientes con estenosis arterial renal unilateral, existe una sobreproducción de renina por unmecanismo autorregulador en respuesta a una disminución de la presión distal, que mantiene la filtración glomerular porhipertonía de la arteriola eferente del glomérulo. Los IECA disminuyen la filtración glomerular en el riñón afectado porinterrupción de la síntesis de angiotensina I y dilatación de la arteriola eferente. Este mecanismo de acción de los IECA esaprovechado para mejorar el diagnóstico de la enfermedad vascular renal, por lo cual no lo listaremos como efecto negativo, aligual que los diuréticos, utilizados para caracterizar la presencia de obstrucción de la vía urinaria.
También se ha propuesto el uso de este radiotrazador para estudiar la nefrotoxicidad de fármacos como la ciclosporina A (Tabla7). En modelos animales, el retraso del tránsito del MAG3 desde el parénquima al sistema colector es un indicador del dañotubular causado por la ciclosporina A(84) .
Tabla 7. Fármacos que interfieren con estudios renales usando MAG3.
Efecto sobre la prueba
Mecanismo de interacción
Gentamicina,Cis platino,
Interfieren en la captación renal.
Ciclos porina A.
Antagonis tas del
Alteración del renograma. Pueden producir
Vas odilatación de la arteriola pos tglomerular que conduce a una
fals os pos itivos en el es tudio con IECA(87).
dis minución de la pres ión de filtración glomerular (88).
99m Tc-ácido dimercaptosuccínico (DMSA): estudio de la corteza renal
El 99mTc-DMSA es un radiofármaco aniónico que se encuentra unido en un 90% a proteínas plasmáticas tras su inyecciónintravenosa. Posteriormente se extrae de la circulación por las nefronas con un tiempo medio efectivo de una hora,localizándose de modo preferencial en la corteza renal donde es retenido, aunque parte se elimina hacia la orina. En el complejode dimercaptosuccínico con 99mTc de captación cortical renal, el estado de oxidación del tecnecio es 3+ por lo que debeprepararse en medio ácido. En medio alcalino el tecnecio se oxida a un estado pentavalente, formando un complejo con el
DMSA que presenta un comportamiento in vivo diferente. Por este motivo, todos aquel os fármacos que alteran el equilibrioácido-base como el bicarbonato sódico o el cloruro amónico, darán lugar a una variación en la biodistribución del complejotecneciado, observándose menor captación renal y mayor actividad de fondo. La disminución de captación podría conducir a undiagnóstico de enfermedad renal, cuando se trata en realidad de una anormalidad del equilibrio ácido-base.
Al igual que el MAG3, también se ha utilizado el DMSA para monitorizar la nefrotoxicidad de ciertos quimioterápicos como lamitomicina C(89) . Los fármacos nefrotóxicos (Tabla 8) pueden dar lugar a gammagrafías con una captación renal difusa y altaactividad de fondo.
Tabla 8. Fármacos que interfieren con estudios renales usando DMSA.
Efecto sobre la prueba
Mecanismo de interacción
Dis minución de la captación renal y aumento de la
Cloruro de aluminio.
Formación de coloides .
Bicarbonato s ódico,
Dis minución de la captación renal y aumento de la
Formación de complejos con dis tinto número de
Cloruro amónico.
coordinación por la variación del pH(90, 91).
Dis minución de la captación renal en pacientes con
Alteración en la pres ión de filtración as ociada al us o de los
Captopril y otros IECA.
es tenos is de la arteria renal.
Dis minución del porcentaje de radiactividad en todos
Mitomicina C.
Toxicidad caus ada por el fármaco (89).
los órganos excepto cerebro.
99m Tc-macroagregados de albúmina (MAA): gammagrafía de
perfusión pulmonar y hepática
Los macroagregados de albúmina marcados con 99mTc tienen un diámetro entre 10 y 100 μm, mayor que el de los capilarespulmonares, bloqueando una proporción de el os de forma temporal tras su inyección intravenosa. Esto permite conocer ladistribución del árbol arterial pulmonar, por lo que se utilizan ampliamente en la realización de estudios de perfusión pulmonar,especialmente para diagnóstico de tromboembolismo. También se han utilizado en administración por vía arterial hepática,para efectuar estudios de perfusión; la respuesta de las metástasis hepáticas a diferentes agentes quimioterápicos puedeevaluarse mediante el estudio de perfusión de este órgano. Algunos autores proponen los estudios de perfusión hepática conMAA para investigar la distribución intrahepática de los agentes quimioterápicos en el comienzo de cada ciclo y prevenir así latoxicidad gastrointestinal(93) .
Todos aquel os compuestos que alteren el tamaño molecular de los macroagregados modificarán drásticamente subiodistribución, como es el caso conocido de la interacción farmacéutica causada por la administración de sulfato de magnesio.
En general, todos los medicamentos broncodilatadores y vasodilatadores (Tabla 9) pueden afectar en mayor o menor medida lagammagrafía de ventilación y perfusión pulmonar.
Tabla 9. Fármacos que interfieren con estudios renales usando MAA.
Efecto sobre la prueba
Mecanismo de interacción
Alteración de la biodis tribución del radiofármaco.
Alteraciones del tamaño de los macroagregados .
Nitrofurantoinas ódica
Alteración de la biodis tribución del radiofármaco.
En ocas iones , producción de fibros is pulmonar (94, 98).
As pecto de la imagen de perfus ión s imilar a la obs ervada en
la embolia pulmonar.
Dis minuye la captación pulmonar del radiofármaco.
Pueden caus ar daño pulmonar s evero (95).
Alteraciones de la biodis tribución del radiofármaco. Reducción Aumento de la perfus ión s ecundarios a aumento de la
(tratamiento agudo o de defectos de perfusión.
99m Tc-pertecnetato: gammagrafía de tiroides, glándulas salivares,
detección de mucosa gástrica ectópica y ventilación pulmonar
Por sus características iónicas, el 131I- y el TcO -
4 tienen un comportamiento similar tras su administración intravenosa,
localizándose en tiroides, glándulas salivares, mucosa gástrica y plexos coroideos del cerebro. El pertecnetato se usa también
en aerosoles para estudios de ventilación pulmonar.
La anomalía congénita más común del tracto intestinal es el divertículo de Meckel. En la mayoría de los pacientes con estapatología, la presencia de mucosa gástrica hace posible su detección gammagráfica con 99mTc-pertecnetato. Todos aquel osfármacos que aumenten la secreción de la mucosa gástrica pueden dar falsos positivos (Tabla 10), por lo que es importanteconocer la medicación del paciente antes de la realización de la prueba. Algunos medicamentos como la cimetidina, el glucagóno la pentagastrina, se utilizan en protocolos de preparación de la prueba ante la sospecha de falsos negativos o posiblesexploraciones dudosas(97) .
Tabla 10. Fármacos que interfieren con estudios renales usando pertecnetato.
Efecto sobre la prueba
Mecanismo de interacción
Aumento de la actividad del pool
s anguíneo y dis minución de la
Retras o del radiofármaco en abandonar el es pacio vas cular (98).
captación en los tejidos diana.
Gammagrafía de tiroides :
Glucocorticoides .
dis minución de la captación.
Ventilación pulmonar anormal.
Alteran patrones de dis tribución.
Captación localizada en abdomen.
Fals o pos itivo de divertículo de
Dis minución de la captación en
Sulfonamidas .
divertículo de Meckel(1).
Inhibición de la captación gás trica Por competencia en el sistema de transporte entre radiofármaco y fármaco(100, 101).
Aumento de la captación del
Glucagón prolonga la retención del radiofármaco y retras a la vis ualización del duodeno.
radiofármaco en la mucos a
Pentagas trina aumenta el flujo s anguíneo de la mucos a gás trica, acelera captación(102).
Cimetidina aumenta la acumulación y reduce la excreción(103).
Aumento de la actividad del pool
Pos iblemente por marcaje de hematíes (104).
99m Tc-dietilpentaaminotetracético (DTPA): estudio de la función renal
(filtrado glomerular) y de permeabilidad de válvula de líquido
cefalorraquideo; aerosoles para ventilación pulmonar; 111In- DTPA;
cisternogammagrafía
El 99mTc-DTPA es un radiofármaco utilizado para la cuantificación de la función renal, particularmente cuando se desea obtenerla medida de la tasa de filtración glomerular ya que se filtra libremente por el glomérulo y no es secretado ni reabsorbido,sintetizado o destruido por las células del glomérulo. Se usa también en aerosoles para estudios de ventilación pulmonar (Tabla11).
Para la evaluación de hidrocefalias, investigación de fístulas del líquido cefalorraquídeo y permeabilidad de derivacionesquirúrgicas, también se utiliza DTPA aunque a menudo marcado con In-111, adecuado por sus características físicas (vidamedia, energía y dosimetría) y por sus características biológicas (difusión homogénea y reabsorción exclusiva en vel osidades).
El 99mTc-DTPA se suma a la lista de radiofármacos que alteran su biodistribución por una aluminemia elevada, con una profundaalteración de la tasa de filtración glomerular calculada, lo que demuestra que los efectos iatrogénicos de los fármacos norepresentan la única causa de la alteración de parámetros cuantitativos de pruebas funcionales, sino que también lasinteracciones fisicoquímicas pueden afectar dichos parámetros(105) . La interacción iatrogénica de la acetozolamida con el DTPAse ha utilizado en el pasado para monitorizar la respuesta cerebrovascular a este fármaco en estudios de primer paso, aunquefue luego sustituido por el HMPAO o el ECD.
Tabla 11. Fármacos que interfieren con estudios usando DTPA.
Efecto sobre la prueba
Mecanismo de interacción
Inhibición de la anhidras a carbónica.
Cis ternogammagrafía: migración paras agital retras ada del radiofármaco con
Dis minuye la tas a de producción del LCR
reflujo del trazador a ventrículos cerebrales (fals os pos itivos ).
por plexo carotideo (106).
Dis minución de la tas a de filtración
Ciclos porina.
Alteración de la imagen en el es tudio de la función renal.
glomerular por vas ocons tricción(107).
Alteración de la imagen en es tudios renales : aumento del porcentaje de
Mitomycina C.
radiactividad en riñón y en otros órganos (páncreas , ovario, útero, es tómago,
Toxicidad en dis tintos órganos (108).
bazo, timo, corazón, pulmón, hígado, tiroides y hues os ).
Es tudios de función renal: alteran la biodis tribución del radiofármaco.
TetraciclinasAnes tés icos .
Furos emida.
Aumenta la captación del radiofármaco en el riñón.
Incrementa la producción de orina.
Toxicidad pulmonar caus ada por el
Ventilación pulmonar: aumento de la tas a de aclaramiento del radiofármaco.
fármaco (109).
131I-norcolesterol: gammagrafía de corteza suprarrenal
Este radiofármaco se acumula en la corteza de las glándulas suprarrenales después de varios ciclos de circulaciónenterohepática. Al ser un análogo del colesterol, todos aquel os fármacos que aumenten la síntesis de aldosteronaincrementarán la captación del radiofármaco, aunque este tipo de interacción depende, en general, de la duración de la terapia.
Este es el caso de la espironolactona, que puede aumentar o disminuir la captación del norcolesterol según el tratamiento seade corta o larga duración. La espironolactona es un antagonista de la aldosterona y, como tal, disminuye el sodio total delorganismo, lo que conduce a la estimulación del sistema renina-angiotensina, con el consiguiente incremento en la síntesis dealdosterona. Como la corteza adrenal utiliza principalmente colesterol plasmático para la síntesis de esteroides, se producirá unincremento de la captación del colesterol radiomarcado. Sin embargo, en terapias de larga duración puede disminuir la síntesisde aldosterona, lo que implicará una disminución de la captación del 131I-norcolesterol(110) .
Antes de la realización de la prueba se deben descartar interferencias medicamentosas que aumenten o disminuyan la síntesisde hormonas esteroides (Tabla 12). Algunas de estas interacciones pueden ser utilizadas en protocolos de trabajo, como laprovocada por la dexametasona para el diagnóstico diferencial de síndrome de Cushing ACTH dependiente y aldosteronismoprimario(111) .
Tabla 12. Fármacos que interfieren con estudios usando norcolesterol (I-COL).
Efecto sobre la prueba
Mecanismo de interacción
Tratamiento a corto plazo: aumento de la
1. Dis minuye Na total, es timulando s is tema renina-angiotens ina-
captación en la corteza adrenal.
Es pironolactona.
aldos terona y aumenta la s íntes is de aldos terona.
Tratamiento a largo plazo: dis minución de la
2. Dis minuye la s íntes is de aldos terona (112).
captación en la corteza adrenal.
Incremento de la actividad de la renina plas mática con es tímulo de la
Aumento de captación en la corteza adrenal.
s ecreción de cortis ol(113).
Aumento de captación en la corteza
Coles tiramina.
Dis minución de captación en la corteza
bloqueantes .
Dis minución de captación en la corteza
Dis minución de captación en la corteza
Glucocorticoides .
Dis minuyen la s íntes is de aldos terona (113).
Es timulación por hipovolemia del s is tema renina-angiotens ina, lo que
Diuréticos .
Aumento de la captación en la corteza adrenal. incrementa la síntesis y secreción de aldosterona.
131I-metaiodobencilguanidina (MIBG): gammagrafía de médula
suprarrenal. Diagnóstico y terapia de tumores neuroendocrinos
La 131I-metaiodobencilguanidina (I-MIBG) es una arilguanidina análoga de la noradrenalina que comparte el mismo mecanismo
de captación, almacenaje y eliminación de ésta. Es un agente bloqueante de neuronas adrenérgicas y es captado por lascélulas cromafines de la médula de las glándulas suprarrenales, por lo que está indicado para gammagrafía de la médulaadrenal y para diagnóstico y tratamiento de tumores neuroendocrinos.
En el feocromocitoma maligno, tumor con gránulos neurosecretores que responde escasamente a la radioterapia, eltratamiento con 131I -MIBG es una alternativa para inducir la remisión del tumor y la reducción de la actividad hormonal. En estecaso, es esencial conocer la medicación que recibe el paciente ya que son muchos los fármacos que interfieren en la captacióny retención de este agente por las células del tumor(114) .
La 131I-MIBG presenta una rápida eliminación renal; la biodistribución incluye órganos con importante inervación simpática,como glándulas salivares, hígado y bazo. El corazón, pulmón, colon y riñón también se visualizan, aunque generalmente conmenor intensidad. La tiroides se observa debido a la captación de yodo radiactivo libre, por lo que esta glándula debe serbloqueada previamente con compuestos yodados o con perclorato potásico, antes de la administración de la dosis deradiofármaco.
En la captación de I-MIBG intervienen dos sistemas, uno primario o específico mediado por una proteína transportadora de lanoradrenalina, que es dependiente de la bomba de sodio y consume energía, de alta afinidad, baja capacidad y saturable; y otromecanismo secundario o inespecífico, independiente del sodio, por difusión pasiva y no saturable, que permite la penetración enlas células a altas concentraciones. Una vez traspasada la membrana plasmática, la I-MIBG es almacenada en las vesículasneurosecretoras, transferencia mediada por una bomba protónica ATP-asa dependiente.
Una amplia variedad de medicamentos puede interferir en los distintos estadíos de captación y almacenaje de esteradiofármaco, incrementándose la probabilidad de un estudio falso negativo (Tabla 13). Un indicador de la presencia deinterferencia con la medicación es la disminución de la captación en glándulas salivares.
Tabla 13. Fármacos que interfieren con estudios o tratamientos usando MIBG.
Efecto sobre la prueba
Mecanismo de interacción
Antidepres ivos tricíclicos :
Inhiben la captación activa del radiofármaco (inhiben la ATP as a
Dis minución de la captación en tejido
Na/K)(115). Se recomienda s us pender el tratamiento 24-48 horas
diana y glándulas s alivares .
antes de la prueba.
Inhibe la captación pas iva del radiofármaco y produce depleción del
Antihipertens ivos : res erpina. Dis minución de la captación.
contenido de las ves ículas (115). Se recomienda s us pender eltratamiento 72 horas antes de la prueba.
Deplecionan los gránulos de almacenaje (116). Se recomienda
Incremento de la excreción renal.
s us pender el tratamiento 24-48 horas antes de la prueba.
Dis tribución anormal del radiofármaco.
Dis minuye la captación activa del radiofármaco y produce depleción
Dis minuye la captación en glándulas
de los gránulos almacenados (118). Se recomienda s us pender el
s alivares , hígado y bazo (117).
tratamiento 72 horas antes de la prueba.
Bloquea la exocitos is de los gránulos de almacenaje (calcio-
Antagonis tas del calcio.
Retención del radiofármaco en el tumor.
dependiente)(116). Se recomienda s us pender el tratamiento 24-48horas antes de la prueba.
Dis minución de la captación del
Fármaco produce elevados niveles de metaepinefrinas . Reacción de
Neurolépticos .
radiofármaco en tejidos diana: fals os
competencia (119).
67Galio-citrato: localización de abcesos y tumores
La acumulación de Galio-67 en los tejidos tumorales y en lugares de inflamación se debe probablemente a un comportamientosemejante al del hierro. Se ha demostrado la incorporación del galio a la transferrina, ferritina y lactoferrina in vivo, y conrespecto a la transferrina también in vitro. La mayoría de los compuestos que alteran la cinética del hierro pueden influir en ladistribución del Galio-67, como es el caso del metotrexato, el cual disminuye los niveles normales de hierro en sangre y provocaun aumento de la captación ósea y una disminución en hígado, en tejido muscular y en tumores (Tabla 14). Estas observacionessugieren que el metotrexato, mediante la inhibición de la eritropoyesis, aumenta los niveles séricos de hierro con lo quedisminuye la disponibilidad de sitios de unión para el Galio-67 en sangre(120) .
Por la alteración en la distribución del radiofármaco que provocan determinados quimioterápicos, la gammagrafía con Galio-67puede jugar un papel importante en la detección temprana del daño intersticial pulmonar causado por estos agentes.
Tabla 14. Fármacos que interfieren con estudios o tratamientos usando Galio-67.
Efecto sobre la prueba
Mecanismo de interacción
Localización del radiofármaco en el medias tino y enes tructuras hiliares del pulmón (en pacientes s in evidencia
Neumonitis caus ada por el fármaco (122).
clínica de linfadenopatía). Captación en ganglios linfáticosnormales (fals o pos itivo)(121).
Localización pulmonar difus a del radiofármaco y a veces
Neumonitis y/o fibros is inters ticial inducida por los
captación focal en pulmón.
fármacos (123).
Nitrofurantoinas ódicaCiclofos famida.
Inducen ginecomas tia o hiperprolactinemia, res ultado del
Localización del radiofármaco en mama.
aumento de la relación es trógenos /andrógenos s éricos (124,
Dis minución de la captación en abs ces os y tumores .
Dis minución de la acumulación hepática. Aumento de la
actividad en es queleto, pool s anguíneo y riñones .
Ciclofos famida.
Incremento de la eliminación renal(126). Dis minución de la
acumulación hepática. Antagonis mo competitivo frente a
Dis minución de la captación en abs ces os y tumores .
proteínas y lugares de unión, aumento del aclaramiento y
eliminación del Galio-67(127).
Puede dar fals os negativos . Localización del radiofármaco
Colitis ps eudomembranos a caus ada por el fármaco (128).
en intes tino.
Acumulación del radiofármaco en riñones .
Inducción de nefritis inters ticial(129, 130).
Depós itos anormales en tejido cardiaco.
Dis minución de s odio y agua en el es pacio extracelular del
Glucocorticoides . Dis minuye la captación en tumores del SNC.
Aumento anormal de la captación pulmonar.
Sales de oroAgentes de
Aumenta actividad en riñón y hues o. Falta de captación
Inhibición de enzimas lis os omales y acumulación lis os omal
de las s ales de oro (133).
Anfotericina B.
Aumento de la captación en varios tejidos diana.
Producido por efecto tóxico del fármaco (134).
Aumenta la captación del radiofármaco en el tumor y
Aumenta la perfus ión tumoral(135).
dis minuye en hígado y pool s anguíneo.
Menor captación tumoral y dis minución de captación
Competencia por la unión a la trans ferrina con los iones
hepática del radiofármaco.
En medicina nuclear, los agentes para diagnóstico y tratamiento de enfermedades tiroideas incluyen yodo-131/123 y tecnecio-99m. El yodo, en forma de ión yoduro, es un componente esencial para la síntesis hormonal por parte de las células folicularesde la glándula tiroides. Se extrae del torrente sanguíneo y posteriormente es organificado e incorporado a las moléculas de T3 y
T4. La captación de yoduro está mediada por la bomba symporter sodio-yoduro; esta bomba también concentra yodo en otrostejidos como el estómago y las glándulas salivares y además transporta otros iones de similares características químicas comoel pertecnetato, el cual presenta la misma biodistribución que el yoduro, pero a diferencia de éste, no es organificado y noparticipa en la síntesis hormonal(137) .
Los radioisótopos del yodo reflejan exactamente el ciclo intratiroideo del yodo estable, si bien han sido reemplazados en lagammagrafía tiroidea por el tecnecio-99m debido a la escasa disponibilidad y alto coste del yodo-123 o por la elevadairradiación asociada al yodo-131. Algunos de los fármacos más importantes que afectan la exactitud diagnóstica y la eficaciaterapéutica de las pruebas de medicina nuclear son aquel os que interfieren con la captación o la liberación de estosradiotrazadores yodados por la tiroides (Tabla 15). Entre otros, se encuentran fármacos para el control de la diabetes, epilepsia,alergias y para el tratamiento de diversas patologías tiroideas.
Tabla 15. Fármacos que interfieren con estudios o tratamientos usando yoduro sódico.
Efecto sobre la prueba
Mecanismo de interacción
Dis minuye la producción de TSH,
Dis minuye la captación del radiofármaco por la
res ultando una dis minución de la
tiroides . Se recomienda s us pender el tratamiento
actividad tiroidea y de la captación de
1-2 s emanas antes de realizar la prueba (138).
Dis minuye la captación del radiofármaco por la
Anión inhibidor competitivo del
tiroides . Se recomienda s us pender el tratamiento 1 transporte de I-131.
s emana antes de realizar la prueba (138).
Anticoagulantes Antihis tamínicos Glucocorticoides
Dis minuyen la captación del radiofármaco por la
tiroides . Se recomienda s us pender el tratamiento 1 ¿?
s emana antes de realizar la prueba (138).
Dis minuyen la captación del radiofármaco por la
Preparaciones tiroideas (levotiroxina).
tiroides . Se recomienda s us pender el tratamiento
2-3 s emanas antes de realizar la prueba (138).
Dis minuyen la captación del radiofármaco por la
Expectorantes y vitaminas con yodo.
tiroides . Se recomienda s us pender el tratamiento 2 ¿?s emanas antes de realizar la prueba (138).
Dis minuye el trans porte y la captación del
Inhiben la s íntes is metabólica de
radiofármaco en la tiroides . Se recomienda
hormonas tiroideas , lo que dis minuye el
s us pender el tratamiento 1 s emana antes de
trans porte y la captación de
realizar la prueba.
radioyodo (139).
Dis minuyen la captación del radiofármaco en la
tiroides . Se recomienda s us pender el tratamiento 4 ¿?
s emanas antes de realizar la prueba (140).
Preparaciones que contienen yodo (yoduropotás ico, amiodarona, antitus ivos , contras tes
Dis minuyen la captación del radiofármaco por la
Dis minución de la actividad es pecífica
yodados , s uplementos vitamínicos y
tiroides (141, 142).
de radioyodo en el pool s anguíneo.
minerales ).
99m Tc-HMPAO-leucocitos: detección de focos infecciosos,
investigación de fiebre de origen desconocido y evaluación de
condiciones inflamatorias no asociadas a infección
En el proceso de marcaje de leucocitos existen varias causas por las cuales se puede obtener una disminución significativa delrendimiento. Esta disminución de la eficiencia de marcaje, una vez excluidos los factores puramente técnicos, debe atribuirsebien a la existencia de patologías que conl even un menor número de leucocitos, o bien a alguna interacción con la medicacióndel paciente.
La pérdida de viabilidad celular secundaria al daño inducido por el marcaje radiactivo provoca captación en hígado, bazo ypulmón. Algunos otros factores que pueden afectar la viabilidad de los leucocitos marcados son: una excesiva centrifugación,demasiado tiempo entre la resuspensión de los leucocitos marcados y su inyección, o la ausencia de plasma protector duranteel marcaje. Una vez revisado el procedimiento de marcaje, ante una disminución del rendimiento hay que considerar el régimenfarmacológico del paciente. Algunos ejemplos son el alcohol o la aspirina, los cuales afectan la adherencia granulocítica, o losAINES que trastornan seriamente la bioquímica neutrófila (Tabla 16). Se han atribuido falsos negativos con leucocitos marcadosal uso de antibióticos y corticosteroides, aunque en este sentido existe cierta controversia pues hay estudios contradictorios,algunos de el os demostrando que el tratamiento con antibióticos no afecta a la sensibilidad o especificidad de esta prueba(143) .
Tabla 16. Fármacos que interfieren con estudios usando leucocitos marcados.
Efecto sobre la prueba
Mecanismo de interacción
Dis minución de captación del
Inhibe la adherencia de granulocitos en un 40% y s uprime la pres encia de leucocitos
radiofármaco en abs ces os .
polimorfonucleares en los s itios de inflamación(144).
Dis minución de captación del
Corticoides .
Dis minuye la quimiotaxis de los leucocitos polimorfonucleares (145).
radiofármaco en abs ces os .
Dis minución de captación del
Afectan adherencia de granulocitos (146).
radiofármaco en abs ces os .
AINEsAminoglucós idos Afectan la vis ualización de la
Alteración de la dis tribución de neutrófilos (143).
Dis minución del rendimiento de
Ciclos porina.
Dis minuye la s íntes is predominantemente de linfocitos T-helper (146).
Dis minución del rendimiento de
Caus a leucopenia y agranulocitos is (146).
Dis minución del rendimiento de
Dis minuye la neutropoyes is (147).
Dis minución del rendimiento de
Caus an neutro y leucopenia (147).
Ciclofos famida.
Dis minución del rendimiento de
Impide quimiotaxis .
Inhibe la activación del complemento y la migración de linfocitos (147).
El 111In-penteotride es un neuropéptido análogo de la somatostatina, por lo que se localiza por la unión específica a susreceptores. Será captado y se visualizará en imágenes en aquel os tejidos donde, como consecuencia de la enfermedad, lassuperficies celulares contienen una cantidad de receptores superior a la densidad fisiológica normal, por lo que se ha utilizadoen la detección de tumores carcinoides neuroendocrinos del tracto gastrointestinal y procedentes de tejidos embriológicamentederivados de la cresta neural. La principal interacción se producirá con péptidos análogos como el caso del octreotide, quecausan disminución de la captación en hígado, riñón y bazo (Tabla 17).
Tabla 17. Fármacos que interfieren con estudios usando penteotride.
Efecto sobre la prueba
Mecanismo de interacción
Octreotide y otros análogos de la
Dis minuye la captación del radiofármaco en Competencia por los receptores de la s omatos tatina
s omatos tatina.
del tumor (148).
El IBZM es un antagonista de los receptores dopaminérgicos postsinápticos D2 usado para estudios cerebrales, por lo tantotodos aquel os fármacos con afinidad específica por los receptores D2, como los antipsicóticos, competirán con esteradiotrazador. Tiene una marcada captación fisiológica en ganglios basales y, en menor grado, en cerebelo y córtex.
El IBZM marcado ha sido empleado en la esquizofrenia a fin de monitorizar la ocupación de los receptores D2 por los fármacosantipsicóticos. Al utilizar este radiofármaco, debe tenerse en cuenta el efecto sobre su captación que pueden presentar losneurolépticos a largo plazo después de su retirada (Tabla 18). Se han descrito casos de pacientes a los que se les realizóSPECT-IBZM después de un mes y medio de retirada del decanoato de flufenazina y aún mostraban un porcentaje de ocupaciónde 50-83%(149) . Existe una correlación entre la relación estriado/córtex en el estudio SPECT y la dosis diaria óptima deantipsicóticos: cuando los receptores no están totalmente saturados puede emplearse mayor dosis farmacológica, sin embargocuando los receptores se encuentran saturados debe cambiarse la medicación a fármacos no bloqueantes de receptores D2.
Por tanto, esta técnica puede ser usada para determinar el nivel de ocupación de receptores D2 por la dopamina en pacientesen tratamiento con distintos neurolépticos y antipsicóticos, con el objetivo de ajustar la dosis y conseguir un nivel de ocupaciónidónea de dopamina comparable con individuos sanos. En un estudio que comparó sujetos sanos con pacientes esquizofrénicoslibres de medicación y en tratamiento con dos antipsicóticos atípicos, olanzapina y risperidona, se concluyó que la ocupaciónóptima por la medicación antipsicótica debe ser de un 48%(150) .
En la enfermedad de Parkinson y en los parkinsonismos, el 123I-IBZM SPECT se utiliza como control para predecir la respuesta a
los agonistas dopaminérgicos como la L-DOPA. En el parkinsonismo con respuesta al tratamiento con L-DOPA no haydisminución de densidad de receptores, a diferencia con las atrofias multisistémicas y la parálisis supranuclear progresiva.
Tabla 18. Fármacos que interfieren con estudios usando IBZM.
Mecanismo de
Efecto sobre la prueba
Dis minución de la captación en los ganglios
Reducida unión al
Bloqueantes de canales de calcio: cinnarizine y flunarizine.
Neurolépticos : haloperidol, s ulpiride, raclopride y clorpromazina.
Dis minución de la captación.
competencia (151).
Antips icóticos .
Dis minución de la captación.
competencia (149).
Agonis tas dopaminérgicos : pergolida, bromocriptina, lis urida y
Dis minución de la captación.
competencia (152).
El ioflupano pertenece a un grupo de compuestos derivados de la cocaína que se unen a los transportadores de dopamina. Lacaptación en el cerebro es rápida y aproximadamente el 30 % de la actividad total se atribuye a la captación por el cuerpoestriado.
El 123I-ioflupano está indicado para detectar la pérdida de terminaciones nerviosas dopaminérgicas funcionales en el cuerpoestriado de pacientes con síndromes parkinsonianos clínicamente dudosos, para ayudar a diferenciarlos del temblor esencial. Laenfermedad de Parkinson es una dolencia neurodegenerativa caracterizada anatomopatológicamente por la degeneración deneuronas dopaminérgicas en la sustancia nigroestriada. El hecho de que los síntomas del Parkinson puedan presentarsetambién en pacientes con temblor esencial o sean consecuencia del uso de determinados fármacos, como agentesantipsicóticos, dificulta el diagnóstico preciso de esta enfermedad.
Los fármacos que presentan afinidad por el transportador de la dopamina deben retirarse antes de la realización de la prueba(Tabla 19), ya que esta interferencia se traduce en una menor captación del ioflupano y proporciona imágenes de pocaintensidad.
Tabla 19. Fármacos que interfieren con estudios usando ioflupano.
Efecto sobre la
Mecanismo de interacción
MetaanfetaminasAnfetaminas : fenterminaDextroanfetaminasPs icoes timulantes ilegales : cocaínaPs icoes timulantes para obes idad: dietilpropion, mazindol,
Alteración de la
Compiten con el radiofármaco por el mis mo
trans portador (153).
Antidepres ivos no tricíclicos :BupropiónAnticolinérgicos : benzotropinaPs icoes timulante: metilfenidatoAntidepres ivo: s ertralina.
La FDG es el radiofármaco que más comúnmente se utiliza en tomografía por emisión de positrones (PET). Esto se debe, por unlado, a las buenas características físicas del 18F y a la rapidez de su síntesis y por otro, a sus características metabólicas.
Después de la inyección intravenosa, la captación celular de la FDG se realiza por un sistema transportador tisular específico,que es en parte insulino-dependiente y por lo tanto puede estar influenciado por las condiciones nutricionales y la existencia dediabetes mel itus. Atraviesa la membrana celular gracias a los mismos transportadores que utiliza la glucosa, pero una vez en elinterior de la célula sólo experimenta el primer paso de la glicólisis, con el consiguiente atrapamiento metabólico.
Todos los medicamentos que modifiquen las concentraciones séricas de glucosa pueden afectar a la sensibilidad de laexploración (Tabla 20), por ejemplo corticosteroides, valproato, carbamacepina, fenitoína, fenobarbital y catecolaminas(154) .
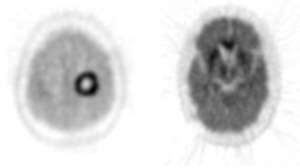
Tabla 20. Fármacos que interfieren con estudios usando FDG.
Efecto sobre la prueba
Mecanismo de interacción
Incremento de la actividad metabólica de la
Alteraciones de la imagen de hues o y médula ós ea (155).
médula ós ea.
Incremento de la actividad de la médula ós ea.
Alteraciones de la imagen de bazo y médula ós ea (156).
Dejar intervalo mínimo de 5 días .
Dis minuye la tas a metabólica en regiones
Dis minución de la captación en SNC.
corticales (157).
Dis minuye la tas a metabólica del córtex
Corticos teroides .
Dis minución de la captación en SNC.
contralateral a un tumor (fig. 6)(158, 159).
Aumenta la captación en núcleo caudado, putamen y tálamo.
Interacción a nivel de receptores D2
Dis minuye el metabolis mo en la corteza frontal.
pos ts inápticos (160).
Figura 6. Estudios de PET cerebral realizados con 370 MBq de 18F-FDG de un
paciente con tumor cerebral en tratamiento con 2 mg/8 h de hidrocortisona
durante las 3 semanas previas al PET y de un paciente en tratamiento con
6mg/8h dexametasona durante los dos meses previos, respectivamente. En
ambos se observa disminución de captación de FDG, de carácter difuso y
homogéneo en todo córtex.
01. Hladik WB 3rd, Nigg KK, Rhodes BA. Drug-induced changes in the biologic distribution of
radiopharmaceuticals. Semin Nucl Med 1982;12:184-218.
02. Sampson CB. Patient medication and nuclear medicine tests: A pharmacist's viewpoint. Nuc Med Commun
03. Owunwanne A, Shihab-Eldeen A, Yacoub T, Ziada G. The use of radiopharmaceuticals as an effective
toxicologic technique for studying nephrotoxicity of drugs: cyclosporine-A. Hum Exp Toxicol 1998;17:613-9.
04. Hommeyer SH, Varney DM, Eary JF. Skeletal nonvisualization in a bone scan secondary to intravenous
etidronate therapy. J Nucl Med 1992;33:748-50.
05. Murphy KJ, Line BR, Malfetano J. Etidronate therapy decreases the sensitivity of bone scanning with
methylene diphosphonate label ed with technetium-99m. Can Assoc Radiol J 1997;48:199-202.
06. Pecherstorfer M, Schil ing T, Janisch S, Woloszczuk W, Baumgartner G, Ziegler R, et al. Effect of clodronate
treatment on bone scintigraphy in metastatic breast cancer. J Nucl Med 1993;34:1039-44.
07. Park CH, Kim HS, Shin HY, Kim HC. Hepatic uptake of Tc-99m MDP on bone scintigraphy from intravenous
iron therapy (Blutal). Clin Nucl Med 1997;22:762-4.
08. Eshima M, Shiozaki H, Ishino Y, Nakata H. Diffuse liver uptake of Tc-99m phosphate compound associated
with intravenous injection of iron col oid solution. Clin Nucl Med 1993;18:348-9.
09. Choy D, Murray IP, Hoschl R. The effect of iron on the biodistribution of bone scanning agents in humans.
10. Cronhjort M, Saaf M, Sjoberg HE, Schnel PO, Jacobsson H. Influence of the phosphate balance on the
activity distribution of 99mTc-hydroxy-methylene diphosphonate. Experimental studies in the mouse. ActaRadiol 1998;39:427-33.
11. Lutrin Cl, Mc Dougal IR, Goris MI. Intense concentration of Tc-99m pyrophosphate in the kidneys of children
treated with chemotherapeutic drugs for malignant disease. Radiology 1978;128:165-7.
12. Malani PN, Depestel DD, Riddel J, Bickley S, Klein LR, Kauffman CA. Experience with community-based
amphotericin B infusion therapy. Pharmacotherapy 2005;25:690-7.
13. Chen WL, Perng MY, Hwei DZ, Yu MD. Therapeutic drug monitoring can avoid iatrogenic alterations caused
by 99mTc-methylene diphosphonate (MDP)-gentamicin interaction. J Nucl Biol Med 1994;38(Suppl 1):132-
14. McAfee JG, Singh A, Roskoopf M, Ritter C, Lyons B, Schoonmaker JF. Experimental drug-induced changes in
renal function and biodistribution of 99mTc-MDP. Invest Radiol 1983;18:470-8.
15. Zimmer AM, Pavel DG. Experimental investigations of the possible cause of liver appearance during bone
scanning. Radiology 1978;126:813-6.
16. Palmer AM, Watt I, Dieppe PA. Soft-tissue localization of 99mTc-hydroxymethylene diphosphonate due to
interaction with calcium. Clin Radiol 1992;45:326-30.
17. Schmitt GH, Holmes RA, Isitman AT, Hensley GT, Lewis JD. A proposed mechanism for 99mTc-labeled
polyphosphate and diphosphonate uptake by human breast tissue. Radiology 1974;112:733-5.
18. Hugues FC, Gourlot C, Le Jeunne C. Drug-induced ginecomastia. Ann Med Interne 2000;151:10-7.
19. Scott S, Alazraki N, Manaster B. Failure of bone scanning to detect fractures in a woman on chronic steroid
therapy. Skeletal Radiol 1984;12:204-7.
20. Van Renterghem D, De Reuck J, Schelstraete K, Elinck W, Van Der Straeten M. Epsilon amino caproic acid
myopathy: additional features. Clin Neurol Neurosurg 1984;86:153-7.
21. Murphy KJ, Line BR, Malfetano J. Etidronate therapy decreases the sensitivity of bone scanning with
methylene diphosphonate label ed with technetium-99m. Can Assoc Radiol J 1997;48:199-202.
22. Hiltz A, Iles SE. Abnormal distribution of Tc-99m iminodiphosphonate due to iron dextran therapy. Clin Nucl
Med 1990;15:818-20.
23. Carr EA Jr, Carrol M, Montes M. Effect of vitamin D3, other drugs altering serum calcium or phosphorus
concentrations, and desoxycorticosterone on the distribution of Tc-99m pyrophosphate between target andnontarget tissues. J Nucl Med 1981;22:526-34.
24. Mathov I, Plotkin LI, Sgarlata CL, Leoni J, Bel ido T. Extracel ular signal-regulated kinases and calcium
channels are involved in the proliferative effect of bisphosphonates on osteoblastic cel s in vitro. J Bone MinerRes 2001;16:2050-6.
25. Salgia R, Demetri GD, Kaplan WD. Changes in Tc-99m radionuclide bone scan images and peripheralization
of marrow hematopoietic activity associated with the administration of granulocyte colony stimulatingfactor as an adjunct to dose-intensified chemotherapy for breast cancer. A case report. Cancer1994;74:1887-90.
26. Flynn BM, Treves ST. Diffuse hepatic uptake of technetium-99m methylene diphosphonate in a patient
receiving high dose methotrexate. J Nucl Med 1987;28:532-4.
27. Subramanian G, McAfee JG, Blair RJ, Kal felz FA, Thomas FD. Technetium-99m-methylene diphosphonate - a
superior agent for skeletal imaging: comparison with other technetium complexes. J Nucl Med1975;16:744-55.
28. Eisenberg B, Owens D, Stewart DL, Wil iamson MR. PYP Maalox localization in liver and spleen. Clin Nucl
Med 1989;14:636.
29. Chacko AK, Gordon DH, Bennett JM, O'Mara RE, Wilson GA. Myocardial imaging with Tc-99m pyrophosphate
in patients on adriamycin treatment for neoplasia. J Nucl Med 1977;18:680-3.
30. Fujita N, Hiroe M, Suzuki Y, Sato H, Inoue Y, Sekiguchi M, et al. A case with cardiac sarcoidosis. Significance
of the effect of steroids on the reversion of advanced atrioventricular block and myocardial scintigraphicabnormalities. Heart Vessels Suppl 1990;5:16-8.
31. Schneider RM, Hayslett JP, Downing SE, Berger HJ, Donabedian RK, Zaret BL Effect of methylprednisolone
upon technetium-99m pyrophosphate assessment myocardial necrosis in the canine countershock model.
Circulation 1977;56:1029-34.
32. Candel J, Castel J, Jurado J, López de Sá E, Nuño de la Rosa J, Ortigosa F et al. Guías de actuación clínica de
la Sociedad Española de Cardiología. Cardiología nuclear: bases técnicas y aplicaciones clínicas. Rev EspCardiol 1999;52:957-989.
33. Tail efer R, Ahlberg AW, Masood Y, White CM, Lamargese I, Mather JF et al. Acute beta-blockade reduces
the extent and severity of myocardial perfusion defects with dipyridamole Tc-99m sestamibi SPECTimaging. J Am Col Cardiol 2003;42:1475-83.
34. Narahara KA, Thomson CJ, Hazen JF, Brizendine M, Mena I. The effect of beta blockade on single photon
emission computed tomographic (SPECT) thal ium-201 images in patients with coronary disease. Am Heart
J 1989;117:1030-5.
35. Sharir T, Rabinowitz B, Livschitz S, Moalem I, Baron J, Kaplinsky E, Chouraqui P. Underestimation of extent
and severity of coronary artery disease by dipyridamole stress thal ium-201 single-photon emissioncomputed tomographic myocardial perfusion imaging in patients taking antianginal drugs. Jam Col Cardiol1998;31:1540-6.
36. Satwani S, Dec GW, Narula J. Beta-adrenergic blockers in heart failure: review of mechanisms of action and
clinical outcomes. J Cardiovasc Pharmacol Ther 2004;9:243-55.
37. Fung HL. Clinical pharmacology of organic nitrates. Am J Cardiol 1993;72:9C-13C.
38. Dewitt CR, Waksman JC. Pharmacology, pathophysiology and management of calcium channel blocker and
beta-blocker toxicity. Toxicol Rev 2004;23:223-38.
39. Sarin B, Chugh PK, Kaushal D, Soni NL, Sawroop K, Mondal A et al. Sodium bicarbonate-augmented stress
thal ium myocardial scintigraphy. Eur J Nucl Med Mol Imaging 2004;31:475-81.
40. Laine H, Sundel J, Nuutila P, Raitakari OT, Luotolahti M, Rönnemaa T. Insulin induced increase in coronary
flow reserve is abolished by dexamethasone in young men with uncomplicated type 1 diabetes. Heart2004;90:270-6.
41. Waschek J, Hinkle G, Basmadjian G, Al en EW, Ice R. Effect of cardiac drugs on imaging studies with thal ous
chloride Tl 201. Am J Hosp Pharm 1981;38:1726-8.
42. Keenan SM, DeLisle RK, Welsh WJ, Paula S, Bal WJ Jr.Elucidation of the Na+, K+-ATPase digitalis binding
site. J Mol Graph Model 2005;23:465-75.
43. Hardenbergh PH, Munley MT, Bentel GC, Kedem R, Borges-Neto S, Hol is D et al. Cardiac perfusion changes
in patients treated for breast cancer with radiation therapy and doxorubicin: preliminary results. Int J RadiatOncol Biol Phys 2001;49:1023-8.
44. Hesslewood S, Leung E. Drug interactions with radiopharmaceuticals. Eur J Nucl Med 1994;21:348-56.
45. Gilman AG, Ral TW, Nies AS (eds). Goodman and Gilman's The Pharmacological Basis of Therapeutics (8th
ed). Pergamon Press, New York, NY, 1990.
46. Nascimento Cardoso V, Roca M, Martín-Comín J. No influence of propanolol, cyclosporine, adriamycin, and
nifedipine on the in vitro label ing of erythrocytes. Rev Esp Med Nucl 2002;21:24-7.
47. Porter WC, Dees SM, Freitas JE, Dworkin HJ. Acid-citrate-dextrose compared with heparin in the preparation
of in vivo/in vitro technetium-99m red blood cel s. J Nucl Med 1983;24:383-7.
48. Sampson CB. Adverse reactions and drug interactions with radiopharmaceuticals. Drug Safety 1993;8:280-
49. Lee HB, Wexler JP, Scharf SC, Blaufox MD. Pharmacologic alterations in Tc-99m binding by red blood cel s:
concise communication. J Nucl Med 1983;24:397-401.
50. White PM, Mann A, Dawn M, Hel er GV. Evaluation of 99mTechnetium red blood cel s label ing efficiency in
adults receiving chemotherapy and the clinical impact in pediatric oncology patients. J Nucl Med Technol1998;26:265-8.
51. Sampson CB. Complications and difficulties in radiolabel ing blood cel s: a review. Nucl Med Commun
52. Tatum JL, Burke TS, Hirsch JI, Miler WW, Fratkin MJ. Pitfal to modified in vivo method of technetium-99m red
blood cel labeling: Iodinated contrast media. Clin Nucl Med 1983;8:585-7.
53. Fang GX, Chan PCK, Cheng IKP. Haematological changes after renal transplantation: differences between
cyclosporin-A and azathioprine therapy. Int Urol Nephrol 1990;22:181-7.
54. Mechanick JI. Coombs' positive hemolytic anemia fol owing sulfasalazine therapy in ulcerative colitis: case
reports, review and discussion of pathogenesis. Mt Sinai J Med 1985;52:667-70.
55. Stimac D, Milic S, Dintinjana RD, Kovac D, Ristic S. Androgenic/anabolic steroid-induced toxic hepatitis. J Clin
56. Zafrani ES, Pinaudeau Y, Dhumeaux D. Drug-induced vascular lesions of the liver. Arch Intern Med
57. Focal nodular hyperplasia associated with the use of a synthetic anabolic androgen. Am J Gastroenterol
58. Mettlin C. Studies on the role of oral contraceptive use in the etiology of benign and malignant liver tumors. J
Surg Oncol 1981;18:73-85.
59. Vana J, Murphy G, Aronoff BL, Baker HW. Primary liver tumors and oral contraceptives. Results of a survey.
60. Bobinet DD, Sevrin R, Zurbriggen MT, Spolter L, Cohen MB. Lung uptake of 99mTc-sulfur col oid in patient
exhibiting presence of Al3+ in plasma. J Nucl Med 1974;15:1220-2.
61. Malmud LS, Charkes ND, Littlefield J, Reil ey J, Stern H, Rosenberg R et al. The mode of action alginic acid
compound in the reduction of gastroesophageal reflux. J Nucl Med 1979;20:1023-8.
62. Malmud LS, Fisher RS. The evaluation of gastroesophageal reflux before and after medical therapies. Semin
Nucl Med 1981;11:205-15.
63. Marano AR, Caride VJ, Prokop EK, Troncale FJ, McCal um RW. Effect of sucralfate and an aluminum
hydroxide gel on gastric emptying of solids and liquids. Clin Pharmacol Ther 1985;37:629-32.
64. Kaplan WD, Drum DE, Lokich J. The effect of cancer chemotherapeutic agents on the liver-spleen scan. J
Nucl Med 1980;21:84-7.
65. King PD, Perry MC. Hepatotoxicity of chemotherapy. Oncologist 2001;6:162-76.
66. Lentle BC, Scott JR, Noujaim AA, Jackson FI . Iatrogenic alterations in radionuclide biodistributions. Semin
Nucl Med 1979;9:131-43.
67. Vil eneuve JP, Pichette V. Cytochrome P450 and liver diseases. Curr Drug Metab 2004;5:273-82.
68. Hasan F. Isoflurane hepatotoxicity in a patient with a previous history of halothane-induced hepatitis.
69. Keyes JW Jr, Wilson GA, Quinonest JD. An evaluation of lung uptake of col oid during liver imaging. J Nucl Med
70. Beatson N. Atropine and paralytic ileus. Postgrad Med J 1982;58:451-3.
71. Wood JD, Gal igan J. Function of opioids in the enteric nervous system. Neurogastroenterol Motil 2004;16
(Suppl 2):17-28.
72. Penagini R, Al occa M, Cantu P, Mangano M, Savojardo D, Carmagnola S. Relationship between motor
function of the proximal stomach and transient lower oesophageal sphincter relaxation after morphine. Gut2004;53:1227-31.
73. Banzo I. Gammagrafía hepatobiliar: metodología y aplicaciones clínicas. Rev Esp Med Nuclear 1998;17:122-
74. Lorberhoym M, Simon J, Horne T. The role of morphine-augmented cholescintigraphy and real-time
ultrasound in detecting gal bladder disease. J Nucl Med Technol 1999;27:294-7.
75. Pedersen SA, Oster-Jorgensen E, Kraglund K. The effects of morphine on biliary dynamics. A scintigraphic
study with 99mTc-HIDA. Scand J Gastroenterol 1987;22:982-6.
76. Coenegracht JM, Oei TL, van Breda Vriesman PJ. The influence of bilirubin, alcohol and certain drugs on the
kinetics of 99mTc-Diethyl IDA (EHIDA) in humans. Eur J Nucl Med 1983;8:140-4.
77. Shafer RB, Knodel RG, Stanley LN, Elson MK. Acute effects of nicotinic acid on hepatic transport of 99mTc-
PIPIDA. Eur J Nucl Med 1983;8:12-4.
78. Curran TJ, Uzoaru I, Das JB, Ansari G, Raffensperger JG. The effect of cholecystokinin-octapeptide on the
hepatobiliary dysfunction caused by total parenteral nutrition. J Pediatr Surg 1995;30:242-6.
79. Llamas-Elvira JM, Sopena R, Martínez-Paredes M, Jimenez-Hefferman A, González FM, Torres M et al.
Muscarinic control of gal bladder dynamics. A study using 99Tcm-HIDA and cholinergic agonists andantagonists. Nucl Med Commun 1990;11:813-7.
80. Kostrubsky VE, Strom SC, Hanson J, Urda E, Rose K, Burliegh J et al. Evaluation of hepatotoxic potential of
drugs by inhibition of bile-acid transport in cultured primary human hepatocytes and intact rats. Toxicol Sci2003;76:220-8.
81. Wilkinson NW, Gustafson RJ, Frizzi JD. The effect of erythromycin on bile excretion and proximal smal bowel
motility fol owing divided gastric bypass surgery: a prospective randomized placebo-control ed trial. ObesSurg 2002;12:765-72.
82. Patel NJ, Zamek-Gliszcynski MJ, Zhang P, Han YH, Jansen PL, Meier PJ et al. Phenobarbital alters hepatic
Mrp2 function by direct and indirect interactions. Mol Pharmacol 2003;64:154-9.
83. Majd M, Reba RC, Altman RP. Effect of phenobarbital on 99mTc-IDA scintigraphy in the evaluation of
neonatal jaundice. Semin Nucl Med 1981;11:194-204.
84. Owunwanne A, Shihab-Eldeen A, Yacoub T, Ziada G. The use of radiopharmaceuticals as an effective
toxicologic technique for studying nephrotoxicity of drugs: cyclosporine-A. Hum Exp Toxicol 1998;17:613-9.
85. Lora-Michiels M, Anzola K, Amaya G, Solano M. Quantitative and qualitative scintigraphic measurement of
renal function in dogs exposed to toxic doses of Gentamicin. Vet Radiol Ultrasound 2001;42:553-61.
86. Herzog KM, Deutsch E, Deutsch K, Silberstein EB, Sarangarajan R, Cacini W. Synthesis and renal excretion
of technetium-99m-labeled organic cations. J Nucl Med 1992;33:2190-5.
87. Ludwig V, Martin WH, Delbeke D. Calcium channel blockers: a potential cause of false-positive captopril
renography. Clin Nucl Med 2003;28:108-12.
88. Claveau-Tremblay R, Turpin S, De Braekeleer M, Brassard A, Leblond R. False-positive captopril renography
in patients taking calcium antagonists. J Nucl Med 1998;39:1621-6.
89. Gomes ML, de Mattos DM, de Souza Freitas R, Bezerra RJ, Bernardo-Filho M. Study of the toxicological
effect of mitomycin C in mice: alteration on the biodistribution of radiopharmaceuticals used for renalevaluations. Hum Exp Toxicol 2001;20:193-7.
90. Yee CA, Lee HB, Blaufox MD. Tc-99m DMSA renal uptake: influence of biochemical and physiologic factors. J
Nucl Med 1981;22:1054-8.
91. Green DA, Davies SG. Dimercaptosuccinic acid distribution in renal tubular acidosis. Br J Radiol.
92. Acosta Gomez MJ, Llamas Elvira JM, Rodriguez Fernandez A, Gomez Rio M, Lopez Ruiz JM, Muros De
Fuentes MA, et al. Diagnosis of renovascular hypertension by pre- and post-captopril renal scintigraphy with99mTc-DMSA. Rev Esp Med Nucl 2001;20:537-43.
93. Pelosi E, Masaneo I, Clara R, Valetto MR, Bel o M, Zanon C. Technetium-99m label ed macroaggregated
albumin arterial catheter perfusion scintigraphy: prediction of gastrointestinal toxicity in hepatic arterialchemotherapy. Eur J Nucl Med 2000;27:668-75.
94. Basoglu T, Erkan L, Canbaz F, Bernay I, Onen T, Sahin M et al. Transient reverse ventilation-perfusion
mismatch in acute pulmonary nitrofurantoin reaction. Ann Nucl Med 1997;11:271-4.
95. Jankovic DL, Djokic DDj Alteration of the organ uptake of the (99m)Tc-radiopharmaceuticals, (99m)Tc-DPD,
(99m)Tc-DMSA, (99m)Tc-tin col oid and (99m)Tc-MAA, induced by the applied cytotoxic drugsmethotrexate sodium and cyclophosphamide. Nucl Med Commun 2005;26:415-9.
96. Sovijarvi AR, Poyhonen L, Kel omaki L, Muittari A. Effects of acute and long-term bronchodilator treatment
on regional lung function in asthma assessed with krypton-81m and technetium-99m-label edmacroaggregates. Thorax 1982;37:516-20.
97. Datz FL, Christian PE, Hutson WR, Moore JG, Morton KA. Physiological and pharmacological interventions in
radionuclide imaging of the tubular gastrointestinal tract. Semin Nucl Med 1991;21:140-52.
98. Wang TS, Fawwaz RA, Esser PD, Johnson PM. Altered body distribution of [99mTc] pertechnetate in
iatrogenic hyperaluminemia. J Nucl Med 1978;19:381-3.
99. Duszynski DO, Jewett TC, Al en JE. Tc 99m Na pertechnetate scanning of the abdomen with particular
reference to smal bowel pathology. Am J Roentgenol Radium Ther Nucl Med 1971;113:258-62.
100. Francis MD, Slough CL, Tofe AJ. Factors affecting uptake and retention of technetium-99m-diphosphonate
and 99m-pertechnetate in osseous, connective and soft tissues. Calcif Tissue Res 1976;20:303-11.
101. Khettery J, Effmann E, Grand RJ, Treves S. Effect of pentagastrin, histalog, glucagon, secretin, and
perchlorate on the gastric handling of 99mTc pertechnetate in mice. Radiology 1976;120:629-31.
102. Sfakianakis GN, Conway J. Detection of ectopic gastric mucosa in Meckel's diverticulum and other
aberrations by scintigraphy: I. Pathophysiology and 10 year clinical experience. J Nucl Med 1981;22:647-54.
103. Yeker D. Radionuclide imaging of Meckel's diverticulum: cimetidine versus pentagastrine plus glucagon. Eur J
Nucl Med 1984;9:316-9.
104. Castronuovo J, Chervu LR, Milstein DM. Altered distribution of technetium-99m sodium pertechnetate
associated with antimicrobial therapy. Clin Nucl Med 1985;10:868-71.
105. Specht HD, Belsey R, Hanada J. Aluminemic disturbance of technetium-99m DTPA renal function
measurement. J Nucl Med 1987;28:383-6.
106. Inou Y, Momose T, Machida K, Honda N, Mamiya T, Takahashy T. A new method for monitoring the
cerebrovascular response to acetazolamide using 99mTc-DTPA-HSA. Radiat Med 1992;10:45-7.
107. McAfee JG, Thomas FD, Subramanian G, Roskopf M, Hel wing B. Evaluation of cyclosporine nephrotoxicity in
rats with various renal radioactive agents. J Nucl Med 1988;29:1577-81.
108. Gomes ML, de Mattos DM, de Souza Freitas R, Bezerra RJ, Bernardo-Filho M. Study of the toxicological
effect of mitomycin C in mice: alteration on the biodistribution of radiopharmaceuticals used for renalevaluations. Hum Exp Toxicol 2001;20:193-7.
109. Dirlik A, Erinc R, Ozcan Z, Atasever A, Bacakoglu F, Nalbantgil S et al. Technetium-99m-DTPA aerosol
scintigraphy in amiodarone induced pulmonary toxicity in comparison with Ga-67 scintigraphy. Ann NuclMed 2002;16:477-81.
110. Fischer M, Vetter W, Winterg B, Zidek W, Vetter H. Adrenal scintigraphy in primary aldosteronism.
Spironolactone as a cause of incorrect classification between adenoma and hyperplasia. Eur J Nucl Med1982;7:222-4.
111. Mila Lopez M, Castel -Conesa J, Pifarre Montaner P, Lorenzo Bosquet C, Garcia-Buril o A, Porta Biosca F.
Adrenal cortex scintigraphy with and without dexamethasone suppression in the study of primaryaldosteronism. Rev Esp Med Nucl 2004;23:324-9.
112. Shapiro B, Grekin R, Gross MD, Freitas JE. Interference by spironolactone on adrenocortical scintigraphy and
other pitfal s in the location of adrenal abnormalities in primary aldosteronism. Clin Nucl Med 1994;19:441-5.
113. Gross MD, Valk TW, Swanson DP, Thral JH, Grekin RJ, Beirewaltes WH. The role of parmacologic
manipulation in adrenal cortical scintigraphy. Semin Nucl Med 1981;11:128-48.
114. Hoefnagel CA, Schornagel J, Valdes Olmos RA. [131I]metaiodobenzylguanidine therapy of malignant
pheochromocytoma: interference of medication. J Nucl Biol Med 1991;35:308-12.
115. Wafelman AR, Hoefnagel CA, Maes RA, Beijnen JH. Radioiodinated metaiodobenzylguanidine: a review of its
biodistribution and pharmacokinetics, drug interactions, cytotoxicity and dosimetry. Eur J Nucl Med1994;21:545-59.
116. Solanki KK, Bomanji J, Moyes J, Mather SJ, Trainer PJ, Britton KE. A pharmacological guide to medicines which
interfere with the biodistribution of radiolabel ed meta-iodobenzylguanidine (MIBG). Nucl Med Commun1992;13:513-21.
117. Apeldoom L, Voerman HJ, Hoefnagel CA. Interference of MIBG uptake by medication: a case report. Neth J
Med 1995;46:239-43.
118. Khafagi FA, Shapiro B, Fig LM, Mal ette S, Sisson JC. Labetalol reduces iodine-131 MIBG uptake by
pheochromocytoma and normal tissues. J Nucl Med 1989;30:481-9.
119. C Sampol Bas; C Peña Viloria. Captación de 123I-MIBG en un hemangioma hepático en el estudio
gammagráfico de una lesión suprarrenal. Rev Esp Med Nucl 2005;24:191-4.
120. Chilton HM, Witcofski RL, Watson NE Jr, Heise CM. Alteration of gal ium-67 distribution in tumor bearing mice
fol owing treatment with methotrexate: concise comunication. J Nucl Med 1981;22:1064-8.
121. Lentle BC, Starreveld E, Catz Z, Penney H, Turner AR. Abnormal biodistribution of radiogal ium in persons
treated with phenytoin. J Can Assoc Radiol 1983;34:114-5.
122. Khan AS, Dadparvar S, Brown SJ, Slizofski WJ, Roman R, Krishna L, Meihoffer M. The role of gal ium-67-
citrate in the detection of phenytoin-induced pneumonitis. J Nucl Med 1994;35:471-3.
123. Moinuddin M. Radionuclide scanning in the detection of drug-induced lung disorders. J Thorac Imaging
124. Fukuchi K, Sasaki H, Yokoya T, Noguchi T, Goto Y, Hayashida K et al. Ga-67 citrate and F-18 FDG uptake in
spironolactone-induced gynecomastia. Clin Nucl Med 2005;30:105-6.
125. Kumar M, Abdel-Dayem HM, Naddaf S. Ga-67 uptake by the male breast under digitalis influence
(Abstract). Clin Nucl Med 1998;23:779.
126. Baker DL, Manno CS. Rapid excretion of gal ium-67 isotope in an iron-overloaded receiving high–dose
intravenous deferoxamine. Am J Hematol 1988;29:230-2.
127. Loesberg AC, Martin WB. Altered biodistribution of Ga-67 citrate in an iron-overloaded with sickle cel
disease. Clin Nucl Med 1994;19:157-9.
128. Gorenberg M, Groshar D, Even Sapir E. Ga-67 uptake unsuppressed by leukopenia and intense antibiotic
therapy. Clin Nucl Med 1992;17:97-8.
129. Wood BC, Sharman JN, Germann DR, Wood WG, Crouch TT. Gal ium citrate Ga 67 imaging in noninfectious
interstitial nephritis. Arch Intern Med 1978;138:1665-6.
130. Handa SP. Drug-induced acute interstitial nephritis: report of 10 cases. CMAJ 1986;135:1278-81.
131. Hatfield MK, Martin WB, Ryan JW, Vokes EE, Vogelzang NJ. Cardiac gal ium uptake in doxorubicin-induced
cardiotoxicity. Clin Nucl Med 1986;11:756-7.
132. Waxman AD, Beldon JR, Richli W, Tanasescu DE, Siemsen JK. Steroid-induced suppression of gal ium uptake
in tumors of the central nervous system: concise communication. Nucl Med 1978;19:480-2.
133. Moult RG, Bekerman C. Altered biodistribution of Ga-67 by intramuscular gold salts. Clin Nucl Med
134. Noujaim AA, Turner CJ, Scott J. The effect of amphotericin B on 67Ga biodistribution. Int J Nucl Biol
135. Bomber P, McReady R, Hammersley P. Propranolol hydrochloride enhancement of tumor perfusion and
uptake of gal iun-67 in a mouse sarcoma. J Nucl Med 1986;27:243-5.
136. Brown SJ, Slizofski WJ, Dadparvar S. Altered biodistribution of gal ium-67 in a patient with aluminum toxicity
treated with desferoxamine. J Nucl Med 1990;31:115-7.
137. Zuckier LS, Dohan O, Li Y, Chang CJ, Carrasco N, Dadachova E. Kinetics of perrhenate uptake and
comparative biodistribution of perrhenate, pertechnetate, and iodide by NaI symporter-expressing tissues invivo. J Nucl Med 2004;45:500-7.
138. Grayson RR. Factors which influence the radioactive iodine thyroidal uptake test. Am J Med 1960;28:397-
139. Moka D, Dietlein M, Schicha H. Radioiodine therapy and thyrostatic drugs and iodine. Eur J Nucl Med Mol
Imaging 2002;29 (Suppl 2):S486-91.
140. Summary of Product characteristics for Theracap131 TM, capsule.
141. Yu MD, Shaw SM. Potential interference of agents on radioiodide thyroid uptake in the euthyroid rat. J Nucl
Med 2003;44:832-8.
142. Laurie AJ, Lyon SG, Lasser EC. Contrast material iodides: potential effects on radioactive iodine thyroid
uptake. J Nucl Med 1992;33:237-8.
143. Chung CJ, Hicklin OA, Payan JM, Gordon L.Indium-111-labeled leukocyte scan in detection of synthetic
vascular graft infection: the effect of antibiotic treatment. J Nucl Med 1991;32:13-5.
144. Vandenbroucke-Grauls CM, Thijssen RM, Marcelis JH, Sharma SD, Verhoef J. Effects of lysosomotropic
amines on human polymorphonuclear leucocyte function. Immunology 1984;51:319-26.
145. Chal a S, Lyons KP, Broekelschen P, Milne N. Relative sensitivity of Tc-99m WBC versus In-111 WBC in a
patient with Crohn disease and steroid use. Clin Nucl Med 1997;22:700-3.
146. Sampson CB. Complications and difficulties in radiolabel ing blood cel s: a review. Nucl Med Commun
147. Sampson CB. Interference of patient medication in the radiolabel ing of white blood cel s: an update. Nucl
Med Commun 1998;19:529-33.
148. Dorr U, Rath U, Sautter-Bihl ML, Guzman G, Bach D, Adrian HJ et al. Improved visualization of carcinoid liver
metastases by indium-111 pentetreotide scintigraphy fol owing treatment with cold somatostatin analogue.
Eur J Nucl Med 1993;20:431-3.
149. Harasko-van der Meer C, Brucke T, Wenger S, Fischer P, Deecke L, Podreka I. Two cases of long term
dopamine D2 receptor blockade after depot neuroleptics. J Neural Transm Gen Sect 1993;94:217-21.
150. Frankle WG, Gil R, Hackett E, Mawlawi O, Zea-Ponce Y, Zhu Z. Occupancy of dopamine D2 receptors by
the atypical antipsychotic drugs risperidone and olanzapine: theoretical implications. Psychopharmacology(Berl) 2004;175:473-80.
151. Tauscher J, Kufferle B, Asenbaum S, Tauscher-Wisniewski S, Kasper S. Striatal dopamine-2 receptor
occupancy as measured with [123I]iodobenzamide and SPECT predicted the occurrence of EPS in patientstreated with atypical antipsychotics and haloperidol. Psychopharmacology (Berl) 2002;162:42-9.
152. Schwarz J, Oertel WH, Tatsch K. Iodine-123-iodobenzamide binding in parkinsonism: reduction by dopamine
agonists but not L-Dopa. J Nucl Med 1996;37:1112-5.
153. Ficha técnica de DATSCAN 74MBq/ml (solución inyectable).
154. Cortés-Blanco A. Especificaciones actuales de la ficha técnica de los radiofármacos fludesoxiglucosa (18F)
autorizados para comercialización en España. Seguridad Nuclear 2006;40:20-8.
155. Blodgett TM, Ames JT, Torok FS, McCook BM. Diffuse bone marrow uptake on whole-body F-18
fluordeoxyglucose positron emission tomography in a patient taking recombinant erythropoietin. Clin NuclMed 2004;29:161-3.
156. Mayer D, Bednarcczyk EM. Interaction of colony stimulating factors and fluordeoxyglucose F18 positron
emission tomography. An Pharmacotherapy 2002;36:1796-9.
157. Theodore WH, Bairamian D, Newmark ME, DiChiro G, Porter RJ, Larson S, Fishbein D. Effect of phenytoin on
human cerebral glucose metabolism. J Cereb Blood Flow 1986;6:315-20.
158. Roelcke U, Blasberg RG, von Ammon K, Hofer S, Vontobel P, Maguire RP. Dexamethasone treatment and
plasma glucose levels: relevance for fluorine-18-fluorodeoxyglucose uptake measurements in gliomas. J NuclMed 1998;39:879-84.
159. Fulham MJ, Brunetti A, Aloj L, Raman R, Dwyer AJ, Di Chiro G. Decreased cerebral glucose metabolism in
patients with brain tumors: an effect of corticosteroids. J Neurosurg 1995;83:657-64.
160. Holcomb HH, Cascel a NG, Thaker GK, Medoff DR, Dannals RF, Tamminga CA. Functional sites of
neuroleptic drug action in the human brain: PET/FDG studies with and without haloperidol. Am J Psychiatry1996;153:41-9.
Source: http://www.radiopharmacy.net/objects/Alteracionesen-la-biodistribucion-de-los-radiofarmacos-causadas-por-interacciones-medicamentosas.pdf
Education in the Round My Vision is Blurry: Could it be from any of the medications that I am taking? Mark T. Dunbar, OD, FAAO Director of Optometry Bascom Palme Eye Institute University of Miami, Miller School of Medicine Miami, FL 33136 Mark Dunbar: Disclosure • Consultant for Allergan • Optometry Advisory Board for:
Diabetes Youth New Zealand National Diabetes Camping Guidelines Diabetes Youth New Zealand National Diabetes Camping Guidelines The Organisation and Management of Camps for Young People with Diabetes, and their Families Produced by Diabetes Youth New Zealand in association with the Starship Paediatric Diabetes Team and the Diabetes Nurse Specialist section of the New Zealand Nurses organisation, and






